Bax介导硼替佐米诱导胃癌细胞株MKN45凋亡作用的研究*
2017-02-07赵羲和李凯邹华伟
赵羲和,李凯,邹华伟
(中国医科大学附属盛京医院第一肿瘤科,辽宁沈阳110022)
论著
Bax介导硼替佐米诱导胃癌细胞株MKN45凋亡作用的研究*
赵羲和,李凯,邹华伟
(中国医科大学附属盛京医院第一肿瘤科,辽宁沈阳110022)
目的验证BCl-2相关X(Bax)蛋白在硼替佐米(BTZ)诱导胃癌细胞株MKN45的凋亡作用。方法以人Bax(NC_000019.10)为靶标设计shRNA序列,将Bax shRNA转染至MKN45细胞中,G418筛选耐药克隆。荧光定量聚合酶链反应和Western blot测定转染前后Bax mRNA和蛋白含量。给予空载体对照MKN45及shBax转染的MKN45细胞BTZ梯度加药(5、25、50、100、250、500和1 000 nmol/L),检测其细胞增殖、凋亡程度。结果通过转染,建立Bax表达稳定下调的MKN45-shBax细胞系。给予BTZ梯度加药后,阴性对照(Mock)组胃癌细胞MKN45 Bax含量增加,凋亡程度逐渐增加,增殖率逐渐降低。沉默Bax后BTZ诱导的MKN45细胞凋亡受到抑制,增殖能力增强。结论Bax能部分介导BTZ对胃癌细胞株MKN45的凋亡作用。
胃癌;硼替佐米;BCl-2相关X;凋亡
胃低分化腺癌的恶性程度相对较高,发现时通常已处于中、晚期,且发病迅速,预后较差,因此胃低分化腺癌的治疗相对困难。早期胃低分化腺癌的治疗以手术切除为主,中、晚期胃低分化腺癌大多已经发生扩散转移,且对化疗不敏感[1]。因此,寻找其治疗靶点,增加化疗敏感性,延长患者生存期,改善生活质量迫在眉睫。目前,手术联合化疗及淋巴结引流区照射是胃癌治疗的主要标准。尽管如此,患者预后差,生存期仍然难以得到明显改善。因此,寻找胃癌治疗的新靶点成为当务之急[2]。
目前,胃癌药物治疗主要集中于化疗药物、靶向分子及病毒载体。针对化疗药物增敏、寻求药物治疗效果的最大化研究也逐渐深入。硼替佐米(Bortezomib,BTZ),商品名万珂(Valcade),是高选择性的可逆性的蛋白酶体抑制剂,临床上主要用于血液系统肿瘤的治疗,近年来,对于一些实体瘤的实验也进入临床前期实验阶段。目前,硼替佐米在细胞及动物实验中可对胃癌起到化疗增敏作用[3]。研究硼替佐米的抑制肿瘤机制,可以有助于更深入地研究,提高胃癌放化疗效果,改善患者的生存时间及生存质量。
1 材料方法
1.1 材料与试剂
人MKN45胃癌细胞购自上海研究院生命科学细胞资源中心,载体构建与质粒合成(shBax)由苏州吉玛公司完成,硼替佐米购自美国Millennium制药公司,Annexin V-PE/7-AAD凋亡检测试剂盒购自美国BD公司,一抗兔单克隆BCl-2相关X(BCL2 associated X,Bax)购自英国Abcam公司。
1.2 仪器与设备
聚丙烯酰胺凝胶电泳装置(美国Bio-Rad Inc公司),转印仪(北京市六一仪器厂),流式细胞仪(美国BD公司),酶标仪(美国Thermofisher公司)。
1.3 摄影方法
1.3.1 细胞培养及质粒转染MKN45细胞用含10%新鲜胎牛血清的高糖培养液[达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)]培养,培养孵箱调试至37℃、5%二氧化碳CO2、饱和湿度。培养2~3 d后细胞汇合度达70%~90%时胰酶消化传代。构建pGFP-V-RS载体(苏州吉玛公司),将Bax shRNA嵌入载体合成质粒,转染MKN45细胞系。不含目的基因序列的空载体做为阴性对照(Mock)组使用。转染过程:MKN45细胞在24孔板中呈单层贴壁生长。当细胞达到对数生长期,汇合度达50%~70%时进行转染。转染使用质粒、Opti-MEMⅠ及Lipofectamine 3000试剂(美国Invitrogen公司),超净工作台操作。配制转染脂质体混合物:Opti-MEMⅠ25μl+Lipofectamine 3 000 1μl超净工作台孵育5 min。与此同时Opti-MEMⅠ25μl+p3000 1μl(Lipofectamine 3000试剂中自带)+质粒1μg超净台孵育5 min。将上述两者混匀后再次孵育5 min,加入24孔板细胞中,孵箱继续培养。稳定表达Bax(-)的细胞系通过加入0.4 mg/ml G418(美国Sigma-Aldrich公司)抗生素的培养基进行筛选,不断增加G418的浓度,经过3~4周后得到G418抗性克隆。转染效率通过实时荧光定量聚合酶链反应(quanti tative real-time polymerase chain reaction,qRT-PCR)来评价。
1.3.2 硼替佐米给药方法为探讨硼替佐米能否诱导胃癌细胞的凋亡,抑制增殖,本研究给与未转染组梯度浓度的硼替佐米,加入无菌二甲亚砜(dimethyl Sulfoxide,DMSO)于超净台溶解至10~20 mol/L,置入-20℃冰箱冷冻保存,使用前无菌去离子水溶解至工作浓度。梯度给药,浓度分别为25、50、100、250、50和1000nmol/L。摸索给药后检测时间点,给药后48h为细胞增殖差异最明显时间点。
1.3.3 细胞增殖实验肿瘤细胞的增殖失控是其恶性程度的最重要表现。为明确Bax是否参与硼替佐米对MKN45细胞活力的影响,本研究给予未转染组、Mock组及shBax组250nmol/L硼替佐米,检测细胞活力。实验使用四唑盐比色法(methylthiazolyldiphenyltetrazolium bromide,MTT)进行。用含10%新鲜胎牛血清的高糖培养基吹打细胞,以3000个/孔的密度接种于96孔板培养,空白对照为不含细胞的等体积10%DMEM培养基,每组设3个副孔。培养24 h后更换培养基,每孔加入MTT溶液(5 mg/ml,pH=7.4)20μl,孵箱培养4 h。弃掉上清培养液,每孔加150μl DMSO,脱色摇床震荡10 min。于酶标仪上检测各个孔490 nm处的吸光度值。细胞生长的增殖率(%)=(实验组均值-空白组均值)/(阴性对照组均值-空白组均值)×100%。抑制率=1-增殖率。
1.3.4 细胞凋亡检测为明确Bax是否参与硼替佐米诱导的MKN45细胞凋亡,本研究给予未转染组、Mock组及shBax组250 nmol/L硼替佐米后,检测细胞凋亡率。细胞凋亡检测使用Annexin V-PE/7-AAD凋亡检测试剂盒。细胞用预冷的磷酸盐缓冲液清洗2次,不含乙二胺四乙酸(edetate,EDTA)的胰酶消化,1 000 r/min离心5 min,避光染色15 min,流式细胞仪上机检测。凋亡比例分析运用BD Accuri C6软件进行。
1.3.5 Western blot检测细胞3 000 r/min离心5 min,收集细胞沉淀,加入含苯甲基磺酰氟(phenyl-methanesulfonyl fluoride,PMSF)的裂解液摇床冰上裂解30 min,细胞超声机械裂解细胞提蛋白样。总蛋白量40μg的蛋白样于十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶中电泳,4℃转膜,一抗与含有蛋白条带的聚偏二氟乙烯膜4℃孵育过夜。一抗兔单克隆Bax(1∶100)、鼠单克隆甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(1∶1 000)。二抗室温孵育2 h,增强化学发光法(enhanced chemiluminescence,ECL)发光系统发光。使用Fluor Chem 2.0软件计算蛋白含量,以积分灰度值(integrated density value,IDV)表示。所有的实验均重复3次。
1.4 统计学方法
数据分析采用Graph Pad Prism version 5.0统计软件,计量资料以均数±标准差(x±s)表示,多组间比较用方差分析,若方差齐,则两两比较用LSD-t检验,P<0.05为差异统计学意义。
2 结果
2.1 硼替佐米对胃癌细胞增殖的抑制作用
为检测硼替佐米对于MKN45细胞的抑制作用,结果显示,硼替佐米能抑制细胞增殖,存在剂量依赖性。当硼替佐米剂量达到250nmol/L时,MKN45抑制率上升趋于缓和,500 nmol/L时曲线趋于平稳。
经过G418压力筛选后,Western blot检测结果,显示shBax组Bax蛋白表达为痕迹量,几乎难以检测出。3组Bax相对表达量比较,经方差分析,差异有统计学意义(F=119.225,P=0.000),shBax细胞株Bax相对表达量约为(0.24±0.03),与Mock组比较,约为其含量的24%,经LSD-t检验,差异有统计学意义(t= 4.931,P=0.029),提示shBax组Bax含量降低。实验结果显示,shBax稳定转染细胞株建立成功。shBax组细胞活力检测OD值为(0.498±0.04),Mock组OD值为(0.213±0.03),经t检验,差异有统计学意义(t=5.752,P=0.008),shBax组细胞活力升高。见图1。
2.2 硼替佐米与Bax表达含量的关系
为明确给予硼替佐米时Bax的含量变化,本研究采用Western blot检测。给与梯度浓度硼替佐米后48 h,Western blot检测Bax的蛋白含量随之上升(见图2)。硼替佐米500nmol/L时Bax相对表达量为(0.54±0.04)上升趋于缓和,经方差分析,差异有统计学意义(F=39.135,P=0.001)。给予MKN45细胞50℃水浴1 min,室温放置30 min后检测Bax表达明显上升,为阳性对照;单纯给予MKN45细胞DMSO时检测Bax含量,无明显上升,为阴性对照。
2.3 Bax与硼替佐米凋亡诱导作用的关系
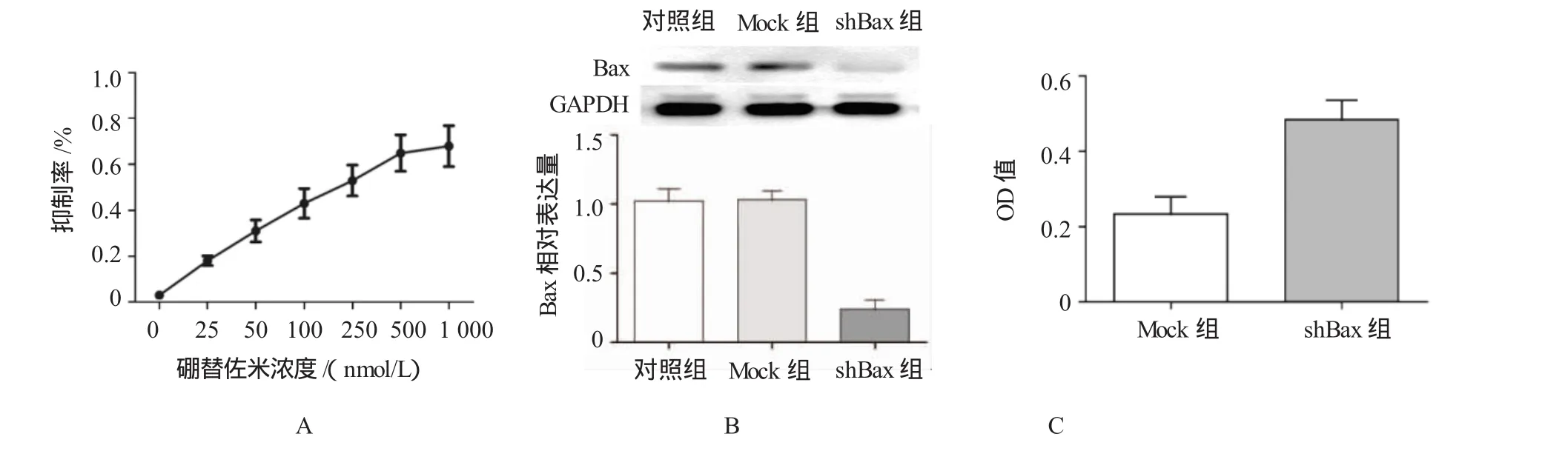
图1 硼替佐米及Bax对胃癌MKN45细胞增殖的影响
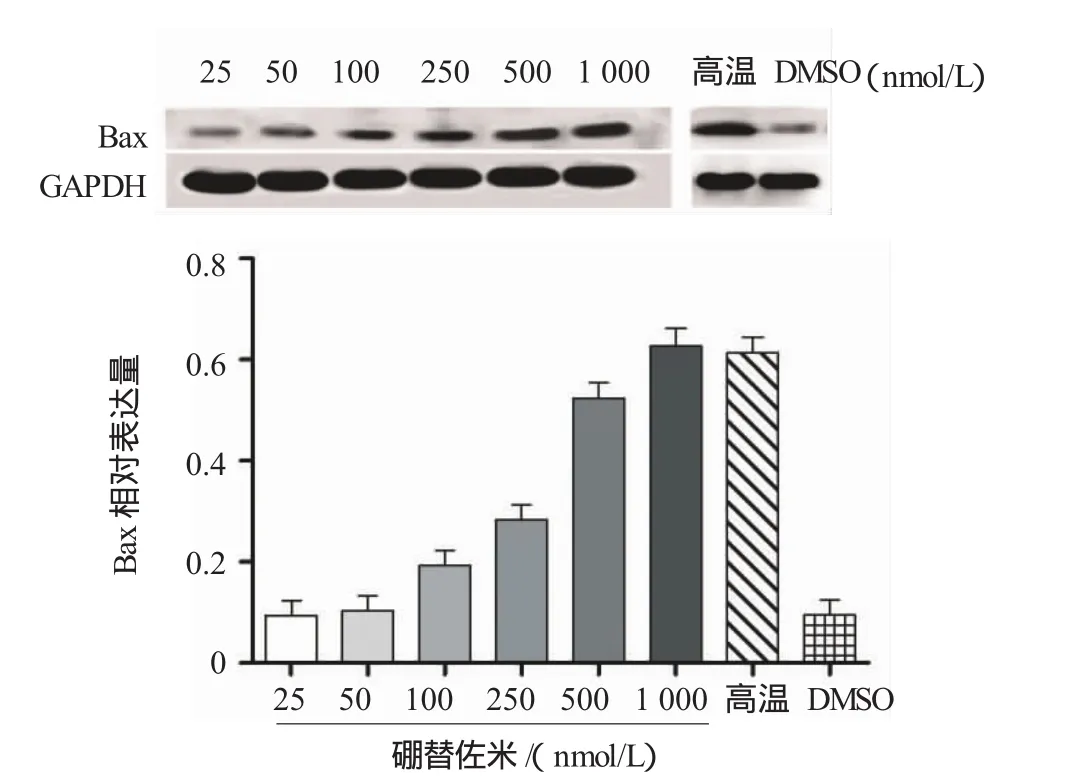
图2 硼替佐米对于未转染MKN45细胞的Bax蛋白表达影响
硼替佐米能促进细胞凋亡。随着硼替佐米浓度的增加,MKN45细胞凋亡率逐渐上升。当硼替佐米剂量达250 nmol/L时,MKN45凋亡率上升趋于缓和,500 nmol/L时凋亡率趋于平稳,与细胞活力受抑制的趋势相符。见图3A、B。
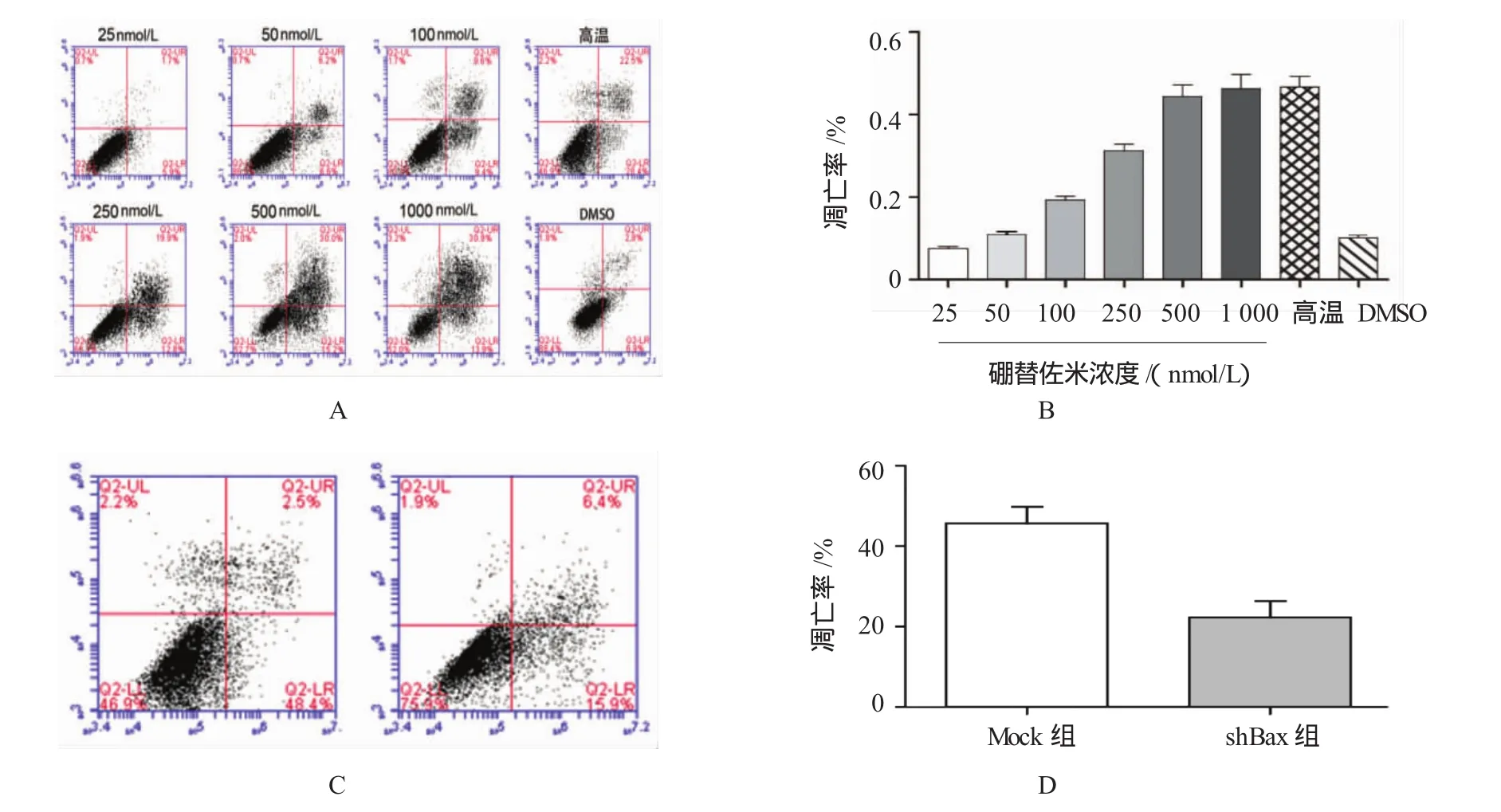
图3 硼替佐米和Bax对胃癌MKN45细胞凋亡的影响
shBax组凋亡率为(22.6±3.1)%,与Mock组细胞凋亡率[(44.3±2.9)%]比较,经t检验,差异有统计学意义(t=7.977,P=0.000),shBax组细胞凋亡率降低。见图3C、D。
3 讨论
近年来,胃癌的生物学和遗传学的认识有很大进展,但目前胃癌的治疗仍是困扰人类的难题。恶性胃癌的标准治疗模式为综合治疗,即术后尽早行铂类和氟尿嘧啶为基础的辅助化疗,对于淋巴结转移阳性者可选择性淋巴引流区照射[4-5]。尽管如此,恶性胃癌患者预后很差,Ⅳ期患者5年生存率约为4%[6]。因此,寻找有效的途径,抑制细胞对药物或射线的抵抗成为目前研究的热点。泛素-蛋白酶体通路(ubiquitin-proteasome pathway,UPP)是生物体内蛋白质选择性降解的重要途径,对基因表达调控、细胞周期、氧化应激等多种细胞活动进行干预。同时其对DNA损伤药物作用肿瘤细胞的增敏效应也被发现与研究,包括对在不同肿瘤模型中电离辐射的增敏效应。硼替佐米是高选择性的,可逆性的蛋白酶体抑制剂,广泛应用于血液病中联合化疗使用[7-8]。硼替佐米对肿瘤细胞的蛋白酶体抑制能力明显强于正常细胞,高出约100~1000倍,其与许多化疗药物合用呈现出增敏作用[9-10]。目前在实体肿瘤中的放化疗增敏作用也被不断地研究。
本实验研究硼替佐米对于胃癌细胞系MKN45增殖、凋亡的影响。硼替佐米能抑制MKN45细胞增殖,促进细胞凋亡。光镜下观察给予硼替佐米的MKN45细胞,呈现凋亡形态学改变,染色质浓缩、核固缩、胞质见大量空泡形成。进一步研究硼替佐米的作用机制发现,凋亡促进蛋白Bax随着硼替佐米的剂量增加而表达量升高。Bax属于Bcl-2家族成员,是最重要的促凋亡基因之一,广泛表达于肝细胞、呼吸系统上皮细胞和支气管平滑肌等细胞中。Bcl-2/Bax比例直接决定线粒体外膜电位[11],形成细胞凋亡调控的枢纽,是启动细胞凋亡的“分子开关”[12]。Bax和Bcl-2通过形成同源或异源二聚体来调节细胞凋亡。当Bax形成同源二聚体时诱导细胞凋亡;Bax与bcl-2形成异源二聚体时则抑制细胞凋亡。在外界因素刺激下,细胞凋亡最终取决于Bc-2和Bax两种调控因子的平衡结果[13]。提高Bax基因表达、上调Bax活性等针对Bax的靶向治疗已显示出促进胰腺癌细胞凋亡、增强药物抗癌效应的作用[14-16]。在胃癌中有研究显示,Bax能部分介导组蛋白去乙酰化酶抑制剂和蛋白酶抑制剂间的协同细胞毒作用[17]。腺病毒转染Bax基因能增加胃癌细胞的放射敏感性[18]。本研究中,当沉默Bax时,细胞增殖率升高,凋亡比例下降,给予硼替佐米后shBax细胞凋亡未见明显上升,提示硼替佐米的促凋亡作用部分由Bax介导。上述研究结果或许能为胃癌的放化疗增敏治疗提供新的思路。
[1]KMIETOWICZ Z.Oesophageal and gastric cancer need to be detected earlier to improve outcomes,audit finds[J].BMJ,2014, 349:g7340.
[2]Cancer Genome Atlas Research N.Comprehensive molecular characterization of gastric adenocarcinoma[J].Nature,2014,513 (7517):202-209.
[3]HULTMAN B,MAHTEME H,SUNDBOM M,et al.Benchmarking of gastric cancer sensitivity to anti-cancer drugs ex vivo as a basis for drug selection in systemic and intraperitoneal therapy[J]. Journal of Experimental Clinical Cancer Research,2014,33(1): 110.
[4]CHEN X,EADS J R,AMMORI J B,et al.Adjuvant and neoadjuvant options in resectable gastric cancer:is there an optimal treatment approach[J].Current Oncology Reports,2015,17(4):18.
[5]ASHRAF N,HOFFE S,KIM R.Adjuvant treatment for gastric cancer:chemotherapy versus radiation[J].The Oncologist,2013, 18(9):1013-1021.
[6]THRUMURTHY S G,CHAUDRY M A,CHAU I,et al.Does surgery have a role in managing incurable gastric cancer[J].Nature Reviews Clinical Oncology,2015,12(11):676-682.
[7]PARAMORE A,FRANTZ S.Bortezomib[J].Nature Reviews Drug Discovery,2003,2(8):611-612.
[8]MEISLER A I.Bortezomib in multiple myeloma[J].The New England Journal of Medicine,2003,349(13):1287-1288.
[9]程亮,王曦,张杰,等.凋亡及其相关蛋白在肿瘤治疗中的研究进展[J].中华病理学杂志,2009,38(9):639-642.
[10]FU D X,TANHEHCO Y,CHEN J,et al.Bortezomib-induced enzyme-targeted radiation therapy in herpesvirus-associated tumors[J].Nature Medicine,2008,14(10):1118-1122.
[11]SHIMIZU S,NARITA M,TSUJIMOTO Y.Bcl-2 family proteins regulate the release of apoptogenic cytochrome c by the mitochondrial channel vdac[J].Nature,1999,399(6735):483-487.
[12]MAHAJAN N P,LINDER K,BERRY G,et al.Bcl-2 and bax interactions in mitochondria probed with green fluorescent protein and fluorescence resonance energy transfer[J].Nat Biotechnol,1998,16(6):547-552.
[13]GHOBRIAL I M,WITZIG T E,ADJEI A A.Targeting apoptosis pathways in cancer therapy[J].CA:a Cancer Journal for Clinicians,2005,55(3):178-194.
[14]FRIESS H,LU Z,GRABER H U,et al.Bax,but not bcl-2, influences the prognosis of human pancreatic cancer[J].Gut, 1998,43(3):414-421.
[15]WACK S,REJIBA S,PARMENTIER C,et al.Telomerase transcriptional targeting of inducible bax/trail gene therapy improves gemcitabine treatment of pancreatic cancer[J].The Journal of the American Society of Gene Therapy,2008,16(2):252-260.
[16]OLTERSDORF T,ELMORE SW,SHOEMAKER AR,et al.An inhibitor of bcl-2 family proteins induces regression of solid tumours[J].Nature,2005,435(7042):677-681.
[17]YU C,FRIDAY B B,YANG L,et al.Mitochondrial bax translocation partially mediates synergistic cytotoxicity between histone deacetylase inhibitors and proteasome inhibitors in glioma cells[J].Neuro-oncology,2008,10(3):309-319.
[18]ARAFAT W O,BUCHSBAUM D J,GOMEZ-NAVARRO J,et al.An adenovirus encoding proapoptotic bax synergistically radiosensitizes malignant glioma[J].Int J Radiat Oncol Biol Phys, 2003,55(4):1037-1050.
(童颖丹 编辑)
Bortezomib induced apoptosis of MNK45 cells through up-regulation of Bax*
Xi-he Zhao,Kai Li,Hua-wei Zou
(Department of Oncology,Shengjing Hospital Affiliated to China Medical University,Shenyang,Liaoning 110022,China)
ObjectiveTo investigate the effect of Bax on Bortezomib-induced apoptosis of gastric cancer MNK45 cells.MethodsBax shRNA was constructed and transfected into MKN45 cells.Bortezomib of gradient concentrations was administrated into MKN45 cells(5 nmol/L,25 nmol/L,50 nmol/L,100 nmol/L,250 nmol/L, 500 nmol/L and 1,000 nmol/L).Cell viability and apoptosis rate were examined.ResultsBax-knockdown MKN45 cell line was constructed by transfection.Gradient Bortezomib suppressed the proliferation of mock MKN45 cells and induced cell apoptosis,meanwhile Bax protein level was increased.Bortezomib increased apoptosis rate at a concentration of 500 nmol/L.In the shBax group,apoptosis rate was down-regulated and proliferation ability was strengthened.ConclusionsBax-mediated apoptosis caused by Bortezomib and knockdown of Bax could partially attenuate cell death caused by Bortezomib.
gastric cancer;Bortezomib;Bax;apoptosis
R735.2
A
10.3969/j.issn.1005-8982.2017.01.003
1005-8982(2017)01-0011-05
2016-02-22
国家自然科学基金(N0:81472806)
邹华伟,E-mail:zouhw@sj-hospital.org;Tel:18940251190
