TRPV5/6通道在急性髓系白血病中的表达研究
2017-02-07吴超杨新宇李璇周明肖佩玲
吴超,杨新宇,李璇,周明,肖佩玲
(湖南省人民医院血液科,湖南长沙410005)
临床论著
TRPV5/6通道在急性髓系白血病中的表达研究
吴超,杨新宇,李璇,周明,肖佩玲
(湖南省人民医院血液科,湖南长沙410005)
目的探讨瞬时受体电位通道V5(TRPV5)、瞬时受体电位通道V6(TRPV6)在急性髓系白血病(AML)中的表达。方法提取AML患者骨髓细胞、捐献者造血干细胞,以及AML细胞株的蛋白和总RNA,运用实时荧光定量聚合酶链反应(qRT-PCR)及Western blot检测TRPV5/6基因和蛋白的表达水平,并分析AML患者临床指标与TRPV5/6表达水平的相关性。结果初治组、复发组、细胞株组结果显示,TRPV5/6的表达高于对照组,差异有统计学意义(P<0.05),而完全缓解组与对照组TRPV5/6的表达比较,差异无统计学意义(P>0.05)。AML患者TRPV5/6表达与骨髓原始细胞百分比呈正相关(P<0.05),而与外周血白细胞计数、血红蛋白、血小板计数、性别、年龄及骨髓染色体核型比较,差异无统计学意义(P>0.05)。结论TRPV5/6通道在AML中表达上调,且与肿瘤负荷相关,有望成为白血病诊断的新型标志物,以及预后评估的分子靶点。
急性髓系白血病;TRPV5/6通道;骨髓细胞
急性髓系白血病(acute myeloid leukemia,AML)是一组以增殖异常、分化障碍、凋亡受阻为主要特征的造血干细胞恶性克隆性疾病,也是成人白血病中最常见的类型。尽管临床化疗方案的改进、新型分子靶向药物的应用,以及造血干细胞移植的发展提高白血病的疗效,但年龄<60岁患者的5年生存率仅有30%~40%,老年白血病5年生存率<10%[1],同时难治、复发、耐药依然是血液科医生目前面临的难题。因此,研究白血病的发病机制,挖掘新的治疗靶点,研发新型的治疗药物成为研究的热点。瞬时受体电位(transient receptor potential,TRP)通道影响一些生理和病理过程,最近研究表明,TRP通道诱导细胞增殖、异常分化、阻止细胞凋亡,甚至导致肿瘤细胞扩散[2]。而瞬时受体电位通道V(transient receptor potential vanilloid receptor,TRPV)通道是其七大家族之一,同时包括6个亚型。TRPV通道参与调节肿瘤细胞的增殖、凋亡、血管生成、迁移及侵袭等[3],此外,其表达的变化也可能抑制细胞凋亡,从而加速肿瘤的发展[4]。但是,目前国内TRPV5/6通道在AML中的表达及作用机制尚不明确。本研究通过检测AML患者骨髓细胞、AML细胞株细胞中TRPV5/6的表达,从而探讨其在白血病中可能发挥的作用。
1 资料与方法
1.1 研究对象
选取2015年5月1日-2016年6月30日湖南省人民医院血液科住院患者经骨髓形态学、免疫分型、融合基因、基因突变等相关检查,符合法、美、英国际分型,明确诊断为急性髓系白血病的临床骨髓标本39例(M3除外),包括初诊患者26例,复发患者6例,完全缓解患者7例。其中,男性23例,女性16例;年龄25~74岁,中位年龄为48.5岁。选取湘雅三医院血液科提供的动员后造血干细胞骨髓细胞3例作为对照组。所有患者同意临床标本的收集,以及未接受化疗或激素治疗,同时均通过了湖南省人民医院医学伦理委员会审核。本课题涉及AML的诊治及疗效评估均参考《威廉姆斯血液病学》第8版[5]。
1.2 试剂、仪器与设备
胎牛血清和洛斯维(roswell park memorial institute,RPMI)1640购于美国Gibco公司,Trizol、逆转录试剂盒、荧光定量试剂盒购于美国Sigma公司,引物由上海生工生物工程有限公司合成,兔抗鼠TRPV5、TRPV6单克隆抗体购于英国Abcam公司,放
射免疫沉淀测定(radio immunoprecipitation assay,RIPA)裂解液、十二烷基硫酸钠、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、电化学(electro-chemi-luminescence,ECL)超敏发光液、三氨基甲烷(tris aminomethane tween,TBST)购于美国Thermo公司。紫外线分光光度仪(上海菁华科技仪器有限公司),蛋白电泳仪、蛋白电泳槽、荧光显微镜、荧光定量聚合酶链反应仪PIKO REAL 96、荧光PCR板(美国Thermo公司)。
1.3 方法
1.3.1 单个核细胞分离按常规无菌操作行骨髓穿刺术抽取新鲜骨髓标本2 ml,置于乙二胺四乙酸抗凝的无菌试管中,用Hanks平衡盐溶液稀释骨髓悬液1倍,1 500 r/min离心10 min去除上层脂肪细胞,运用骨髓淋巴细胞分离液获得单个核细胞,适量红细胞裂解液去除残余的红细胞,Hanks平衡盐溶液洗涤1次离心后留取沉淀即单个核细胞,加入1 ml Trizol试剂充分裂解细胞,直接提取总RNA,置于-80℃冰箱冷冻保存备用。
1.3.2 细胞株培养急性髓系白血病细胞株(human acute monocytic leukemia cell line,THP1)、Kasumi-1及慢性髓系白血病细胞株K562培养于10%灭活胎牛血清的RPMI 1640培养基中,在37℃、5%二氧化碳CO2湿化培养箱中进行培养,每天换液1次,隔2~3 d细胞传代1次,实验选取对数生长期细胞进行。
1.3.3 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)法检测TRPV5/6 mRNA的表达收集临床骨髓标本提取后的单个核细胞及细胞株细胞,Trizol试剂提取总RNA,逆转录成互补DNA,行qRT-PCR反应。反应参数:95℃预变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸30s,共40个循环。确定扩增产物为单一目的片段从而分析熔解曲线。以β-肌动蛋白作为内参,采用2-△△Ct计算基因的相对表达量。在美国国立生物技术信息中心上搜索目的基因的序列,运用Primer 5软件设计PCR引物,引物序列见表1。
1.3.4 Western blot检测TRPV5/6的蛋白表达收集临床骨髓标本提取后的单个核细胞及细胞株细胞,预冷磷酸缓冲盐溶液洗涤,按照6孔板每孔细胞加入200μl RIPA裂解液裂解细胞,运用聚氰基丙烯酸正丁酯法定量后调整蛋白量为60μg/泳道,10%SDS-PAGE分离蛋白质、转膜、封闭。依据目的蛋白的分子量,切割聚偏二氟乙烯膜,用TRPV 5/6一抗(1∶10 000)4℃孵育过夜,然后1×TBST洗3次,15 min/次,再用辣根过氧化物酶标记的兔抗鼠(1∶3 000)二抗孵育1 h,结束后1×TBST洗膜3次,15 min/次。ECL发光、显影。以β-肌动蛋白作为内参。结果采用Quantily One软件进行分析。
1.4 统计学方法
Sigmaplot 10.0作图,数据分析采用SPSS 13.0统计软件,计量资料以中位数±四分位数(x±s)表示,用方差分析或秩和检验或H检验,相关性分析用Spearman秩相关,P<0.05为差异有统计学意义。

表1 qRT-PCR引物序
2 结果
2.1 TRPV5/6通道在白血病中的基因表达水平
TRPV5、TRPV6在白血病中的基因表达水平,采用方差分析进行多组间比较,差异有统计学意义(F=10.841和14.672,P=0.016和0.021)。见图1和图2A。

图1 TRPV5与TRPV6通道在AML及K562中mRNA的相对表达(x±s)
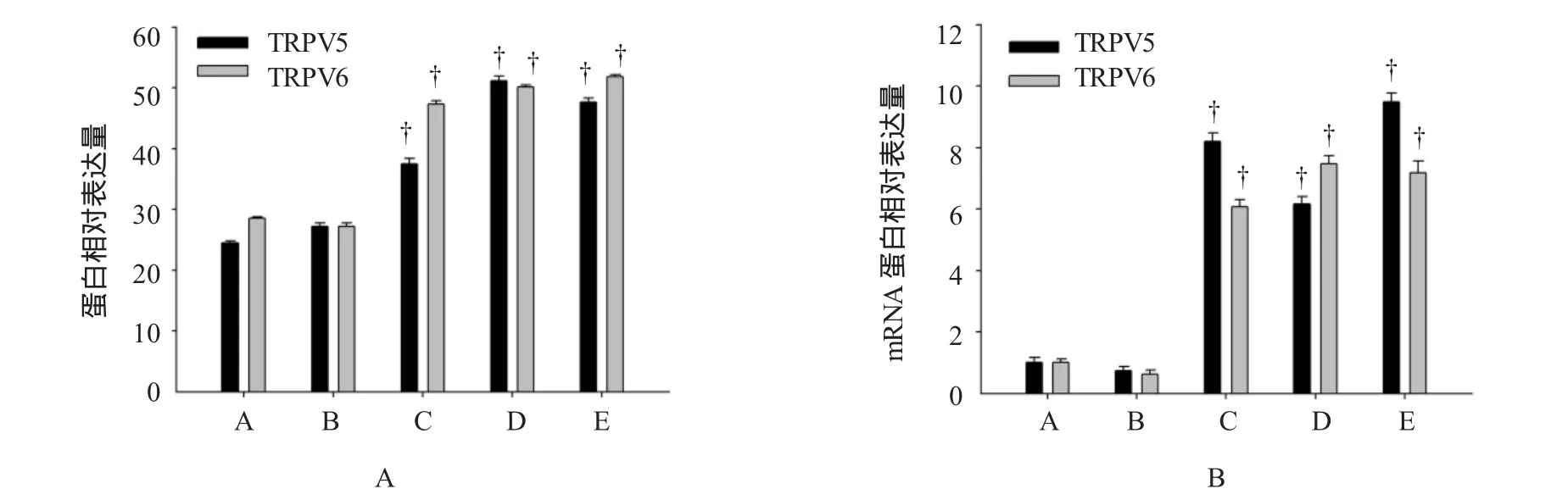
图2 AML中TRPV5/6通道mRNA与蛋白的相对表达(x±s)
除完全缓解组外,TRPV5、TRPV6基因表达均上调,初治组(AML包括MO~M7 8个分型,其中M3除外)、复发组、细胞株组(包括Kasumi-1、THP1,其中K562是慢性髓系白血病细胞株)表达水平均高于对照组,差异有统计学意义。而完全缓解组中TRPV5、TRPV6的表达量与对照组比较,差异无统计学意义。见表2。
2.2 TRPV5/6通道在白血病中的蛋白表达水平
采用方差分析进行多组间比较,TRPV5、TRPV6在白血病中的蛋白表达水平差异有统计学意义(F= 10.624和27.232,P=0.000)。见图2B和图3。
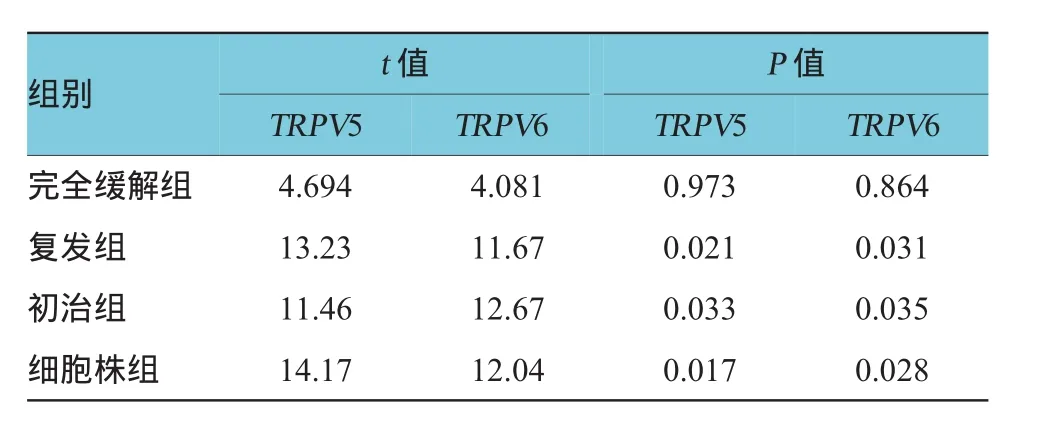
表2 TRPV5/6在白血病中基因表达的方差分析两两比较结果
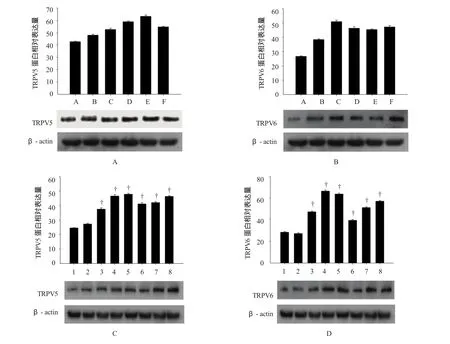
图3 TRPV5与TRPV6通道在AML及K562中蛋白的相对表达
除完全缓解组外,TRPV5、TRPV6蛋白表达均上调,初治组(AML包括MO~M78个分型,其中M3除外)、复发组、细胞株组(包括Kasumi-1、THP1,其中K562是慢性髓系白血病细胞株)表达水平均高于对照组,差异有统计学意义。而完全缓解组中TRPV5、TRPV6的表达量与对照组比较,差异无统计学意义。见表3。
2.3 AML患者TRPV5/6表达与临床指标的相关性
39例临床AML患者TRPV5/6表达水平与骨髓原始幼稚细胞百分比呈正相关,差异有统计学意义(P<0.05),而与行骨髓形态学分析当天的外周血白细胞计数、血红蛋白、血小板计数比较,差异无统计学意义(P>0.05)。见表4。
2.4 AML患者TRPV5/6表达与性别、年龄、骨髓染色体核型的相关性
AML患者依据性别及年龄,以60岁为界,划分为两组,运用秩和检验对各组间TRPV5、TRPV6表达进行差异性分析,结果表明TRPV5/6表达差异无统计学意义(P>0.05)。39例AML患者中可供分析的骨髓染色体核型24例。其中预后良好组9例,包括5例t(15;17)(q31;q22),3例t(8;21)(q22;q22),1例inv(16);预后中等组11例,包括2例+8,3例t(11q23),6例正常核型;预后差组4例,包括2例-5,1例-7,1例复杂核型(47,XY+?8[2]/46,XY[18]),TRPV5、TRPV6在3组间表达比较,经H检验,差异无统计学意义(P>0.05)。见表5、6。
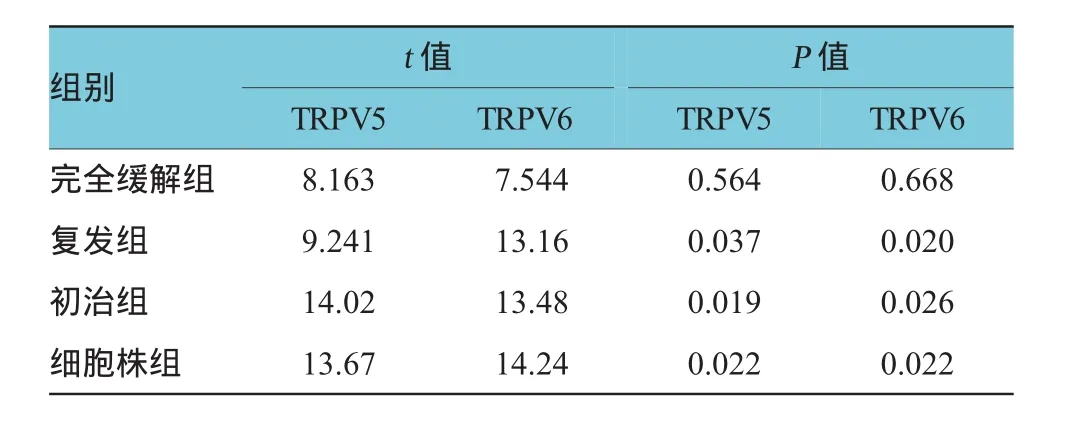
表3 AML中TRPV5/6蛋白表达的方差分析两两比较结果
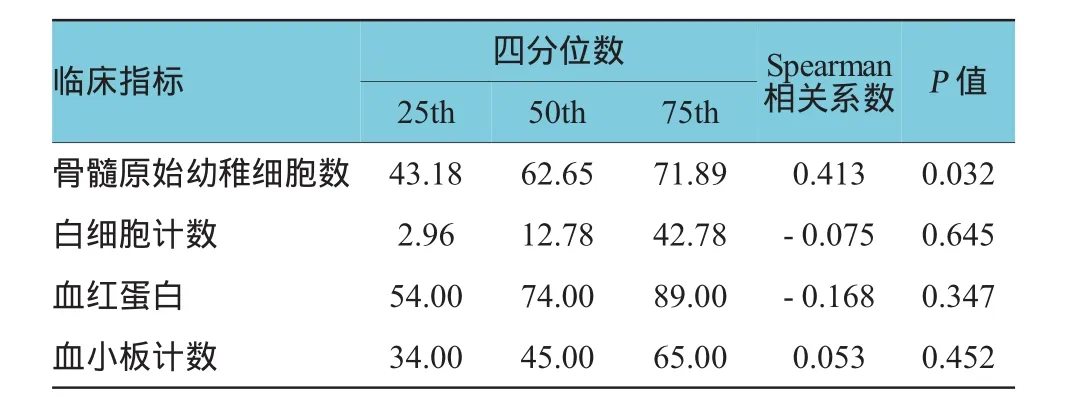
表4 AML患者TRPV5/6的表达与临床指标的相关性(%)
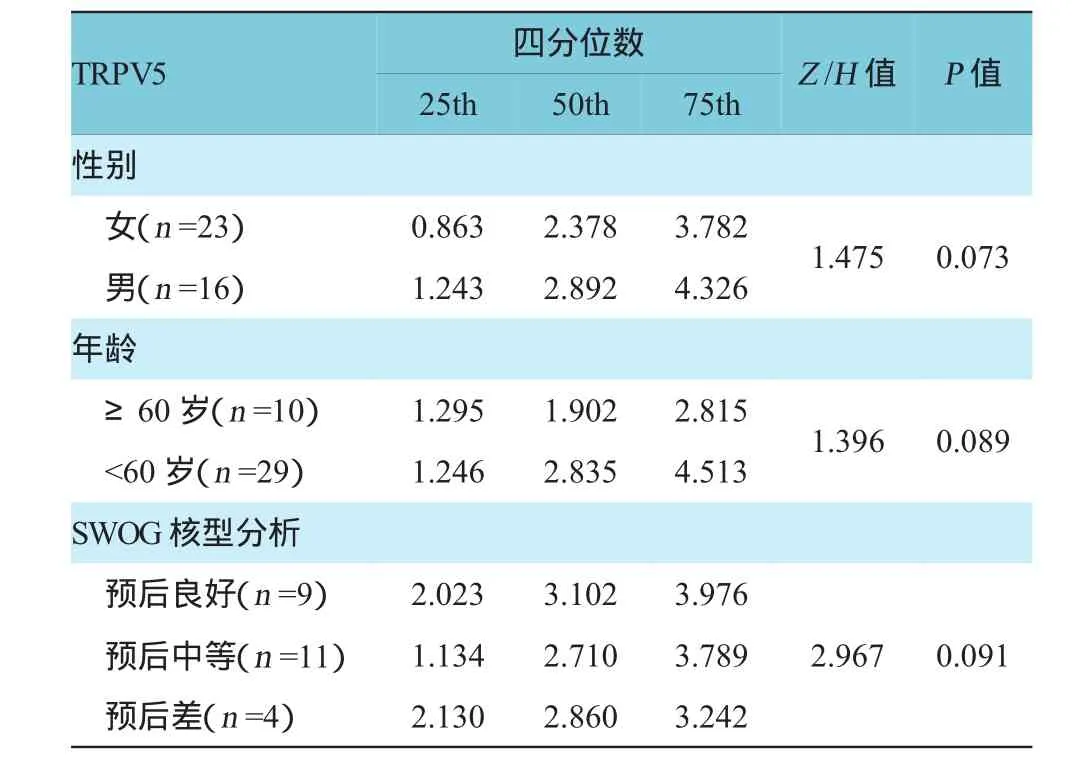
表5 不同性别、年龄和骨髓染色体核型患者TRPV5表达水平的比较(%)

表6 不同性别、年龄和骨髓染色体核型患者TRPV6表达水平的比较
3 讨论
随着人口老龄化,白血病的发病率逐年升高,而急性白血病(acute leukemia,AL)是涉及多种分子遗传学异常的起病急、病程短、预后差的恶性克隆性疾病。虽然不断研发的新型化疗药物的临床运用,以及造血干细胞移植技术的发展明显改善其疗效和预后,但是AL的复发、难治及耐药仍是目前研究白血病领域的重点和难点[6]。
最近的研究表明,TRPV通道是选择性阳离子通道[7],同时是各种可兴奋细胞兴奋或者恢复过程中钙内流的重要途径,与肿瘤息息相关,在多种实体肿瘤中表达上调,如肾癌、肝癌、胃癌、前列腺癌等[8-11],并且TRPV通道有可能作为肿瘤药物治疗的潜在靶点。TRPV通道参与机体许多生理和病理功能,包括钙离子平衡、细胞增殖、分化、凋亡、迁移、血管新生甚至远处转移[12-14]。此外,肿瘤细胞可自身分泌蛋白水解酶或者诱导宿主细胞来降解蛋白酶,从而改变离子通道(如钙离子介导的TRPV通道)和细胞膜受体的功能,导致正常细胞演变为细胞增生、化生、不典型增生、肿瘤细胞,最终发生远处转移[15]。越来越多的研究澄清TRPV通道与肿瘤之间的关联,同时其涉及到细胞的增殖增强、异常分化、凋亡抑制,最后导致无法控制的浸润和远处转移[16]。目前已有研究表明,TRPV5/6通道在正常人单个核细胞存在表达,同时LEE等[17]研究表明,维生素D3浓度减低可抑制TRPV5/6通道的表达,从而诱导白血病细胞的凋亡,但是关于AML患者骨髓细胞及AML细胞株中的TRPV5/6的表示水平检测的研究尚未见报道。综上所述,TRPV5/6通道有望成为白血病诊断的新型标志物,以及预后评估的分子靶点。
临床诊断白血病依赖于骨髓穿刺术完善骨髓形态学、免疫分型,以及分子遗传学等综合诊断方法,因此骨髓细胞标本易于收集,且39例临床标本均获得患者的同意。本研究采用qRT-PCR、Western blot检测临床AML、AML细胞株及K562中TRPV5/6的表达水平。结果表明,初治组、复发组、细胞株组(AML细胞株及K562)的表达均高于对照组。而完全缓解组的表达水平与对照组比较差异无统计学意义,有待进一步加大样本量进行进一步深入研究。同时K562为慢性髓系白血病细胞株,其表达与对照组比较,差异有统计学意义,但是否临床患者慢性髓系白血病骨髓细胞存在高表达,有待于本课题组接下来的实验研究。同时TRPV5/6的表达与临床骨髓原始幼稚细胞百分比呈正相关。TRPV5/6不仅仅在AML中存在高表达,并且其高表达与AML的发生、发展息息相关。望本研究为将来探索白血病的诊疗及预后评估奠定理论基础,并开辟新的研究思路。
[1]CARNEIRO B A,ALTMAN J K,KAPLAN J B,et al.Targeted therapy of acute myeloid leukemia[J].Expert Review of Anticancer Therapy,2015,15(4):399-413.
[2]ECHEVERRY S,RODRIGUEZ MJ,TORRES YP.Transient receptor potential channels in microglia:roles in physiology and disease[J].Neurotoxicity Research,2016:1-12.
[3]LI X,ZHANG Q,FAN K,et al.Overexpression of TRPV3 correlates with tumor progression in non-small cell lung cancer[J]. International Journal of Molecular Sciences,2016,17(4):DOI: 10.3390/ijms17040437.
[4]SANTONI G,FARFARIELLO V,AMANTINI C.TRPV channels in tumor growth and progression[J].Advances in Experimental Medicine and Biology,2011,704:947-67.
[5](美)KAUSHANSKY K,(美)LICHTMAN MA,(美)BEUTLER E,等.《威廉姆斯血液病学》(第8版).陈竺译.北京:人民卫生出版社,2010.
[6]YEBENES-RAMIREZ M,SERRANO J,MARTINEZ-LOSADA C, et al.Clinical and biological prognostic factors in relapsed acute myeloid leukemia patients[J].Medicina Clinica,2016,147(5):185-191.
[7]TOMILIN V N,CHEREZOVA A L,NEGULYAEV Y A,et al. TRPV5/V6 channels mediate Ca(2+)influx in jurkat T cells under the control of extracellular pH[J].Journal of Cellular Biochemistry,2016,117(1):197-206.
[8]WU Y,MIYAMOTO T,LI K,et al.Decreased expression of the epithelial Ca2+channel TRPV5 and TRPV6 in human renal cell carcinoma associated with vitamin D receptor[J].The Journal of Urology,2011,186(6):2419-2425.
[9]LIU G,XIE C,SUN F,et al.Clinical significance of transient receptor potential vanilloid 2 expression in human hepatocellular carcinoma[J].Cancer Genetics and Cytogenetics,2010,197(1):54-59.
[10]LEE W H,CHOONG L Y,MON N N,et al.TRPV4 regulates breast cancer cell extravasation,stiffness and actin cortex[J].Scientific Reports,2016,6:DOI:10.1038/srep27903.
[11]MORELLI M B,AMANTINI C,NABISSI M,et al.Cross-talk between alpha 1D-adrenoceptors and transient receptor potential vanilloid type 1 triggers prostate cancer cell proliferation[J]. BMC Cancer,2014,14:921.
[12]VETTER I,KYM P R,SZALLASI A.Feeling hot,feeling cold: TRP channels-a great story unfolds[J].Temperature,2015,2(2): 150-151.
[13]ANDRES D,KEYSER B,BENTON B,et al.Transient receptor potential(TRP)channels as a therapeutic target for intervention of respiratory effects and lethality from phosgene[J].Toxicology Letters,2016,244:21-27.
[14]HERNANDEZ-GARCIA E,ROSENBAUM T.Lipid modulation of thermal transient receptor potential channels[J].Current Topics in Membranes,2014,74:135-180.
[15]HDUD I M,LOUGHNA P T.Influence of 1alpha,25-dihydroxyvitamin D3[1,25(OH)2D3]on the expression of Sox 9 and the transient receptor potential vanilloid 5/6 ion channels in equine articular chondrocytes[J].Journal of Animal Science and Technology,2014,56:33.
[16]LANGE M,WEIHMANN F,SCHLIEBNER I,et al.The transient receptor potential(TRP)channel family in colletotrichum graminicola:a molecular and physiological analysis[J].PloS One, 2016,11(6):DOI:10.1371/Journal.pone.0158561.
[17]LEE H J,MUINDI J R,TAN W,et al.Low 25(OH)vitamin D3 levels are associated with adverse outcome in newly diagnosed, intensively treatedadult acute myeloidleukemia[J].Cancer, 2014,120(4):521-529.
(童颖丹 编辑)
Expression of transient receptor potential channel 5 and 6 in acute myeloid leukemia
Chao Wu,Xin-yu Yang,Xuan Li,Ming Zhou,Pei-ling Xiao
(Department of Hematology,Hunan Provincial People's Hospital, Changsha,Hunan 410005,China)
ObjectiveTo observe the expressions of transient receptor potential channel TRPV 5 and TRPV6 in acute myeloid leukemia(AML).MethodsThe protein and total RNA were extracted from bone marrow cells of AML patients,hematopoietic stem cells of healthy donors and AML cell lines.Quantitative real-time polymerase chain reaction and Western blot were used respectively to examine the expression levels of TRPV5 and TRPV 6.The relationships between TRPV 5 and TRPV6 expressions and clinical features of the patients were analyzed.ResultsThe expressions of TRPV5 and TRPV6 in the initial treatment group,the relapse group and the cell line group were significantly higher than that in the control group(P<0.05).The expressions of TRPV5 and TRPV6 in the complete remission group showed no significant difference from that in the control group(P>0.05).The expressions of TRPV5 and TRPV6 in the AML patients had positive correlations with the percentage of bone marrow progenitor cells(P<0.05),but had no obvious correlation with WBC count,hemoglobin,platelet count of peripheral blood,sex,age,or bone marrow chromosome(P>0.05).ConclusionsTRPV5 and TRPV6 are excessively up-regulated in acute myeloid leukemia and correlated with tumor load of the patients.They could be new markers of prognosis and molecular targets for diagnosis of AML.
acute myeloid leukemia;transient receptor potential channel 5 and 6;bone marrow cell
肖佩玲,E-mail:xiaopl@163.com;Tel:13507431491
R733
A
10.3969/j.issn.1005-8982.2017.01.014
1005-8982(2017)01-0071-06
2016-07-15
