外周血AREG基因多态性与结直肠癌的相关性及其临床意义*
2017-02-07吴肖王爱军王红钰徐晋珩郑宝军程健张超施华冯俊伟
吴肖,王爱军,王红钰,徐晋珩,郑宝军,程健,张超,施华,冯俊伟
(河北省唐山市工人医院1.肿瘤外科,2.病理科,河北唐山063000)
临床论著
外周血AREG基因多态性与结直肠癌的相关性及其临床意义*
吴肖1,王爱军1,王红钰1,徐晋珩2,郑宝军1,程健1,张超1,施华1,冯俊伟1
(河北省唐山市工人医院1.肿瘤外科,2.病理科,河北唐山063000)
目的探讨外周血中双向调节蛋白(AREG)基因rs2291715位点多态性与结直肠癌的相关性及其意义。方法选取2012年1月-2015年12月在该院治疗的400例结直肠癌患者作为病例组,同期进行健康体检的健康者400例作为对照组。检测病例组与对照组外周血中AREG、CEA、CA50、CA242水平。应用聚合酶链反应扩增联合DNA直接测序法,检测两组外周血中AREG基因rs2291715位点的基因分布情况,按不同基因型将病例组和对照组进行分组,并观察按基因型分组后不同基因型外周血中AREG水平的变化。Logistic回归分析AREG基因rs2291715位点多态性与结直肠癌的相关性。结果病例组中血清AREG、CEA、CA50、CA242水平高于对照组(P<0.05)。AREG基因rs2291715位点存在C和G 2种等位基因,共发现3种基因型:GG(突变纯合子)、CG(突变杂合子)、CC(野生型)。病例组中CG、GG基因型频率及G等位基因均高于对照组(P<0.05)。Logistic回归分析显示,GG基因型及G等位基因与结直肠癌的发生、发展密切相关,是结直肠癌的独立危险因素[^OR=8.936(95%CI:1.539,48.246)P=0.009]。结论AREG基因rs2291715位点多态性与结直肠癌的发生、发展密切相关。
结直肠癌;双向调节蛋白;基因多态性;外周血
结直肠癌的发生原因主要与生活方式、饮食结构、饮食习惯、遗传因素等有关,生活水平高、食物精细、油炸类食品摄入过多、纤维素摄入少、过量饮酒、运动量不足等是结直肠癌发病率高的原因[1-2],其另一重要原因还是遗传因素,阳性家族史人群是结直肠癌的高危人群[3]。大多数结直肠癌患者早期无症状或症状不明显,仅有腹部不适感、消化不良、大便少量带血或里急后重等,常被误认为肠道功能紊乱,确诊时多为中、晚期,许多患者就诊时已出现肝脏或其他部位转移,错过了最佳治疗时间。因此,通过基因分析寻找可以预测结直肠癌发生、发展的临床指标有重要的现实意义。
双向调节蛋白(amphiregulin,AREG)是肿瘤相关成纤维细胞释放的一种外泌蛋白,属于表皮生长因子家族中的一员,具有酪氨酸激酶活性,与恶性肿瘤的局部增殖扩张、周围侵袭、远处转移等有关。有研究证实,AREG在多种恶性肿瘤中表达明显增高[4-7],但该基因突变与结直肠癌之间关系的报道较少。本研究通过检测结直肠癌患者AREG在外周血中的浓度及其单核苷酸多态性(single nucleotide polymorphism,SNP)位点在结直肠癌和健康人群中的分布差异,以及AREG浓度随SNP位点的变化情况;同时检测肿瘤标志物癌胚抗原(carcino-embryonic antigen,CEA)、糖类抗原50(carbohydrate antigen 50,CA50)、CA242的水平。探讨AREG在结直肠癌发生、发展过程中的意义,为正确评估结直肠癌患者的病情提供客观依据。
1 资料与方法
1.1 一般资料
选取2012年1月-2015年12月于河北省唐山市工人医院就诊的结直肠癌患者400例作为病例组,所有患者经术前活检及术后病理学检查明确诊断为结直肠癌。选取同期来本院进行体检的健康人作为对照组(400例)。两组人员性别、年龄匹配。病例组男性257例,女性143例;年龄(22~70岁),平均(56.4±12.1)岁;对照组男性250例,女性150例;年龄(23~70岁),平均(55.7±11.9)岁。本研究由医院伦理委员会批准,所有研究对象签署知情同意书。
1.2 方法
1.2.1 标本采集所有研究对象于空腹过夜晨起抽取静脉血6 ml。2 ml置于乙二胺四乙酸二钾(ethylenediaminetetraacetic acid disodium salt,EDTA-K2)抗凝管中,颠倒混匀,置入-80℃冷冻保存备用;4 ml置于生化促凝管中,室温血液自然凝固10~20 min,3 000 r/min,离心15 min分离血清。收集上清液,提出的血清-80℃冷冻保存备用。
1.2.2 酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)血清AREG水平人AREG ELISA试剂盒购自武汉伊莱瑞特生物科技有限公司,进口分装(批号:E-EL-H0237c)。按照ELISA试剂盒说明书操作,依次加入生物素化的抗人AREG抗体和辣根过氧化物酶标记的亲和素,形成免疫复合物,加入显色底物,在辣根过氧化物酶的催化下呈现蓝色,加终止液后变成黄色。用酶标仪在450 nm波长处测光密度(optical density,OD)值,AREG浓度与OD450值呈正比,通过绘制标准曲线,计算出样品中AREG的浓度。试剂盒检测范围31.25~2 000.00 pg/ml,18.75 pg/ml时敏感性最高,板内、板间变异系数均<10%。
1.2.3 肿瘤标志物血清CEA、CA50、CA242水平的测定采用电化学发光法(美国雅培公司i2000化学发光仪)测定肿瘤标志物CEA、CA50、CA242水平。
1.2.4 基因组DNA的提取EDTA-K2抗凝血复融后,充分混匀,取300μl进行检测。应用血液基因组DNA提取试剂盒Wizard Genomic DNA Purification kit(批号:D1192-01,美国Promega公司),采用离心柱法提取各样本基因组DNA。
1.2.5 扩增目的基因AREG基因rs2291715 SNP位点引物序列,正向引物:5'-GAGAATAAGCTTAAAA CACACC-3',反向引物:5'-AATTTGTAAGTTATGTCA TA-3'。建立总体积为25μl的聚合酶链式反应(polymerase chain realtion,PCR)反应体系,包括正反向引物(25μmol/L)各1μl、4种脱氧核糖核苷三磷酸混合物(dNTP 2 mmol/L)5μl,10×扩增缓冲液[500 mmol/L KCl,100 mmol/L Tris-HCl(pH 8.4,20℃),150 mmol/L MgCl2,1 mg/ml明胶]2.5μl,模板DNA 1 μl,Taq DNA聚合酶(5 u/μl)1μl,加ddH2O至终体积为25μl。PCR循环参数:94℃预变性10 min,94℃变性30 s,55℃退火20 s,72℃延伸30 s,共35个循环,72℃继续延伸5 min。经2%琼脂糖电泳鉴定PCR产物并与Marker(日本TaKaRa公司,150 bp)进行比较,判断PCR扩增产物的准确性。
1.2.6 AREG基因rs2291715 SNP位点的核苷酸序列分析应用DNA直接测序技术检测病例组和对照组人群外周血AREG基因rs2291715 SNP位点的等位基因分布。将扩增的PCR产物进一步纯化,应用Beckman Coulter GeXP遗传分析系统(美国Beckman公司)进行双向测序,得出SNP位点周围的碱基序列图。应用DNAMAN软件将测定结果与Gen-Bank查询确定的AREG基因序列进行比对,比较测序结果与基因库中公布的基因序列之间的基因序列的差异。
1.3 统计学方法
数据分析采用SPSS 15.0统计软件,计量资料以均数±标准差(x±s)表示,用t检验;计数资料以百分率表示,用χ2检验。应用Logistic回归分析AREG基因rs2291715多态位点与结直肠癌间的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清AREG、CEA、CA50、CA242水平比较
病例组与对照组的血清AREG、CEA、CA50、CA242水平比较,经t检验,差异有统计学意义(P<0.05),病例组血清AREG、CEA、CA50、CA242水平高于对照组。见表1。
2.2 AREG基因rs2291715 SNP位点直接测序结果
PCR产物纯化后双向测序结果显示,AREG基因rs2291715 SNP位点存在2种等位基因C和G,共有3种基因型:GG(突变纯合子)、CG(突变杂合子)、CC(野生型)。见附图。
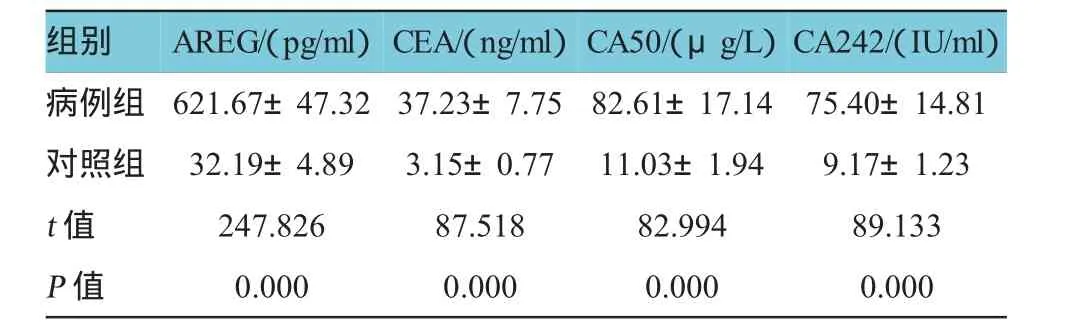
表1 两组血清AREG水平比较(n=400,x±s)
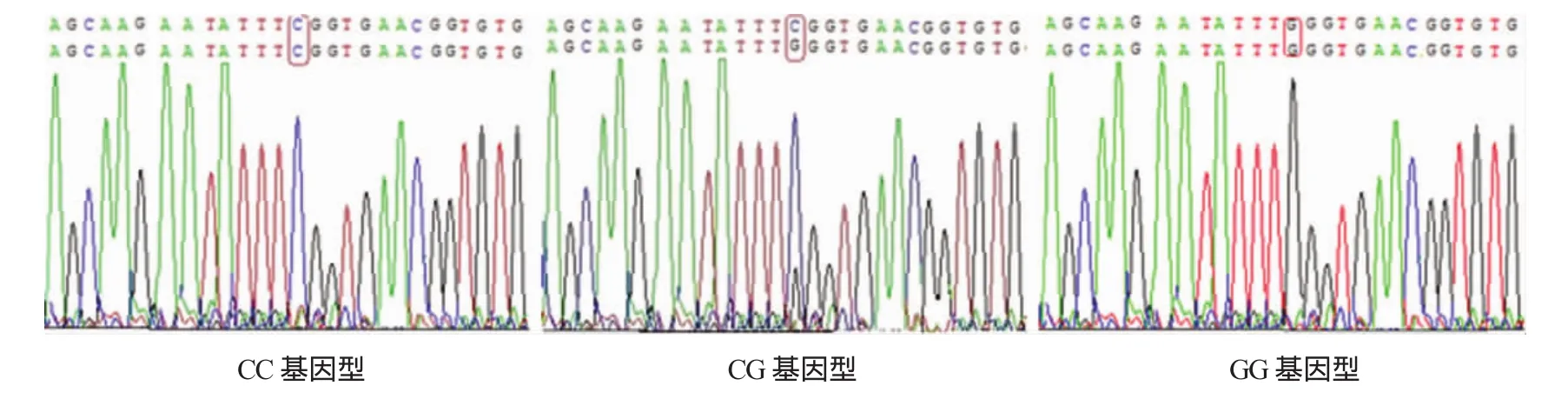
附图AREG基因rs2291715 SNP位点基因序列图
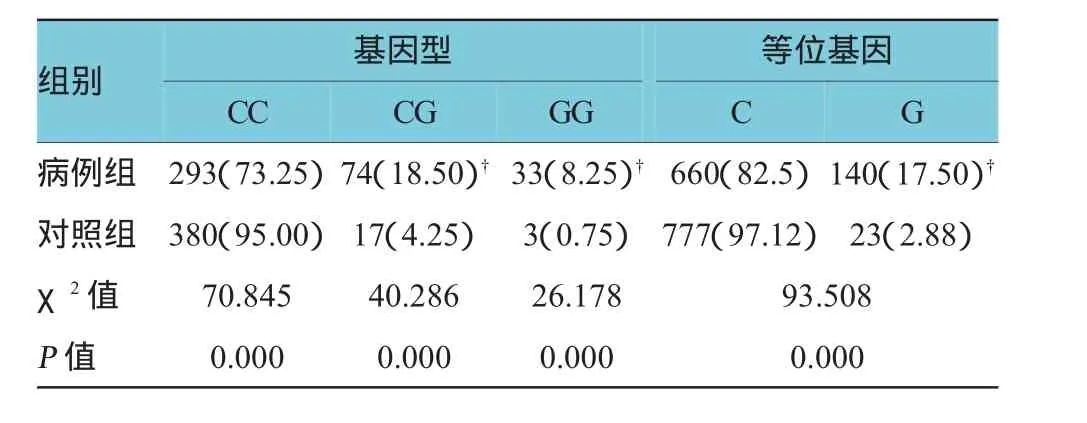
表2 两组AREG基因rs2291715 SNP位点多态性基因型和等位基因频率分布比较[n=400,例(%)]
2.3 两组AREG基因rs2291715 SNP位点多态性基因型和等位基因频率分布比较
病例组与对照组GG、CG基因型频率比较,经χ2检验,差异有统计学意义(P<0.05),病例组GG、CG基因型频率均高于对照组。病例组与对照组G等位基因频率比较,经χ2检验,差异有统计学意义(P<0.05),病例组G等位基因频率高于对照组。见表2。
2.4 两组AREG基因rs2291715 SNP位点不同基因型血清AREG水平的比较
病例组和对照组按GG、CG、CC基因型进一步分组后,病例组中GG、CG基因型AREG水平与CC基因型比较,经t检验,差异有统计学意义(t=18.252、7.067,P=0.000),病例组GG、CG基因型AREG水平均高于CC基因型,而GG基因型AREG水平又高于CG基因型(t=14.381,P=0.000)。对照组中GG、CG基因型AREG水平与CC基因型比较,经t检验,差异有统计学意义(t=17.423、9.658,P=0.000),GG、CG基因型AREG水平均高于CC基因型,而GG基因型AREG水平亦高于CG基因型(t=11.955,P=0.000)。见表3。
2.5 Logistic回归分析AREG基因rs2291715 SNP位点与结直肠癌间的相关性
以有无患结直肠癌(无=0,有=1)为因变量,以年龄、性别、CEA、CA242、CA50、AREG基因rs2291715 SNP位点基因型[CC(0,0),CG(0,1),GG(1,0)]为自变量,进行Logistic回归分析,结果显示,GG基因型与结直肠癌关系密切,AREG基因rs2291715 SNP位点GG基因型是结直肠癌发生、发展的独立危险因素[^OR=8.936(95%CI:1.539,48.246),P=0.009]。见表4。
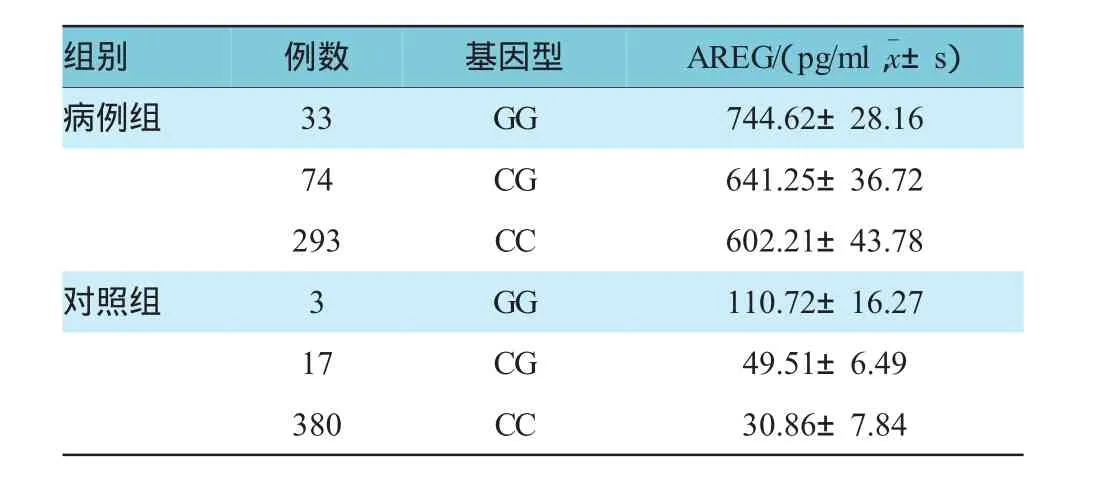
表3 病例组与对照组AREG基因rs2291715 SNP位点不同基因型血清AREG水平的比较

表4 Logistic回归分析结果
3 讨论
结直肠癌是临床常见的消化道恶性肿瘤之一,该病的发生率随着生活水平的提高不断上升,对人民健康造成严重危害[8]。结直肠癌早发现、早诊断、早治疗会很好地改善预后。因此,找到一种敏感性高、特异性强、便于监测的指标用于结直肠癌的诊断治疗十分重要。AREG是一种促癌因子,研究显示,AREG具有促癌作用,与肿瘤的发生、侵袭、转移密切相关[4-7]。AREG具有两方面的作用,一方面促进机体多种细胞的生长分化、代谢更新,另一方面可以抑制机体细胞尤其包括肿瘤细胞的增殖。AREG通过介导肿瘤细胞之间,以及肿瘤细胞与周围组织细胞的相互作用,激活多条信号转导通路,帮助肿瘤细胞实现免疫逃避,促进肿瘤细胞的增殖、侵袭和远处转移,加快肿瘤的生长[9-10]。有研究证实,AREG在多种人类恶性肿瘤中高表达,尤其是在发生局部侵袭或远处转移的肿瘤中表达明显增强。在本研究中,笔者检测结直肠癌患者外周血中AREG的水平,发现病例组血清AREG水平高于对照组,这与上述研究结果一致。
AREG是表皮生长因子(epidermal growth factor,EGF)家族的成员之一,位于4号染色体长臂1区3带3亚带,其相对分子质量为9 912 bp,共6个外显子,8个内含子,经转录、翻译、剪切形成252个氨基酸的mRNA,属于跨膜糖蛋白的一种[11]。AREG在恶性肿瘤中的异常表达与其基因位点突变密切相关。本研究涉及的AREG基因rs2291715是第4外显子上的SNPs位点,该位点存在C和G 2种等位基因,野生型为CC基因型。当第5 301位碱基由C突变为G,导致第177位氨基酸由TTC(苯丙氨酸,F)突变为TTG(亮氨酸,L)。目前有关AREG基因的rs2291715位点多态性与结直肠癌关系的报道还很少见。
本研究采用DNA直接测序法检测病例组和对照组的目的基因组DNA,结果显示,病例组AREG基因GG、CG基因型频率和G等位基因频率均高于对照组,提示AREG基因rs2291715 SNPs位点突变与结直肠癌有关,是结直肠癌发生的危险因素。同时本实验将病例组和对照组患者根据rs2291715 SNPs位点不同的基因型进行分组,结果发现,无论是病例组还是对照组,GG基因型和CG基因型患者血清中AREG的水平高于CC基因型,GG基因型患者血清中AREG的水平高于CG基因型,由此可见,G等位基因与AREG的表达密切相关。推测G等位基因突变,促进AREG蛋白水平的高表达,从而促进肿瘤的发生、发展。
为进一步观察AREG基因rs2291715 SNPs位点突变的影响,本研究还检测与结直肠癌关系密切的肿瘤标志物的表达,发现病例组的肿瘤标志物水平高于对照组。Logistic回归分析结果显示,GG基因型是结直肠癌发生转移的重要危险因素,进一步证实AREG基因rs2291715 SNPs位点多态性与结直肠癌的发生、发展有关。
综上所述,AREG基因rs2291715 SNPs位点多态性与结直肠癌的发生、发展、转移密切相关,推测该基因位点突变通过促进AREG在机体内异常高表达,从而导致肿瘤的发生、进展和转移。因此,加强对AREG基因rs2291715 SNPs位点多态性的检测有助于帮助临床医师早期发现结直肠癌,早期诊断,早期治疗,更好地掌握患者肿瘤进展的状况,把握手术时机,提高患者的生存率,争取改善患者的总体预后。
[1]BECHTOLD ML,ASHRAF I,NGUYEN DL.A clinician's guide to fecal occult blood testing for colorectal cancer[J].South Med J, 2016,109(4):248-255.
[2]ONG ML,SCHOFIELD J B.Assessment of lymph node involve ment in colorectal cancer[J].World J Gastrointest Surg,2016,8(3): 179-192.
[3]TEZCAN G,TUNCA B,AK S,et al.Molecular approach to genetic and epigenetic pathogenesis of early-onset colorectal cancer[J]. World J Gastrointest Oncol,2016,8(1):83-98.
[4]YONESAKA K,TAKEGAWA N,SATOH T,et al.Combined analysis of plasma amphiregulin and heregulin predicts response to cetuximab in metastatic colorectal cancer[J].PLoS One,2015, 10(11):e0143132.
[5]PETERSON E A,JENKINS E C,LOFGREN K A,et al.Amphiregulin is a critical downstream effector of estrogen signaling in ERα-positive breast cancer[J].Cancer Res,2015,75(22): 4830-4838.
[6]LIU J F,TSAO Y T,HOU C H.Amphiregulin enhances intercellular adhesion molecule-1 expression and promotes tumor metastasis in human osteosarcoma[J].Oncotarget,2015,6(38):40880-40895.
[7]YUAN C H,SUN X M,ZHU C L,et al.Amphiregulin activates regulatory T lymphocytes and suppresses CD8+T cell-mediated anti-tumor response in hepatocellular carcinoma cells[J].Oncotarget,2015,6(31):32138-32153.
[8]RESCH A,LANGNER C.Risk assessment in early colorectal cancer:histological and molecular markers[J].Dig Dis,2015,33(1): 77-85.
[9]CARVALHO S,LINDZEN M,LAURIOLA M,et al.An antibody to amphiregulin,an abundant growth factor in patients' fluids, inhibits ovarian tumors[J].Oncogene,2016,35(4):438-447.
[10]CHEN J C,CHEN Y J,LIN C Y,et al.Amphiregulin enhances alpha 6 beta 1 integrin expression and cell motility in human chondrosarcoma cells through Ras/Raf/MEK/ERK/AP-1 pathway[J]. Oncotarget,2015,6(13):11434-11446.
[11]GUZMAN M J,SHAO J,SHENG H.Pro-neoplastic effects of amphiregulin in colorectal carcinogenesis[J].J Gastrointest Cancer,2013,44(2):211-221.
(童颖丹 编辑)
Correlation of polymorphism of amphiregulin gene in peripheral blood with colorectal cancer and significance*
Xiao Wu1,Ai-jun Wang1,Hong-yu Wang1,Jin-heng Xu2,Bao-jun Zheng1, Jian Cheng1,Chao Zhang1,Hua Shi1,Jun-wei Feng1
(1.Department of Surgical Oncology,2.Department of Pathology, Tangshan Gongren Hospital,Tangshan,Hebei 063000,China)
ObjectiveTo investigate the relationship of rs2291715 locus polymorphism of amphiregulin (AREG)gene in peripheral blood with colorectal cancers and its significance.MethodsIn this study,400 colorectal cancer patients treated in our department from Jan.2012 to Dec.2015 were recruited as case group,and 400 healthy people who
health examination during the same period were enrolled as control group.Levels of AREG,CEA,CA50 and CA242 in peripheral blood of both groups were separately detected.Then PCR amplification combined with DNA direct sequencing was applied to test rs2291715 locus polymorphism of AREG gene in peripheral blood.Based on different genotypes,both groups were classified and observed for the change of AREG level in peripheral blood.Logistic regression analysis was used to evaluate the relationship between rs2291715 polymorphism of AREG gene and colorectal cancer.ResultsSerum levels of AREG,CEA,CA50 and CA242 in the case group were higher than those in the control group(P<0.05).There were 2 kinds of allelic genes C and G in the rs2291715 locus of AREG gene,and 3 kinds ofgenotypes GG,CG and CC were discovered.The frequency of GG and CG genotypes and allelic gene G in the case group was higher than that in the control group(P<0.05).Logistic regression analysis showed that GG genotype and allelic gene G were closely related to the development of colorectal cancer and were the independent risk factors for colorectal cancer[OR^=8.936(95%CI:1.539,48.246),P=0.009].ConclusionsPolymorphism of AREG gene rs2291715 locus is closely related to carcinogenesis and progression of colorectal cancer.
colorectal cancer;amphiregulin gene;gene polymorphism;peripheral blood
R735.3
A
10.3969/j.issn.1005-8982.2017.01.010
1005-8982(2017)01-0050-05
2016-04-22
河北省科技计划项目(No:16277702D)
王爱军,E-mail:wajts@126.com;Tel:0315-3722178
