C18—酸基双改性液相色谱固定相的制备与评价
2017-02-06唐涛张维冰徐基伟夏明珠贡雪东王
唐涛+张维冰+徐基伟+夏明珠+贡雪东+王风云+李彤
摘 要 以十八烷基三氯硅烷和3.巯丙基三甲氧基硅烷为改性剂,采用一锅法对硅胶表面加以修饰,进一步将巯基氧化制备成C 18.磺酸基双改性液相色谱固定相。在优化的反应条件下得到了十八烷基和磺酸基摩尔比为3∶7的固定相,分别采用扫描电镜、元素分析、红外光谱对固定相的形貌和特征加以表征。针对制备的固定相,在不同的分离模式下,系统考察其色谱分离性能。在反相色谱模式下,成功分离了5种烷基苯化合物; 在亲水模式下,分离了3种核苷; 进一步应用于牛血清白蛋白酶解产物的分离,得到了较好的结果。实验结果表明, 制备的混合模式固定相同时具有多种分离机理,在分离复杂样品、调整选择性方面具有潜在的优势。
关键词 混合模式色谱固定相; 反相色谱; 亲水作用色谱; 3.巯丙基三甲氧基硅烷
1 引 言
随着药物组学、蛋白质组学、代谢组学等学科的快速发展,需要分析的样品越来越复杂,对高效液相色谱的分离能力也提出了更高要求。高效液相色谱的分离介质,从最初的无定形硅胶发展到多孔硅胶、金属氧化物微球以及聚合物整体柱等,针对不同的分析目的,已经研制出了大量具有特殊结构的液相色谱填料,为色谱分离方法发展提供了更多的选择。
在硅胶表面的硅羟基上键合新型官能团、双官能团,如聚乙二醇[1]、聚丙烯酰胺[2]、胡敏酸[3]、肽段[4]、氨基酸[5,6]等,并应用于复杂样品的分离一直是该领域研究的热点。 Wei等[7]以3.氯丙基三氯硅烷和十八烷基三氯硅烷为改性剂,制备了一种反相/强阴离子交换混合模式固定相,并进一步将制备的固定相应用于固相萃取马兜铃酸。Dabre等[8]利用一种新型的反相/弱阴离子交换色谱柱,实现了7种水溶性维生素和3种脂溶性维生素混合物的基线分离。Zhao等[9]采用活化硅胶依次与3.缩水甘油醚氧丙基三甲氧基硅烷、叠氮化钠和N,N.二乙基丙炔胺反应,制备了一种弱阴离子交换/亲水双模式色谱固定相,并利用制备的同一支色谱柱通过两次不同模式的分离,实现了离线二维分离9种蛋白质。彭西甜等[10]制备了一种辛基.羧基共同键合的反相/弱阳离子交换混合色谱固定相,成功应用于3种阳离子表面活性剂、6种抗抑郁药的分离。Shen等[11]通过巯基.烯烃点击化学反应,制备了多种适用于极性物质分离的色谱固定相,并应用于二维色谱分离模式。在我们的前期工作[12]中,针对反相和离子交换混合固定相,在电色谱的模式下系统研究了溶质的保留特性,取得了较好的基础。在固定相表面进行多种模式改性,可以使固定相在分离过程中提供不同分离机理的多位点的相互作用,对复杂样品的分离表现出良好的选择性。
本研究在硅胶表面同时键合十八烷基三氯硅烷与3.巯丙基三甲氧基硅烷,并通过氧化巯基制备双改性固定相,使其具有多种保留机理,并应用于不同模式的色谱行为研究。
2 实验部分
2.1 仪器与试剂
P1201高效液相色谱仪,配有P1201高压恒流泵、UV1201紫外.可见检测器、EC2006色谱数据工作站(大连依利特分析仪器有限公司); Vario EL型有机元素分析仪(德国Elementar公司); Tensor27红外光谱仪(德国布鲁克公司); pH酸度计(Mettler Toledo公司); JSM.7800F超高分辨热场发射扫描电子显微镜(JEOL,日本电子株式会社)。
5 μm球形硅胶(169 m2/g,120 , ThermoFisher公司); 十八烷基三氯硅烷(95%, 0.984 g/mL)、3.巯丙基三甲氧基硅烷(97%, 1.057 g/mL)、胰蛋白酶(Trypsin)、牛血清白蛋白(98%, Albumin from bovine serum, BSA)、二硫苏糖醇(98%, Dithiothreitol, DTT)、尿苷、肌苷、鸟苷(北京百灵威科技有限公司); 碘乙酰胺(99%, Iodoracetamide, IAA, Amresco公司); 甲苯、乙苯、丙苯、丁苯、戊苯、盐酸、过氧化氢、二氯甲烷、浓H2SO4(98%)、醋酸铵、三乙胺、尿素、NH4HCO3(天津科密欧试剂有限公司); 甲醇、乙腈(色谱纯,美国TEDIA试剂公司)。
2.2 C 18.磺酸基双改性液相色谱固定相的制备
考察了十八烷基三氯硅烷和3.巯丙基三甲氧基硅烷投料比分别为1∶1、2∶1、4∶1的键合率,并最终选择1∶1作为后续实验的投料比,具体实验步骤如下:称取3 g硅胶于150 mL圆底烧瓶中,加入50 mL HCl、20 mL水,在110℃下搅拌回流8 h,过滤,使用500 mL水,分5次洗涤,120℃下真空干燥过夜,得到活化硅胶(Activated silica,AS)。将AS加入250 mL三口烧瓶中,依次加入50 mL甲苯、1.0 mL十八烷基三氯硅烷、0.5 mL 3.巯丙基三甲氧基硅烷,50 μL三乙胺,氮气保护、100℃搅拌回流24 h,过滤,依次用100 mL二氯甲烷、50 mL甲醇、100 mL水、50 mL甲醇洗涤,80℃下真空干燥过夜,得到C 18.巯基键合硅胶(Octadecyl.mercapto silica, OMS)。将OMS加入到150 mL圆底烧瓶中,依次加入15 mL甲醇、50 mL 30% H2O2、20 μL浓H2SO4,25℃下搅拌反应20 h,过滤,依次用100 mL水、100 mL甲醇洗涤,80℃下干燥过夜,得到目标产物C 18.磺酸基双改性固定相(Octadecyl.sulfonic silica, OSS)。C 18.磺酸基双改性色谱固定相的制备路线见图1。
2.3 色谱柱的装填
采用高压等密度匀浆技术,准确称取2.2 g 固定相于50 mL烧杯中,配制匀浆液,超声; 倒入匀浆罐中,用顶替液加压,装色谱柱(150 mm × 4.6 mm i.d.)进行后续评价。
2.4 BSA酶解样品的制备
称取1.0 mg BSA溶于8 mol/L 尿素和100 mmol/L NH4HCO3缓冲液(pH 8.0)中; 加入8 μL 1 mol/L DTT ,60℃水浴锅中反应2 h; 加入20 μL 1 mol/L IAA,常温下避光反应0.5 h; 随后使用100 mmol/L NH4HCO3将样品中尿素浓度稀释至1.0 mol/L,并按质量比1∶25加入胰蛋白酶,37℃下反应过夜; 最后,将得到的蛋白质酶解液调至酸性,除盐后冻干, 待用。
3 结果与讨论
3.1 固定相的表征
3.1.1 电镜扫描 硅胶改性前后的扫描电镜图如图2所示。从图2a和图2b可见,改性前后,硅胶颗粒直径、粒度大小分布没有明显变化。对比放大图(图2c和2d)可见,硅胶微球表面的多孔结构也没有明显改变,仅是改性后的表面略显粗糙。间接说明改性实验对硅胶粒度和多孔结构没有影响,表面微小的变化也符合硅胶表面改性实验设计。
3.1.2 元素分析 对C 18.磺酸基双改性固定相制备过程中各步产物进行了元素分析,结果如表1所示。固定相中含有C、H、S元素,表明十八烷基三氯硅烷、3.巯丙基三甲氧基硅烷均已成功键合到硅胶表面。根据元素分析结果推算出固定相中十八烷基与磺酸基的摩尔比为3∶7; 参考公式[13],计算出十八烷基表面覆盖率为1.0 μmol/m2,磺酸基为2.37 μmol/m2。计算所得键合相之比与投料比不同的原因可能是十八烷基在反应过程中受到的空间位阻效应较大,导致键合到硅胶表面的量较少。
3.2 固定相的色谱行为评价
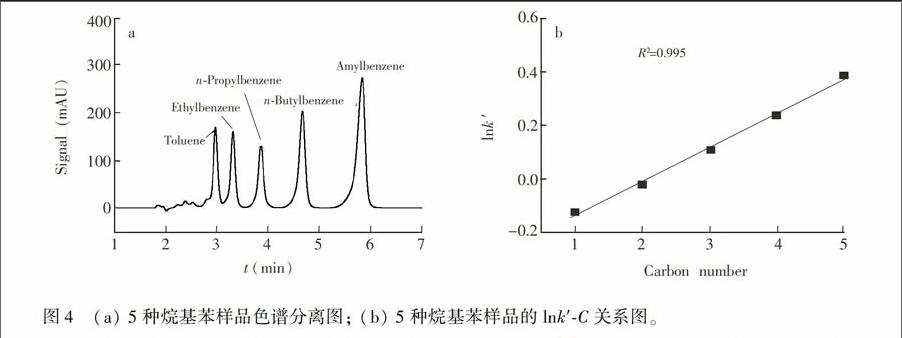
3.2.1 反相色谱模式 使用5种烷基苯作为分析样品,考察固定相在反相色谱模式中的色谱行为。从图4a可见,固定相对烷基苯具有很好的分离选择性,5种样品均得到了基线分离。按照卢佩章等[14]阐述的同系物保留值的碳数规律,在反相色谱分离模式中,lnk′与同系物的碳数成线性关系。以5种烷基苯的lnk′为纵坐标,含碳数为横坐标,做lnk′.C关系图,如图4b所示,线性关系良好, R2=0.995,说明制备的固定相具有典型的疏水作用保留机理。
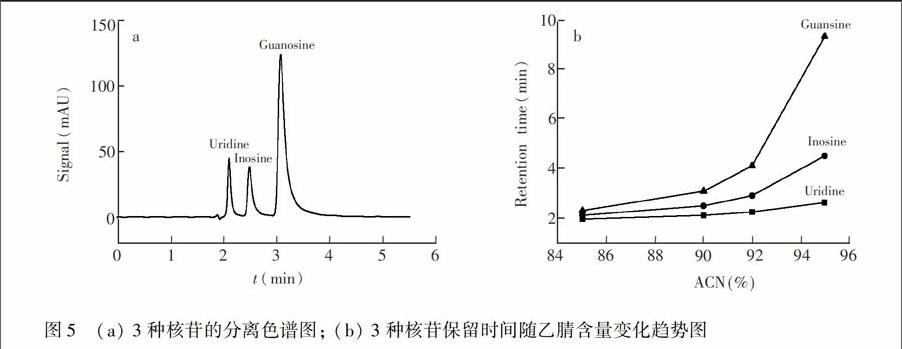
3.2.2 亲水作用色谱模式 使用3种核苷样品作为探针,考察这些物质在该固定相上的色谱保留性能。由图5a可知,固定相对3种核苷具有很好的分离选择性。进一步改变流动相中乙腈含量,考察其对核苷类物质保留的影响,结果表明,当乙腈含量大于80%时,随着乙腈含量的不断升高,3种核苷的保留时间逐渐增加,如图5b所示,说明固定相具有典型的亲水作用保留机理。
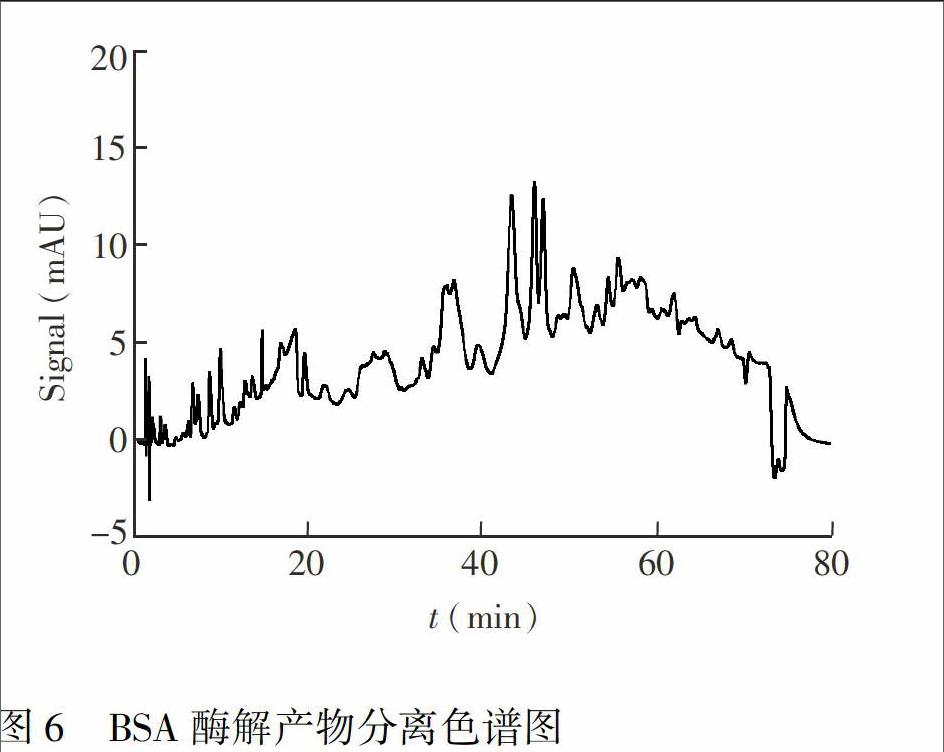
3.2.3 BSA酶解产物的分离 很多的研究报道[15,16]采用BSA酶解产物作为评价固定相分离性能的样品。BSA酶解产物是一种典型的蛋白质类复杂样品,同时具有疏水、亲水等成分,单一的分离模式很难取得理想效果。采用制备的混合固定相,分离BSA酶解产物的谱图如图6所示,以1 mAU为积分门槛,共识别谱峰27个,获得了较好的分离效果。
4 结 论
利用“一锅法”,将十八烷基三氯硅烷和3.巯丙基三甲氧基硅烷键合到硅胶表面,进一步氧化制得C 18.磺酸基混合固定相。通过扫描电镜、元素分析、红外光谱分析,证明了双改性基团被成功键合。采用制备的固定相,在反相模式下分离了5种烷基苯化合物,在亲水模式下分离了3种核苷,并在分离BSA酶解产物时获得了良好结果,说明固定相能提供多个活性位点,同时具有多重分离机理,尤其适合于蛋白质类的复杂样品分离。
References
1 Song C, Wang J S, Zhao K L, Bai Q. Biomed. Chromatogr., 2013, 27: 1741-1753
2 YANG Duo, YU Dong.Ping, DONG Xue.Fang, SHEN Ai.Jin, JIN Gao.Wa, GUO Zhi.Mou, YAN Jing.Yu, LIU Ming.Yang, LIANG Xin.Miao. Chinese J. Anal. Chem., 2015, 43(10): 1439-1444
杨 铎, 俞冬萍, 董雪芳, 沈爱金, 金高娃, 郭志谋, 闫竞宇, 刘名扬, 梁鑫淼. 分析化学, 2015, 43(10): 1439-1444
3 Gezici O, Kara H. Talanta, 2011, 85(3): 1472-1482
4 Ray S, Takafuji M, Ihara H. J. Chromatogr. A, 2012, 1266: 43-52
5 Aral T, Aral H, Ziyadanoullar B, Ziyadanoullar R. Talanta, 2015, 131: 64-73
6 Wu S J, Li X L, Zhang F F, Jiang G, Liang X M, Yang B C. Analyst, 2015, 140: 3921-3924
7 Wei J, Guo Z M, Zhang P J, Zhang F F, Yang B C, Liang X M. J. Chromatogr. A, 2012, 1246: 129-136
8 Dabre R, Azad N, Schwmmle A, Lmmerhofer M, Lindner W. J. Sep. Sci., 2011, 34 (7): 761-772
9 Zhao K L, Yang F, Xia H J, Wang F, Song Q G, Bai Q. J. Sep. Sci., 2015, 38: 703-710
10 PENG Xi.Tian, WANG Yu, FENG Yu.Qi. Chinese Journal of Chromatography, 2013, 31(4): 329-334
彭西甜, 王 钰, 冯钰琦. 色谱, 2013, 31(4): 329-334
11 Shen A J, Guo Z M, Cai X M, Xue X Y, Liang X M. J. Chromatogr. A, 2012, 1228: 175-182
12 ZHANG Wei.Bing, ZHANG Li.Hua, ZHANG Ling.Yi, ZHANG Yu.Kui. Chinese Journal of Chromatography, 2002, 20(4): 295-298
张维冰, 张丽华, 张凌怡, 张玉奎. 色谱, 2002, 20(4): 295-298
13 Berthod A,Chang C D, Armstrong D W. Talanta, 1993, 40(9): 1367-1373
14 LU Pei.Zhang, DAI Chao.Zheng, ZHANG Xiang.Min. Fundamentals of Chromatography Theory. Beijing: Science Press, 1997: 282-285
卢佩章, 戴朝政, 张祥民. 色谱理论基础. 北京: 科学技术出版社, 1997: 282-285
15 WEI Juan, GU Xue, WANG Yan, YAN Chao. Chinese J. Anal. Chem., 2011, 39(2): 188-192
魏 娟, 谷 雪, 王 彦, 阎 超. 分析化学, 2011, 39(2): 188-192
16 XIE Jing.Xin, BI Kai.Shun, QIAN Xiao.Hong, ZHANG Yang.Jun. Chinese Journal of Chromatography, 2009, 27(2): 186-190
谢晶鑫, 毕开顺, 钱小红, 张养军. 色谱, 2009, 27(2): 186-190
Abstract A C 18.sulfonic group dual modification chromatographic stationary phase was prepared by one.pot reaction to modify the surface of silica with two modifier of octadecyltrichlorosilane (OTS) and trimethoxysilylpropanethiol (MPS) and oxidize the thiol group. Under the optimized reaction conditions, the stationary phase with a mole ratio of 3∶7 between C 18 and sulfonic group was obtained. The morphology and feature of the stationary phase were characterized by scanning electronic microscopy, elemental analysis and infrared spectra. The chromatographic properties of the prepared stationary phase were systematically investigated in different separation modes. Five alkyl benzenes and three nucleosides were separated successfully in reversed phase chromatography and hydrophilic interaction chromatography respectively. The bovine serum albumin digests could also be separated well on the stationary phase. The results indicated that the prepared mixed.mode stationary phase could provide multiple separation mechanism and had potential advantages in separating complex samples and adjusting the selectivity.
Keywords Mixed.mode chromatography stationary phase; Reversed phase chromatography; Hydrophilic interaction chromatography; 3.Mercaptopropyltrimethoxysilane