miRNA-93在PCOS大鼠血清中的表达
2017-02-06邢莹莹李青春韩艳艳李小琳
邢莹莹,李青春,韩艳艳,李小琳
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是生殖功能障碍与糖代谢异常并存的一种特殊疾病。多以高雄激素血症、持续性无排卵或排卵障碍、胰岛素抵抗和高脂血症为主要特点[1]。目前对PCOS的研究多借助于动物实验,PCOS的造模方法有很多,其中脱氢表雄酮(dehydroepi androsterone,DHEA)造模是比较理想的造模方法[2],从生殖和代谢方面全面评估模型动物的表型特征,为PCOS模型的建立奠定研究基础。
微小RNA(miRNA)是一类约由19~25个核苷酸组成内源性非编码小分子RNA,通过抑制转录后基因表达或促进靶基因mRNAs降解发挥重要的调节作用[3]。每个miRNA都可以调控上百个基因的表达,据推测,人类基因组上约有1/3基因的表达都受到miRNA的调控[4]。近年来,血液中的miRNA又称为循环miRNA,血清中miRNA含量丰富,结构稳定,耐核酸酶并且容易检测到[5-6],在疾病的早期筛查、区分高危人群等方面具有广阔的应用前景。循环miRNA的含量变化可作为多种疾病的诊断标志物。本文旨在研究miRNA-93及靶基因血管内皮生长因子A(vascular endothelial growth factor, VEGFA)在PCOS大鼠模型血清中的表达及相关作用,以期为PCOS的诊断和治疗提供新的靶点,现报道如下。
1 材料和方法
1.1材料
1.1.1实验动物选用3周龄雌性SD清洁级大鼠40只,体质量(50±20) g,由河南省动物实验中心提供,生产许可证号:SCXK(豫)2015-0001。大鼠饲养于河南科技大学第一附属医院新区医院实验动物中心,饲养于IVC专用笼,喂食标准饲料,饮用水使用大鼠专用水,笼内垫料每周更换2次,动物实验中心温度维持在(22±1) ℃,湿度为50%左右,明暗交替周期设为12 h。
1.1.2主要试剂及仪器DHEA购于索莱宝公司,注射用大豆油购于RUBIO公司。miRNA提取试剂盒、miRNA Cdna Synthesis Kit、miRNA qPCR Assay Kit,均购于康为世纪生物科技有限公司。50%葡萄糖注射液大鼠胰岛素(insulin,INS)酶联免疫吸附测定试剂盒,武汉优尔生商贸有限公司,大鼠VEGFA酶联免疫吸附实验试剂盒,武汉优尔生商贸有限公司,INS酶联免疫吸附测定试剂盒,武汉优尔生商贸有限公司。荧光定量PCR仪器(美国伯乐公司,Thermo Heraeus Multifuge X1R台式高速冷冻离心机(美国Thermo公司)。罗氏优越型血糖仪(德国ROCHE公司)。
1.2方法
1.2.1构建动物模型将40只雌性SD大鼠随机分为观察组和对照组,每组20只,观察组大鼠每日颈背部皮下注射DHE6 mg·100 g-1体质量+0.2 mL无菌注射用油,对照组每日颈背部皮下注射0.2 mL无菌注射用油剂。均于上午10时,连续皮下注射28 d。
1.2.2标本取材在造模28 d结束后,5%水合氯醛腹腔注射麻醉后摘眼球法,取5~10 mL血,室温放置1 h,以2 000 r·min-1离心10 min,分离血清后进行解剖,取双侧卵巢,用磷酸盐缓冲液(phosphate buffer,PBS)溶液清洗,显微镜下分离卵巢多余的脂肪组织,并称重。固定于中性福尔马林溶液中,进行石蜡包埋切片,用于HE染色。
1.2.3观察内容及方法①每日记录大鼠体质量,解剖后用电子体质量测量仪、电子精密天平及游标卡尺测量子宫、卵巢质量。卵巢质量为左、右卵巢之和。②动情周期:连续2个周期(每个周期4~5 d)进行阴道脱落细胞涂片,采用巴氏染色法观察大鼠动情周期。③酶联免疫吸附实验试剂盒(购于武汉优尔生商贸有限公司)检测大鼠血清INS、VEGFA。④观察两组大鼠双侧卵巢大体解剖,石蜡包埋卵巢组织,进行HE染色,光镜下观察其组织形态。⑤口服胰岛素耐量实验(insulin tolerance test,ITT):大鼠禁食不禁水12 h,分别以0.5 U·kg-1的剂量腹腔注射50%胰岛素,鼠尾尖取血,用罗氏优越型血糖仪(德国 ROCHE 公司)测定大鼠灌胰岛素后0、15、30、60、120 min的血糖值。⑥口服葡萄糖耐量实验(oral glucose tolerance test,OGTT):大鼠禁食不禁水12 h,以3 g·kg-1剂量灌服50% 葡萄糖溶液,尾尖取血,用血糖仪测定大鼠灌糖后0、15、30、60、120 min的血糖值。⑦计算稳态模型胰岛素抵抗指数(HOMA-IR):HOMA-IR=空腹血糖(mmol·L-1)×空腹胰岛素(mIU·L-1)/22.5。⑧血脂测定:应用全自动免疫发光仪(西门子DPC IMMULITE 2000)测定大鼠黄体生成激素(LH)、促卵泡成熟激素(FSH)、睾酮(T)、雌二醇 (E2)及代谢指标血清胆固醇(TC)、甘油三酯(TG)。⑨RT-PCR检测大鼠血清miRNA-93表达引物借助https://www.ncbi.nlm.nih.gov/网站进行设计,委托上海生工有限公司合成。具体步骤按miRNA提取试剂盒、miRNA Cdna Synthesis Kit、实时定量荧光PCR试剂盒检测说明书操作(均购于康为世纪生物科技有限公司),miRNA-93上游引物:5’-TGCGCCAAAGTGCTGTTCGTGCA-3’,miRNA-93下游引物为试剂盒通用引物,扩增产物为:100bp,内参为U6,上游引物为5’-CGCTTCGGCAGCACATATAC-3’,下游为5’-AAATATGGAACGCTTCACGA-3’,扩增产物为:110 bp,采用2-△△Ct法进行分析。
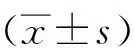
2 结果
2.1大鼠体质量、腹围、卵巢、子宫质量及比较观察组大鼠体质量、子宫质量明显高于对照组,有统计学意义(P<0.05)。大鼠腹围、卵巢模型组略高于对照组,但差异无统计学意义(P>0.05),见表1。

表1 两组大鼠体质量,腹围,卵巢、子宫质量及比较
注:①与对照组比较,P<0.01。
2.2大鼠动情周期的变化对大鼠进行2个周期(1个周期4~5 d)的阴道涂片巴氏染色观察动情周期,观察组大鼠动情周期不规律,提示无排卵;对照组动情周期规律(见图1)。动情前期(A)以小、圆、有核上皮细胞为主,持续时间12 h左右。动情期(B)持续时间9~15 h以不规则状无核上皮细胞为主。动情后期(C)有核上皮细胞,无核上皮细胞,白细胞均存在为主,持续时间14~18 h。间情期(D)白细胞为主,持续时间60~70 h。

图1 大鼠动情周期的变化(巴氏染色,×200)
2.3大鼠血清FSH、LH、T、E2水平变化观察组大鼠血清FSH、T、LH水平较对照组明显升高,两组比较,差异有统计学意义(P<0.05),两组LH比较,差异无统计学意义(P>0.05),E2水平较对照组明显降低,两组比较,差异有统计学意义(P<0.05)。结果见表2。

表2 两组大鼠血清 FSH、LH、T水平比较
注:①与对照组比较,P<0.01。FSH:促卵泡成热激素;LH黄体生成激素;T:睾酮;E2:雌二醇。
2.4大鼠血脂变化观察组大鼠血清甘油三酯(TG)水平明显高于对照组,差异有统计学意义(P<0.05)。观察组与对照组胆固醇(TC)水平比较,差异无统计学意义(P>0.05)。结果见表3。

表3 两组大鼠血清TC、TG比较
注:①与对照组比较,P<0.01。TG:甘油三酯;TC:胆固醇。
2.5卵巢形态学变化观察组大鼠卵巢表面苍白,体积增大;镜下见卵泡多呈囊性扩张,变成囊泡即空卵泡,颗粒细胞层数减少多为2~3层、排列疏松,各级卵泡及黄体少见。对照组大鼠卵巢色泽红,表面多个红点或紫点;镜下可见各级发育卵泡及多个黄体,卵泡内颗粒细胞呈多层,多为8~9层,结果见图2。

图2 大鼠卵巢切片(HE染色,×40)
2.6OGTT与ITT结果检测大鼠0、15、30、60、120 min血糖值。结果表明与对照组相比观察组大鼠不能诊断为糖尿病,而胰岛功能受损,结果见图3-4。
2.7两组大鼠空腹血糖、HOMAI-IR比较观察组空腹血糖(fasting blood glucose,FBG)值明显高于对照组(P<0.01),观察组大鼠空腹胰岛素(fasting insulin,FINS)、HOMAI-IR明显高于对照组,差异有统计学意义(P<0.01),说明大鼠存在胰岛素抵抗,结果见表4。

图3 糖耐量实验

图4 胰岛素耐量实验

组 别nFBG/(mol·L-1)FINS/(mIU·mL-1)HOMAI-IR观察组204.45±0.76①4.14±0.86①0.82±0.41①对照组203.65±0.50 1.34±0.34 0.22±0.05 t3.776.456.35P0.000.000.00
注:①与对照组比较,P<0.01。FBG:空腹血糖;FINS:空腹胰岛素;HOMAI-IR:胰岛素抵抗指数。
2.8ELISA检测血清中VEGFA的表达观察组VEGFA的表达较对照组显著增加,统计分析结果显示:观察组卵巢组织中VEGFA的表达增加(P<0.01),结果见表5。

表5 两组VEGFA水平比较
注:①与对照组比较,P<0.05。VEGFA:血管内皮生长因子。
2.9大鼠血清miRNA-93的表达量miRNA-93相对基因表达的结果显示:观察组与对照组中相对表达量分别为1.55∶1;SD为0.097、0.032。与对照组比较,miRNA-93在观察组大鼠血清中的表达升高,具有统计学意义(P<0.01,n=6),结果见图6。

A:观察组;B:对照组。1:mark;4~8:观察组;10~14:对照组。图6 荧光定量PCR检测miRNA-93结果
3 讨论
PCOS是育龄期女性常见的内分泌疾病,患病率为5%~10%,占无排卵性不孕患者的70%~80%[7]。病因至今尚未阐明,研究认为其可能是由于某些遗传基因与环境因素相互作用所致[8-9]。此外,一些细胞因子,如VEGFA也与不孕有关。有研究显示卵巢血管的生成与PCOS的发病机制密切相关[10]。PCOS的诊断标准在国际上一直存在较大的争议,目前比较广泛运用于临床的诊断标准主要有:2003年5月欧洲人类生殖和胚胎学会和美国生殖医学会(ESHRE/ASRM)鹿特丹会议提出的PCOS诊断标准[11]。2010年中华医学会妇产科分会内分泌学组专家学者制定的PCOS诊断标准[12]。现阶段临床医学关于PCOS的诊断方法有基础体温测定、B超、诊断性刮宫、腹腔镜以及内分泌测定等[13]。由于PCOS患者临床取材困难,大鼠具有价格低廉、遗传背景稳定、动情周期规律、便于集中管理监测等优点。采用雄激素诱导动物使其产生伴有胰岛素抵抗的PCOS模型已经成为经典可靠的实验模型[14]。本实验采用脱氢表雄酮造模方法构建PCOS大鼠模型,结果显示模型组中大鼠体质量增加、性周期紊乱、卵巢呈多囊状改变、卵泡成熟障碍,伴有高雄激素血症的同时还出现脂质代谢紊乱、血糖紊乱及胰岛素抵抗、高胰岛素血症。这与人类PCOS有很多相似之处,与国内外一些研究结果是一致的。
循环miRNA是一类在血清、血浆等体液中稳定存在的miRNA分子,具有差异表达明显、检测灵敏、取材方便等特点。大量研究表明循环miRNA在疾病诊断中也具有一定参考价值,可作为一种新型诊断标志物分子。近年来,人们发现在子宫、卵巢、输卵管等女性生殖器官中均有miRNA的表达,并广泛参与调控女性卵泡发育成熟、受精、着床及胚胎发育等生理过程,对维持女性正常生育功能起重要作用[15]。miRNA在PCOS性激素合成分泌、胰岛素抵抗、卵泡发育及成熟、细胞凋亡、炎症等方面均有一定调节作用[16]。PCOS患者脂肪组织中miRNA-93的高表达可导致GLUT4基因的表达下调,miRNA-93的高表达与胰岛素抵抗指数有很大的相关性[19]。研究表明miRNA-93可通过结合靶基因细胞周期素依赖性蛋白激酶抑制剂1A(CDKN1A)3′-UTR位点在PCOS患者中呈高表达,影响卵泡正常发育及成熟,导致排卵障碍及不孕[18]。PCOS患者血清中miRNAs表达谱存在差异,其异常的miRNAs表达通过影响基因转录后的水平,参与PCOS的发生发展。
VEGFA是一种特异的与血管内皮细胞结合而发挥作用的因子,其功能包括诱导血管生成、增加血管通透性[20]。VEGFA对血管的再生、卵泡血管化、卵泡内的氧化都发挥着重要作用,因此影响卵泡成熟、卵母细胞质量、受孕及胚胎的生长发育[21]。miRNA可以通过调节数个靶基因发挥不同作用,而一个靶基因则可被数个miRNA调控,其相互作用的互联网络十分复杂。Long等证实miRNA-93的靶基因是血管内皮生长因子A(VEGFA)[19]。本实验采用RT-PCR、ELISA分别检测PCOS大鼠血清中miRNA-93及靶基因VEGFA的表达水平,结果显示观察组与对照组相比血清中miRNA-93及靶基因VEGFA表达一致呈高表达,提示VEGFA在卵巢内异常表达、分泌并释放入血,可能是卵巢间质血管化增加的基础,最终导致PCOS患者无优势卵泡发育的原因之一。miRNA-93可通过结合靶基因VEGFA在PCOS患者中呈高表达,影响卵泡正常发育及成熟,导致排卵障碍及不孕。
综上所述,PCOS大鼠模型血清中miRNA-93及靶基因VEGFA表达上调,miRNA-93可能通过转录水平导致VEGFA蛋白增多,从而参与PCOS的发生发展,循环miRNA-93可许可以作为PCOS的一种新型的非侵入性的诊断标志物。然而miRNA在促进颗粒细胞增生、加速颗粒细胞凋亡、阻碍卵泡正常发育及成熟、影响性激素合成及分泌和增强胰岛素抵抗等方面的作用并不完善,仍需进一步深入研究,以揭示miRNA在PCOS中的作用机理,为今后PCOS的诊断和治疗提供新的依据和治疗靶点。
[1] Qiao J,Feng HL.Extra-and intra-ovarian factors in polycystic ovary syndrome: impact on oocyte maturation and embryo developmental competence[J].Hum Reprod Update,2010,17(1):17-33.
[2] Lee MT,Anderson E,Lee GY.Changes in ovarian morphology and serum hormones in the rat after treatment with dehydroepiandrosterone[J].Anat Rec,1991,231(2):185-192.
[3] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[4] Lewis BP,Burge CB,Bartel D.Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15.
[5] Bagga S,Bracht J,Hunter S,et al.Regulation by let-7,and lin-4,miRNAs Results in Target mRNA Degradation[J].Cell,2005,122(4):553-563.
[6] Zubakov D,Boersma AWM,Choi Y,et al.MicroRNA markers for forensic body fluid identification obtained from microarray screening and quantitative RT-PCR confirmation[J].Inter J Legal Med,2010,124(3):217-226.
[7] 梁晨,丛晶,吴效科.多囊卵巢综合征患者血脂异常类型及病理生理改变的研究进展[J].现代妇产科进展,2011,22(2):144-145.
[8] Qiao J,Feng HL.Extra-and intra-ovarian factors in polycystic ovary syndrome: impact on oocyte maturation and embryo developmental competence[J].Hum Reprod Update,2010,17(1):17-33.
[9] Eriksen MB,Nielsen MF,Brusgaard K,et a1.Genetic alterations within the DENNDl A gene in patients with polycystic ovary syndrome(PCOS)[J].PLoS One,2013,8(9):e77186.
[10] Diamamti-kandarakis E,Christakouc,Marinakis E.Phenotypes and enviromental factors:their influence in PCOS[J].Curr Pharm Des,2012,18 (3):270-282.
[11]田晓敏.多囊卵巢综合征诊断与治疗新进展[J].世界最新医学信息文摘:电子版,2016,16(32):41-42.
[12]谷伟军.多囊卵巢综合征的诊断和治疗国内外指南解读[J].药品评价,2016,13(3):5-8.
[13]莫燕奇.穴位注射治疗多囊卵巢综合征不孕不育效果分析[J].现代诊断与治疗,2016,27(15):2784-2785.
[14]温宜萍,钟刚. Htra1 mRNA在PCOS大鼠卵巢颗粒细胞中的表达及意义[J].2010,18(7):10-12.
[15]Bagga S,Bracht J,Hunter S,et al.Regulation by let-7,and lin-4,miRNAs results in target mRNA degradation[J].Cell,2005,122(4):553-563.
[16]S rensen AE,Wissing ML,Sal S,et al.MicroRNAs related to polycystic ovary syndrome (PCOS)[J].Genes,2014,5(3):684-708.
[17]Chen Y H, Heneidi S, Lee J M, et al. miRNA-93 Inhibits GLUT4 and is overexpressed in adipose tissue of polycystic ovary syndrome patients and women with insulin resistance[J]. Diabetes, 2013, 62(7):2278.
[18]Jiang L, Huang J, Li L, et al. MicroRNA-93 promotes ovarian granulosa cells proliferation through targeting CDKN1A in polycystic ovarian syndrome[J]. J Clinic Endocrinol Metabol,2015,100(5):E729.
[19]Long JY,Wang Y,Wang WJ,et a1.Identification of microRNA-93 as a novel regulator of vascular endothelial growth factor in hyper-glycemie eonditions[J].Bid Chem,2010,285(30):23457-23465.
[20]Lee EJ,Oh B,Lee JY,et al.Association study between single nucleotide polymorphisms in the VEGFA gene and polycystic ovary syndrome[J].Fertil Steril,2008,89(6):1751-1759.
[21]Grawal R,Jacobs H,Payne N,et al.Concentration of vascular endothelial growth factor released by cultured human luteinized granulosa cells is higher in women with polycystic ovaries than in women with normal ovaries[J].Fertil Steril,2002,78(6):1164-1169.
