紫杉醇-姜黄素介孔SiO2/脂质复合递药系统体外释药研究
2017-02-06胥辉豪赵琳娜林珈好林德贵
王 倩 , 胥辉豪 , 赵琳娜 , 林珈好 , 林德贵
(中国农业大学动物医学院 , 北京 海淀 100193)
二萜生物碱类化合物紫杉醇(TAX)是活性明确的天然抗癌药物,在临床上已广泛用于乳腺癌、卵巢癌和部分头颈癌和肺癌的治疗[1-5]。姜黄素(CUR)是从姜黄根茎中提取出的脂溶性酚类化合物,具有多种药理活性,尤其抗肿瘤作用活性明确[6-8]。紫杉醇与姜黄素二者合用的体内外抑癌作用优于任一单成分组[9],Hossain等[10]研究表明,姜黄素和紫杉醇合用能够高效活化Caspase-8,促进线粒体释放细胞色素C、Smac/Diablo和AIF进入肿瘤细胞胞质,促进肿瘤细胞凋亡。二者联用可大大降低TAX用药剂量,从而降低毒副作用。紫杉醇-姜黄素介孔SiO2/脂质复合递药系统(PLMSNs)具有介孔SiO2比表面积大、装载药物多和缓释等特性的同时,还具有脂质体良好的生物相容性[11-12]。通过对紫杉醇和姜黄素同时载药,发挥二者协同抗乳腺癌作用,提高二者载药量、水溶性和稳定性,从而提高其生物利用度,实现高效低毒。为了解自制TAX-CUR-PLMSNs在生理盐水中的药物释放情况,结合高效液相色谱法(HPLC)[13]进行了如下试验。
1 主要试验材料与仪器
紫杉醇标准品,姜黄素标准品(中国食品药品检定研究院,北京);无水乙醇,乙腈,冰醋酸,甲酸,生理盐水(北京化工厂,北京);viskase MD34MM透析袋、封口夹(北京环科智仪科技有限公司,上海);KQ-3200DE型数控超声波清洗器(昆山市超声仪器有限公司,北京);Sigma 3-18K 台式高速冷冻离心机(西格玛奥德里奇上海贸易有限公司,上海);德国默克密理博Milli-Q Reference超纯水系统(北京德泉兴业商贸有限公司,北京);摇床ZHWY-1102C(上海智诚分析仪器制造有限公司,上海);岛津20A高效液相色谱仪(岛津制作所,日本)。
2 试验方法
2.1 HPLC同时检测紫杉醇、姜黄素方法学建立 在筛选多种流动相配比方案及洗脱方式后,确定色谱条件如下:色谱柱:Eclipse XDB-C18柱(150 mm×4.6 mm,5 μm);流动相:A 相为乙腈,B 相为0.1%甲酸水溶液;流速:1 mL/min;柱温:25 ℃;检测波长: 227 nm;进样体积:20 μL。分别绘制TAX和CUR标准曲线,并从精密度、重复性、稳定性、回收率等方面进行方法学考察。
2.2 溶解度考察 取紫杉醇和姜黄素标准品配成过饱和溶液,于37 ℃、100 r/min条件下震荡24 h后离心取上清过滤,高效液相色谱法检测浓度。
2.3 增溶剂筛选 Robert[14]调研显示,市售注射剂中吐温-80的含量如下:肌肉注射≤ 4 %,静脉推注≤0. 4 %,静脉滴注≤ 2 %。十二烷基硫酸钠(SDS)作为增溶剂其浓度亦不宜过高。因此以2%为浓度上限。分别制备浓度为0.1%、0.5%、1.0%、1.5%、2.0%十二烷基硫酸钠的生理盐水溶液,加入过量紫杉醇、姜黄素,一定条件下震荡,离心取上清过滤,高效液相法检测上清浓度。同样的方法检测同浓度梯度的吐温-80对紫杉醇和姜黄素饱和浓度的影响。
2.4 体外释药
2.4.1 试验分组及药物制备方法 TAX单药组:称取3 mg紫杉醇加入到含有10 mL 1.5%吐温-80的生理盐水中混匀;CUR单药组:称取30 mg姜黄素加入到含有10 mL 1.5%吐温-80的生理盐水中混匀;TAX+CUR单药混合组:称取3 mg紫杉醇与30 mg姜黄素加入到含有10 mL 1.5%吐温-80的生理盐水中混匀;TAX-CUR -MSNs组:称取紫杉醇3 mg,姜黄素30 mg,于20 mL三氯甲烷溶液中混匀,避光,摇床振荡19 h后离心,取上清检测游离TAX、CUR的含量,沉淀置于通风橱;TAX-CUR -LMSNs组:称取适量磷脂、胆固醇以及相应剂量的紫杉醇或姜黄素加入圆底烧瓶中,无水乙醇溶解后旋转蒸发成膜。向TAX-CUR -MSNs组中装有MSNs沉淀的离心管内加入10 mL超纯水,混匀后圆底烧瓶内水合;TAX-CUR -PLMSNs组:在TAX-CUR -LMSNs组基础上添加PEG-2 000成膜。
2.4.2 反透析法考察TAX-CUR-PLMSNs递药系统体外释药行为 研究微粒分散体系体外释药的方法主要分为四大类:膜扩散技术、取样与分离技术、原位法和连续流动法[15]。本章通过经膜扩散技术及取样与分离技术对自制递药系统的体外释放进行研究。采用反透析法进行体外释药试验。半透膜煮沸后加入5 mL释放介质,两端封闭。250 mL 释放容器中加入100 mL释放介质(4组、5组和6组)加入新制备好的3 mL药物,混匀后加入封闭好的半透膜。摇床内震荡,37 ℃,100 r/min。分别于以下时间点取袋内溶液1 mL过滤后高效液相法检测浓度:0.5、1、2、4、6、8、10、12、24、48、72、96 h。取样后即刻补充等量释放介质。
3 结果与分析
3.1 HPLC法同时检测紫杉醇、姜黄素方法学结果与分析 在2.1所述色谱条件下,紫杉醇在0.6 μg/mL-15 μg/mL 浓度范围内回归方程(n=5)为:A = 44018C- 5069.7,R2= 0.9998,15 μg/mL-600 μg/mL浓度范围内回归方程(n=5)为:A = 39175C + 190612,R2= 0.9998。姜黄素在1.5 μg/mL-30 μg/mL 浓度范围内回归方程(n=5)为:A = 44698C-6311.9,R2= 0.9993,15 μg/mL-600 μg/mL浓度范围内回归方程(n=5)为:A = 53627C - 215933,R2= 1.0000。所有浓度范围内呈良好线性关系。该HPLC 方法检测紫杉醇、姜黄素,其精密度/重复性(紫杉醇R2=0.81%,姜黄素R2=0.41%);28 h内稳定性(紫杉醇R2=0.8895%,姜黄素R2=0.8808%)及回收率(紫杉醇高中低3个浓度的R2分别为0.87%、1.03%、1.29%,姜黄素高中低3个浓度的R2分别为1.05%、1.85%、1.89%)均符合相关要求。综上,建立了特异性、准确性、稳定性良好且可重复的同时检测紫杉醇、姜黄素浓度的高效液相法。
3.2 溶解度考察结果与分析 紫杉醇、姜黄素二者浓度均低于高效液相色谱的最低检测限0.6 μg/mL。说明紫杉醇和姜黄素在生理盐水中溶解度极低,不适合单独用于体外释药试验。
3.3 增溶剂筛选结果与分析 见表1。

表1 不同浓度SDS和吐温-80对紫杉醇和姜黄素饱和浓度的影响
从表1可以看出, SDS对紫杉醇的增溶效果显著优于吐温-80,但是对于姜黄素增溶效果不及吐温-80;本课题组已经通过细胞试验确定姜黄素、紫杉醇最佳协同剂量比为6∶1,从增溶剂筛选结果可知吐温-80浓度为1.5%时可以达到该条件,同时又能满足体外释药的漏槽条件。
3.4 体外释药试验结果与分析 计算每个取药时间点的累积释药浓度并绘制曲线,结果见图1、图2。
两种药物释药行为共同之处主要包括以下两个方面:第一,单药组累积释药量高于混合组;第二,自制递药系统累积释药量高于裸药组。将递药系统中的紫杉醇、姜黄素释放曲线分别用数学模型进行拟合,拟合结果见表2。
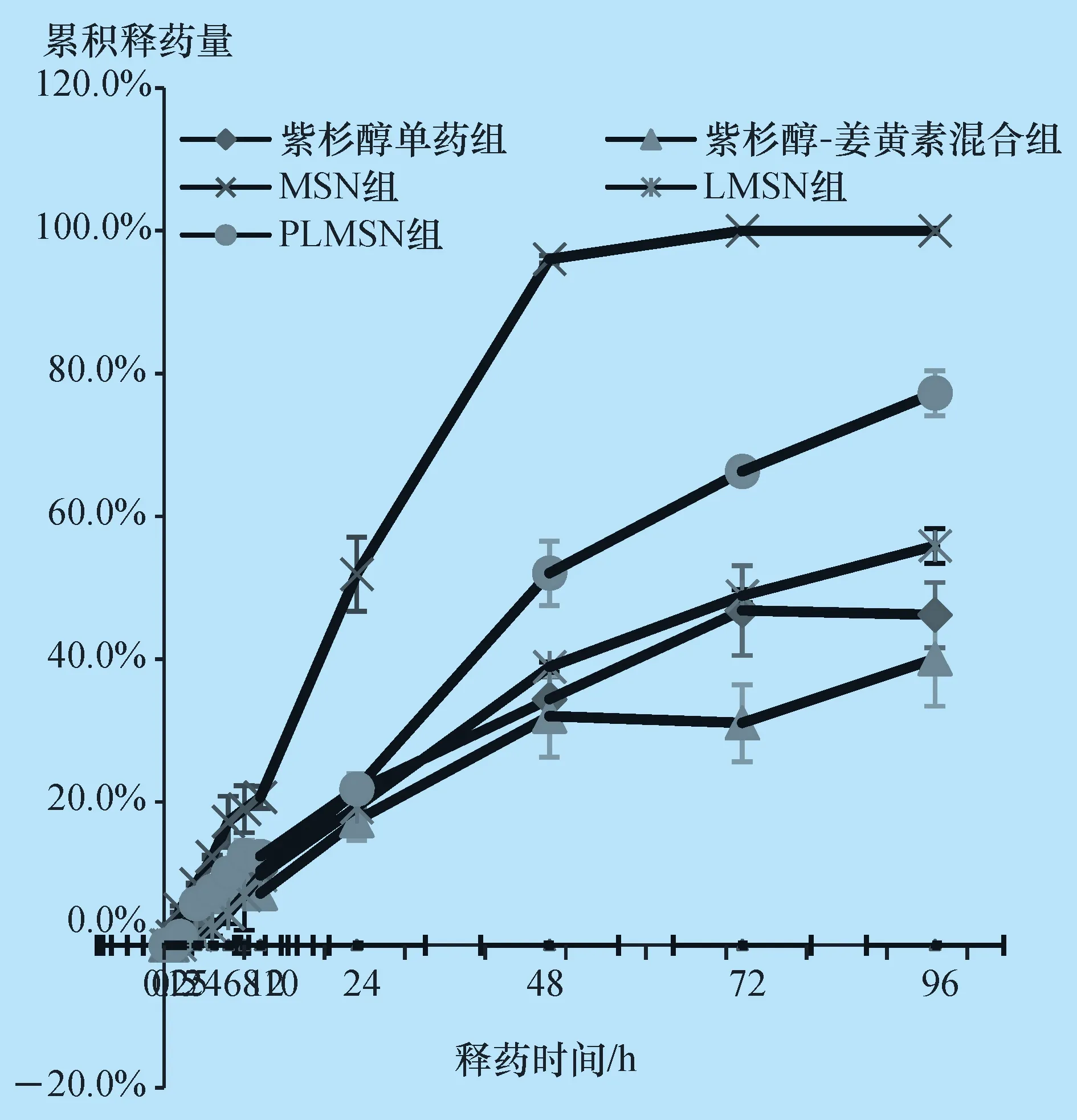
图1 各组不同时间点紫杉醇的累积释药 曲线 (n=3)

图2 各组不同时间点姜黄素的累积释药曲线 (n=3)

表2 PLMSNs组紫杉醇累积释放率动力学模型拟合结果

表3 PLMSNs组姜黄素累积释放率动力学模型拟合结果
递药系统中的紫杉醇和姜黄素两个指标成分的Hixon-Crowell模型拟合释放曲线如图3。
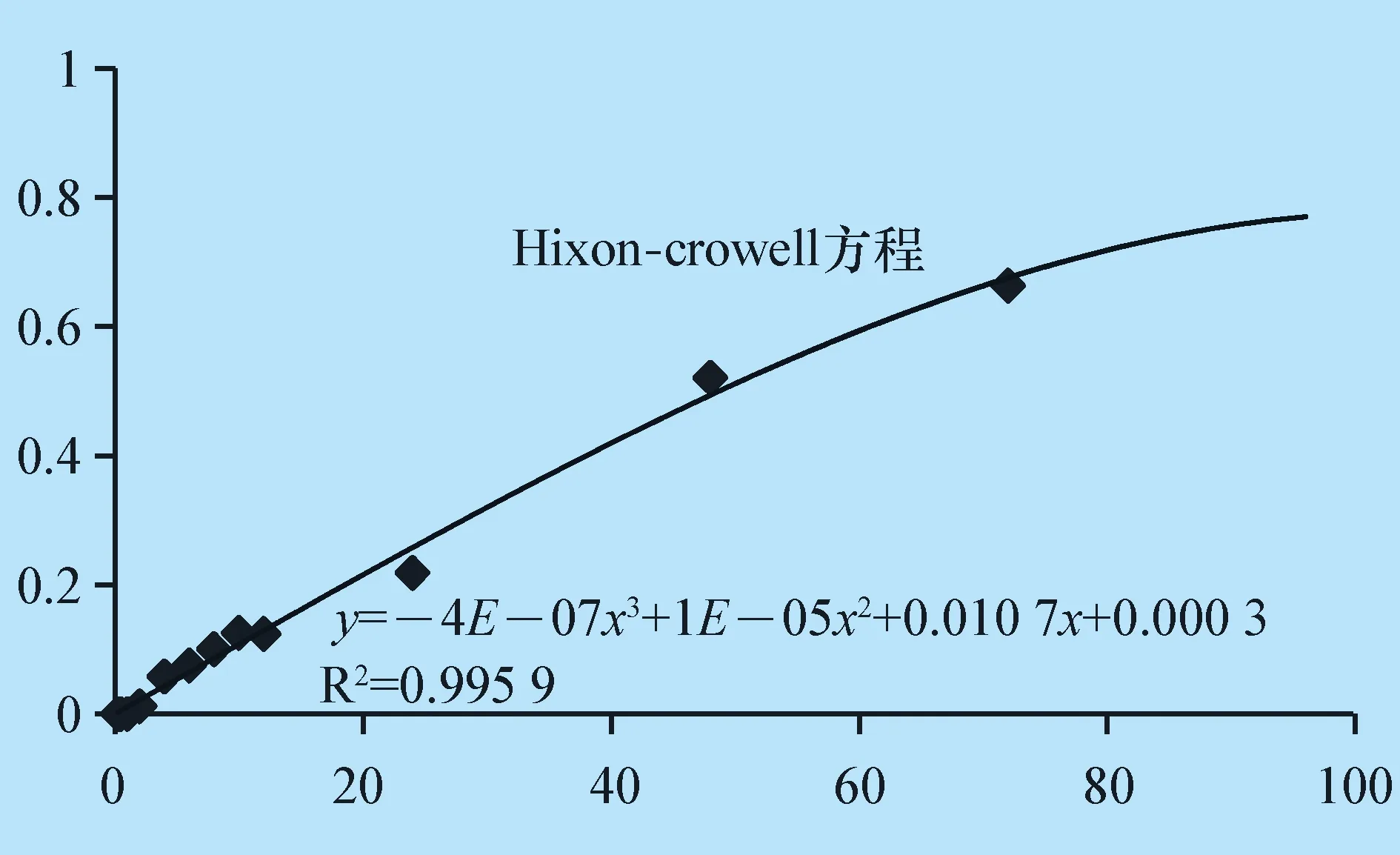
图3 PLMSNs组紫杉醇Hixon-Crowell模型释放曲线

图4 PLMSNs组姜黄素Hixon-Crowell模型释放曲线
由图3、图4模型拟合释放曲线可知,紫杉醇-姜黄素介孔SiO2/脂质复合递药系统中的紫杉醇和姜黄素释药行为均与Hixon-Crowell 模型拟合程度最高,相关系数 R2均大于 0.99。
4 结果与讨论
吐温-80是一种非离子型表面活性剂,其增溶效果归因于其能在水中形成胶团(胶束)[16-17]。作为增溶剂可以提高紫杉醇和姜黄素在生理盐水中的溶解度,但是裸药组药物进入摇床震荡时大部分以被吐温胶束包裹的形式均匀分布于释放介质中,整个过程中只有少量药物从释放介质中穿过透析袋进入到袋内,由此检测到的药物浓度比较低,对应的释放速度和累积释放量也较低。
由此可推测自制递药系统中的紫杉醇和姜黄素缓慢从介孔二氧化硅载体释出经过释放介质穿过透析袋进入袋内介质中。两种药物释药行为不同之处主要在于3种递药系统之间的差别。紫杉醇累积释药量由高到低分别为:MSNs>PLMSNs>LMSNs,姜黄素累积释药量由高到低分别为:LMSNs>PLMSNs>MSNs。其中针对紫杉醇而言,MSNs表面没有包被任何物质,紫杉醇从孔道内逐渐释放,没有受到来自磷脂层或PEG-2000的阻碍作用,因此释药量高于PLMSNs组和LMSNs组。PLMSNs药物表面PEG-2000作为一种亲水性基团有利于释放介质进入孔道中,促进药物的释放。针对姜黄素,MSNs表面没有包被任何物质,姜黄素从孔道内逐渐释放,虽未受到来自磷脂层或PEG-2000的阻碍作用,但是姜黄素初始剂量大,被吐温-80所形成的胶团包裹在内部,因此检测到的浓度低于LMSNs组和PLMSNs组。PLMSNs表面的PEG-2000水溶性促进效果不及电荷效应对姜黄素释出的影响。
整体来看紫杉醇和姜黄素的体外释放行为,紫杉醇的释放量要远远高于姜黄素,这与两者的结构特性及其与释放介质的不同作用有关。
5 结论
紫杉醇-姜黄素介孔 SiO2/脂质复合递药系统中紫杉醇和姜黄素的释放行为符合溶蚀作用控制的多成分均衡释放模式[16],成分之间相辅相成、相互协调,体现了其整体释放行为。
[1] 史清文. 天然药物化学史话:紫杉醇[J]. 中草药,2011,42(10):1 878-1 884.
[2] Aigner J, Marme F, Smetanay K,etal. Nab-PacliTAXel monotherapy as a treatment of patients with metastatic breast cancer in routine clinical practice[J]. Anticancer Res, 2013,33(8):3 407-3 413.
[3] Gluck S. nab-PacliTAXel for the treatment of aggressive metastatic breast cancer[J]. Clin Breast Cancer, 2014,14(4):221-227.
[4] Gou Q, Lei L, Wang C,etal. Polymeric nanoassemblies entrapping curcumin overcome multidrug resistance in ovarian cancer[J]. Colloids & Surfaces B Biointerfaces, 2015, 126: 26-34.
[5] Gao X, Wang B, Wu Q,etal. Combined delivery and Anti-cancer cctivity of paclitaxel and curcumin using polymeric micelles[J]. Journal of Biomedical Nanotechnology, 2015, 11(4):578-589.
[6] 冯为, 胡林峰. 姜黄素的研究进展及其抗肿瘤作用概况[J]. 中国现代药物应用, 2011(13):117-118.
[7] Kunnumakkara A B, Diagaradjane P, Anand P,etal. CURcumin sensitizes human colorectal cancer to capecitabine by modulation of cyclin D1, COX-2, MMP-9, VEGF and CXCR4 expression in an orthotopic mouse model[J]. Int J Cancer, 2009,125(9):2 187-2 197.
[8] Bayet-Robert M, Kwiatkowski F, Leheurteur M,etal. Phase I dose escalation trial of doceTAXel plus CURcumin in patients with advanced and metastatic breast cancer[J]. Cancer Biol Ther, 2010,9(1):8-14.
[9] Gao X, Wang B, Wu Q,etal. Combined Delivery and Anti-Cancer Activity of PacliTAXel and CURcumin Using Polymeric Micelles[J]. J Biomed Nanotechnol, 2015,11(4):578-589.
[10] Hossain M, Banik N L, Ray S K. Synergistic anti-cancer mechanisms of CURcumin and pacliTAXel for growth inhibition of human brain tumor stem cells and LN18 and U138MG cells[J]. Neurochem Int, 2012,61(7):1 102-1 113.
[11] Rahimi Hamid Reza,Nedaeinia Reza,Sepehri Shamloo Alireza,etat. Novel delivery system for natural products: Nano-curcumin formulations[J]. Avicenna journal of phytomedicine,2016,64.
[12] Liu, Z. Evaluation of the efficacy of paclitaxel with curcumin combination in ovarian cancer cells[J]. Oncol Lett, 2016, 12(5): 3 944-3 948.
[13] 王扣琼, 邵文琦, 彭颖斐, 等. 液相色谱-串联质谱法检测血浆紫杉醇性能评价[J]. 检验医学, 2016(05):394-398.
[14] Strickley R G. Solubilizing excipients in oral and injectable formulations[J]. Pharm Res, 2004,21(2):201-230.
[15] Pedram Rafiei,Azita Haddadi. Pharmacokinetic Consequences of PLGA Nanoparticles in DoceTAXel Drug Delivery[J]. Pharmaceutical Nanotechnology,2017,51.
[16] 孙会敏,杨锐,栾琳,等. 聚山梨酯80质量分析与致敏原探究[J]. 药物分析杂志,2011,31(10):1 850-1 855.
[17] 吴毅,金少鸿. 药用辅料吐温 80的药理、药动学及分析方法研究进展[J]. 中国药事,2008,22(08):717-720.
