河北省保定地区雏鸡鸡白痢沙门菌的分离鉴定及耐药性检测
2017-02-06张梦茜唐欣浩王雪伟任志军陈颖彬刘立元赵月兰秦建华
张梦茜 , 唐欣浩 , 王雪伟 , 康 茜 , 任志军 , 陈颖彬 , 刘立元 , 赵月兰 , 秦建华
(河北农业大学动物医学院 , 河北 保定 071001)
鸡白痢沙门菌病是由鸡白痢沙门菌引起的一种急性、败血性传染病,该病对1~3周龄的雏鸡危害较为严重。病雏鸡以急性死亡、败血症、拉白色稀便及糊肛为主要特征,发病率和死亡率较高,严重影响着育雏存活率及鸡群质量,给养鸡业的发展造成巨大的经济损失。目前,鸡沙门菌耐药性出现持续增长的趋势,特别是沙门菌多重耐药的不断出现给世界禽业造成巨大的威胁。化学药物防治造成的药物残留对公共卫生也产生了巨大的潜在危害。河北省保定地区某养殖场内的部分4日龄雏鸡突然出现死亡,疑似鸡白痢沙门菌病,本作者自疑似病鸡采取肝脏病料,进行细菌分离鉴定和PCR鉴定,并对分离菌株进行了耐药性检测,为抗菌药物的临床合理选用提供参考。
1 材料与方法
1.1 病料的采集 河北省保定地区某养殖场内的部分4日龄的雏鸡突然出现死亡,随后几天内部分雏鸡表现出精神沉郁、食欲不振、瘦弱垂腹、拉白色稀粪,继而大量死亡,急性病例肝脏肿大、出血,呈土黄色并有砖红色条纹,有针尖大小的灰白色坏死灶,疑似鸡白痢沙门菌病。无菌采集10只病鸡的肝脏,进行病原分离与鉴定。
1.2 培养基和主要试剂 普通营养琼脂培养基、S.S.琼脂培养基等,均按常规方法配制。葡萄糖、乳糖、麦芽糖、甘露糖、蔗糖、尿素等细菌微量生化管,由杭州天和微生物试剂有限公司生产。鸡白痢沙门菌多价血清型阳性血清,购自北京中海动保科技有限公司。药敏试纸阿莫西林(AMX)、阿齐霉素(AZI)、庆大霉素(GEN)、阿米卡星(AMI)、头孢唑啉(CFZ)、青霉素(PEN)、氧氟沙星(OFL),购自杭州天和微生物试剂有限公司。PCR扩增试剂,均购自TaKaRa公司。
1.3 病原的分离培养 将病鸡肝脏病料接种到M.M.营养肉汤中,于37 ℃增菌培养24 h。取菌液斜划线接种于S.S.琼脂培养基和普通营养琼脂培养基上,37 ℃培养24 h,观察平板上菌落形态,挑取培养基上的单个菌落涂片,经革兰染色后镜检。
1.4 分离菌的生化鉴定 挑取普通琼脂斜面上经37 ℃培养的疑似沙门菌的单个菌落,接种于普通液体LB培养基中,150 r/min,37 ℃过夜培养12 h~24 h,取菌液接种三糖铁琼脂培养基,进行斜面划线并穿刺直至底部,37 ℃培养 24 h~36 h。
将分离菌株接种于葡萄糖、乳糖、麦芽糖、蔗糖、阿拉伯糖、鼠李糖、甘露醇、木糖九种生化管中,37 ℃培养2 d~5 d。
1.5 血清学鉴定 取普通琼脂斜面培养的分离菌落,加灭菌生理盐水制成菌液,取50 μL菌液与等量鸡白痢沙门菌多价血清型阳性血清进行平板凝集反应试验,2 min内观察结果。出现明显的颗粒凝集者,判定为阳性反应。
1.6 分离菌的PCR扩增 参考Gene Bank中登记的沙门菌invA基因序列(序列号:NC-03197),应用Primer Premier5.0软件设计一对引物。由上海生工生物工程技术服务有限公司合成。预期扩增产物长度为373 bp。引物序列如下:
上游引物为P1:5′-GTCCTCCGCCCTGTCTACT-3′
下游引物为P2:5′-TCCTAACGACGACCCI丁C-3′
取培养的菌液,提取细菌基因组DNA,用上述引物进行细菌基因组DNA的invA基因PCR扩增。
PCR反应体系为(总体积25 μL):DNA模板2 μL,dNTP 3 μL,Taq酶 0.5 μL,10×Buffer 2.5 μL,上下游引物分别0.5 μL,水16 μL。PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s, 58 ℃退火30 s,72 ℃延伸40 s,30个循环,72 ℃延伸10 min。取PCR产物5 μL经10 g/L琼脂糖凝胶电泳检测[1-2]。
1.7 分离菌的致病性试验 将20只5日龄的雏鸡分为两组,每组10只。试验组每只腹腔接种分离菌株雏鸡沙门菌培养物0.2 mL(约3×107CUF/mL),对照组每只接种灭菌营养肉汤0.2 mL,两组分别隔离饲养,正常供应饲料及饮水。分别记录每日鸡只的发病数、死亡数,连续观察7 d。
1.8 药敏试验 采用世界卫生组织(WHO)推荐的Kirby-Bauer法测定分离菌对抗菌药物的敏感性。将菌液用生理盐水校正浊度至0.5个麦氏单位,均匀的涂于普通营养琼脂培养基和S.S.琼脂培养基上,然后依次贴药敏纸片即阿齐霉素(AZI)、庆大霉素(GEN)、阿米卡星(AMI)、青霉素(PEN)、头孢唑啉(CFZ)、阿莫西林(AMX)、氧氟沙星(OFL)共7种药敏片,于37 ℃过夜培养。
参照美国临床实验室标准委员会(National Committee for Clinical Laboratory Standards,NCCLS,2009)公布的标准,通过平板上抑菌圈的大小来判断药物的敏感性。以敏感(Susceptible)、中介(Intermediate)、耐药(Resistant)3种形式对抑菌圈大小做出判定(表1)。

表1 分离菌对7种抗菌药物的敏感性判断标准
2 结果
2.1 细菌的分离培养 将10份被检病料接种于普通营养琼脂培养基和S.S.琼脂培养基,经过12 h~24 h的培养,均在培养基表面上长出了边缘整齐的光滑菌落,其在普通琼脂平板生长贫瘠,形成较小的无色透明菌落;在S.S.琼脂平板上形成粉红色、中等大小的菌落;有的菌落中间还会出现带有金属光泽的黑色小点。分离菌的菌落特征均与为鸡白痢沙门菌菌落特征相似。
分离菌染色镜检结果均为革兰阴性、两端钝圆短小杆菌,无芽孢、无荚膜,多散在,少数成对或呈短链状排列。分离菌的菌体特征与鸡白痢沙门菌特征相一致。
2.2 生化鉴定结果 分离菌株对葡萄糖、乳糖、麦芽糖、蔗糖、甘露醇、阿拉伯糖、鼠李糖、木糖的分解能力见表2。
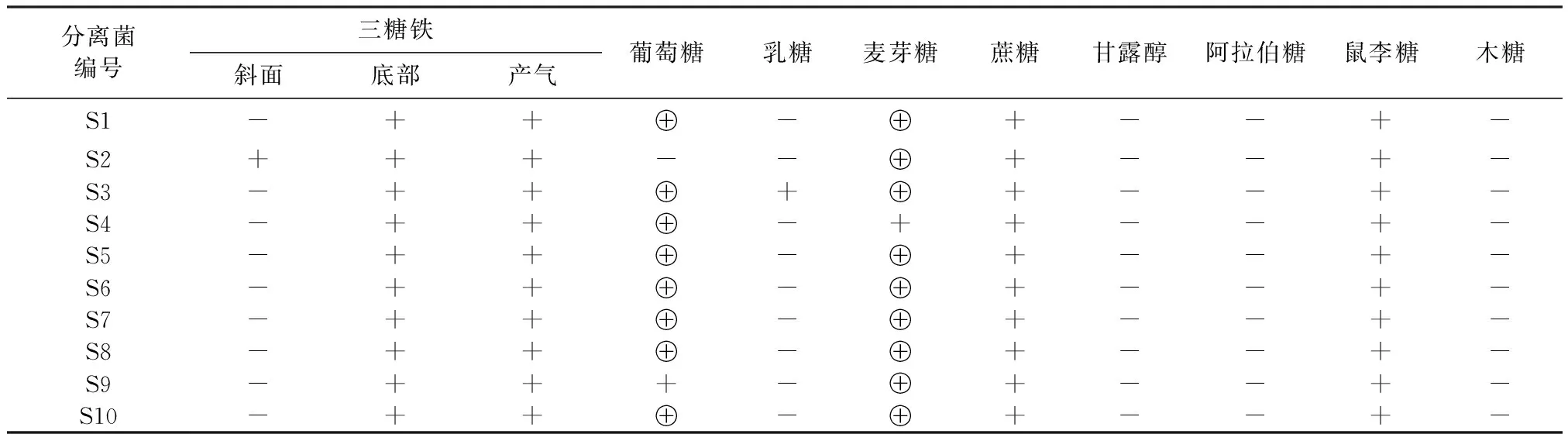
表2 分离菌的主要生化特性
⊕:产酸产气; ﹢:为阳性; -:为阴性
由表1可知,多数分离菌的生化鉴定结果符合沙门菌的特性,三糖铁斜面阴性、底部阳性,发酵葡萄糖、麦芽糖和甘露醇产酸产气,不发酵乳糖和蔗糖。只有个别分离菌株与此有一定的差异,S2三糖铁斜面阳性、葡糖糖阳性,S3乳糖阳性。
2.3 血清学鉴定结果 分离菌与等量鸡白痢沙门菌多价血清型阳性血清进行平板凝集反应试验,结果出现明显的凝集颗粒,判定为阳性反应。
2.4 分离菌的PCR扩增结果 将10株分离菌进行沙门菌基因组DNA片段invA基因的PCR扩增,均扩增出373 bp大小的片段,与预期结果相符(图1)。

图1 沙门菌invA基因PCR扩增结果
M:DL-2 000 Marker; S1-S10:分离菌1-10株
2.5 分离菌的致病性结果 雏鸡攻毒后6 h开始发病,表现为精神不振,恶寒怕冷,羽毛粗乱,食欲减退,拉白色稀便。12 h后雏鸡开始死亡,整个试验期的死亡率达90%(表3)。对照组仅有一只在第5天死亡,其他无临床症状,健康存活。对照组在第5天死亡的一只雏鸡,死前无拉白色稀粪等鸡白痢症状,可能是由于雏鸡有个体差异,有环境应激,抵抗力降低,其他病因导致死亡。
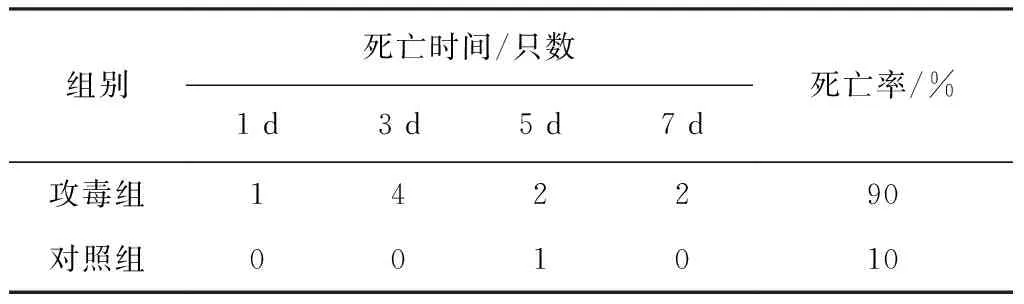
表3 沙门菌分离株对雏鸡的致病性
2.6 药敏试验结果
2.6.1 雏鸡沙门菌分离株的耐药性 雏鸡沙门菌分离株的耐药性见表4和表5。所有的分离菌株均表现出不同程度的耐药性,且表现出多重耐药现象(表4)。在试验的7种抗菌药物中,10株分离菌株对阿莫西林和青霉素耐药率达100%,对阿齐霉素的耐药率达90%,而对阿米卡星、头孢唑林和庆大霉素耐药性较弱、对氧氟沙星较为敏感(表5)。
2.6.2 雏鸡耐药沙门菌的耐药谱 10株耐药菌株的耐药谱见表6和表7。在试验的7种抗菌药物中,分离菌株均对其3~5种药物表现出耐药性(表6),4耐菌株占总菌株的比例最大,达40%,3耐和5耐菌株各占30%。从耐药沙门菌的多重耐药率(表7)可以看出,3耐菌株多重耐药比例为42.86%,4耐菌株多重耐药比例为57.14%,5耐菌株多重耐药比例为71.43%,临床分离株的多重耐药现象已经十分严重。
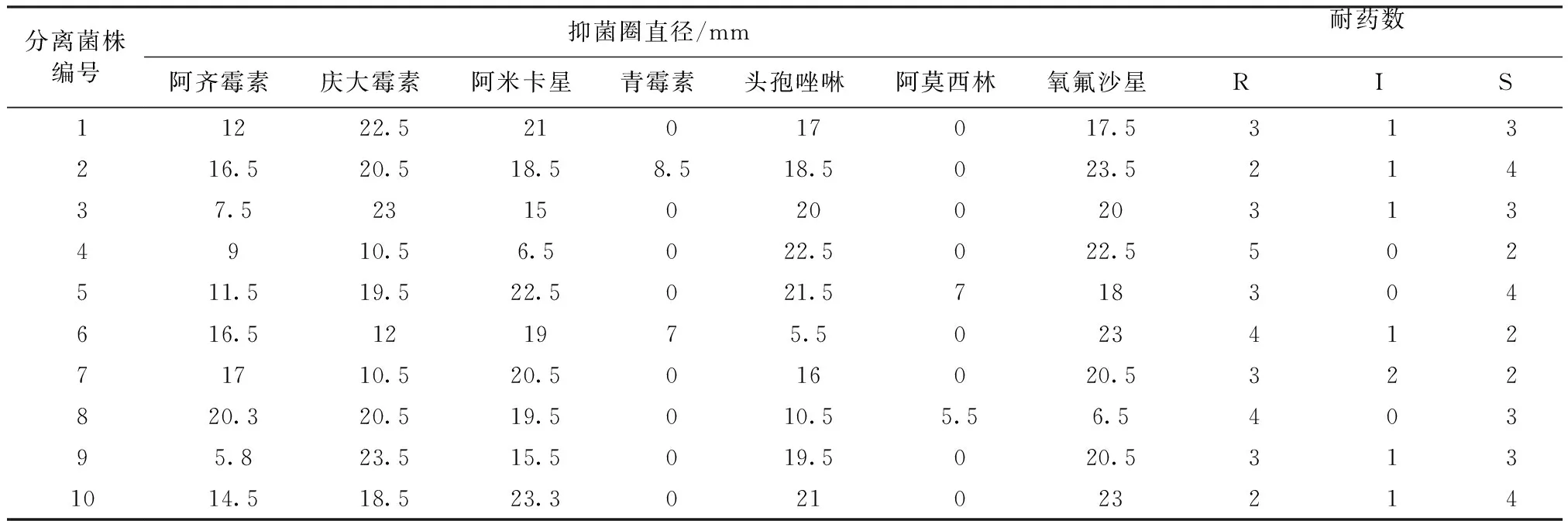
表4 各分离菌对7种药物的耐药性
注: R:耐药, I:中度耐药, S:敏感
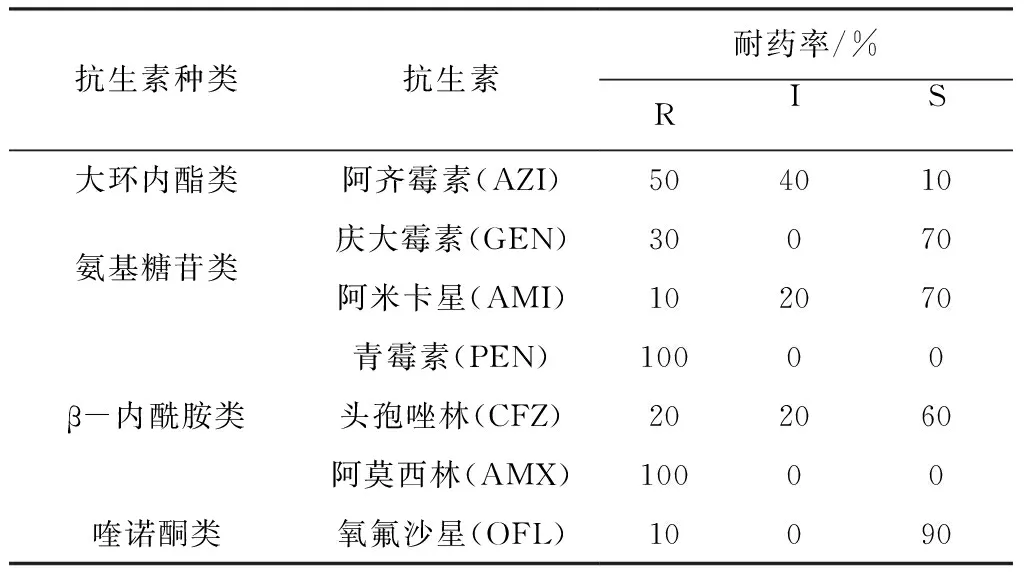
表5 耐药沙门菌对各种抗生素的耐药率
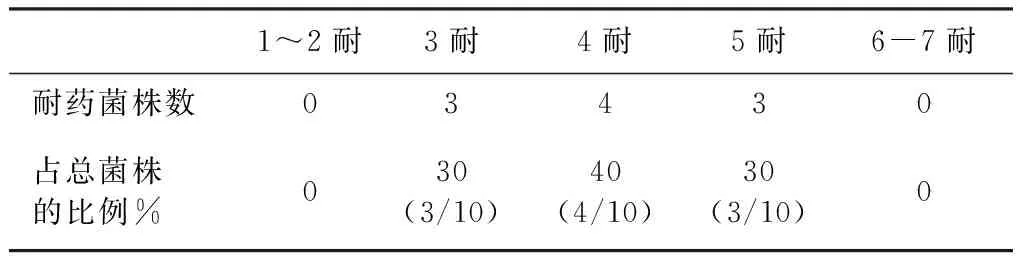
表6 分离菌的多重耐药性

表7 耐药沙门菌的多重耐药率
3 讨论
本研究通过细菌分离培养、细菌形态观察、生化试验、血清学鉴定,证明从病死雏鸡组织中分离出的细菌为鸡白痢沙门菌。沙门菌inv基因簇是编码吸附和侵袭上皮细胞表面蛋白的基因,基于inv基因簇设计的引物,具有属特异性,可用于鉴别沙门菌[3-4]。本研究以沙门菌invA基因序列设计引物,扩增出预期大小的DNA片段,进一步确定分离菌为沙门菌。用分离菌株接种雏鸡,其死亡率高达90%,表明该菌株有很高的致病性。
抗生素药物在防治鸡白痢沙门菌病方面具有重要作用,但随着抗生素药物的广泛使用,以及滥用抗生素,鸡白痢沙门菌耐药菌株不断出现,耐药谱不断增大[5-6],因此,在鸡白痢病的防治中,应经常分离流行致病菌株,通过药敏试验指导用药,防止盲目用药贻误最佳治疗时机。为了准确有效地治疗鸡白痢沙门菌病,本研究自保定地区疑似鸡白痢沙门菌病鸡肝组织采取病料,进行鸡白痢沙门菌分离鉴定以及耐药性检测,为本地区鸡白痢沙门菌病的防治提供依据。
药敏试验结果表明,鸡白痢沙门菌保定分离菌株对阿莫西林和青霉素耐药率达100%,但对阿米卡星、头孢唑林和庆大霉素耐药性较弱,对于氧氟沙星相对较为敏感。在养鸡生产中应通过药敏试验筛选几种敏感药物交替使用,避免长期使用同一种药物而产生耐药性或盲目用药。另外,对鸡白痢沙门菌病的防制不能完全依赖药物,应把重点放在强化生物安全措施,改善饲养管理条件,防止或者延缓耐药株的产生[7]。近年来微生态制剂如益生菌、益生素和中草药制剂如地榆散等的应用,为在临床中防治鸡白痢沙门菌感染提供了新途径[8]。
[1] 许会会,雷连成,谢芳,等.沙门氏菌PCR检测方法的建立[J].中国畜牧兽医,2010,37(4):94-97.
[2] 薛俊龙,张伟业,张国权,等.鸡白痢沙门氏菌PCR检测技术的建立与应用[J].畜牧兽医杂志,2011,30(6):23-27.
[3] 梁成珠,贾俊涛,姜英辉,等.沙门氏菌invA基因重组质粒标准的构建[J].食品质量安全检测学报,2014,5(7):2 119-2 124.
[4] 陈金顶,索青利,廖明,等.沙门氏菌的invA基因序列分析与分子检测[J].中国人兽共患病杂志,2004,20(10):868-871.
[5] 潘志明,焦新安,刘文博,等.鸡白痢沙门氏菌耐药性的监测研究[J].畜牧兽医学报,2002,33(4):377-383.
[6] 黄世娟,陈进喜,彭定兵,等.鸡沙门氏菌的分离鉴定及药敏试验[J].广西畜牧兽医,2011,27(4):213-215.
[7] 杨晓谷,李国祥,纪康,等.鸡白痢的预防与净化[J].山东畜牧兽医,2011,32(11):34-35.
[8] 侯丽丽,程建国,宁炳渭,等.中药“地榆散”防治鸡白痢病的研究与应用[J].中国动物保健,2011,13(6):16-19.
