氮掺杂纳米二氧化钛对3种常见病菌抑菌效果的研究*
2017-02-02陆林杰王潇宇张震芳白春继
闫 磊 卢 怡 陆林杰 王潇宇 张震芳 苏 方 白春继
纳米二氧化钛(TiO2)是一种无机光催化抑菌材料,自1972年日本科学家Fujishima和Honda发现了TiO2在紫外光照射下可以催化降解水的现象以来[1],研究表明,光催化纳米TiO2可通过抑制菌斑获得性膜的形成、破坏细菌细胞壁、细胞膜以及DNA双螺旋结构等机制抗菌[2]。
众所周知,口腔环境中存在大量的微生物,而口腔诊疗过程中易飞溅血液、唾液,如果感染控制不完善,极易引发院内感染[3]。近年来,随着纳米TiO2技术逐渐向口腔领域的渗透,其广谱抗菌、净化空气等特性的发现为减少医院获得性感染,提高口腔感染控制效果奠定了重要基础。Aita等[4]报道了紫外线照射TiO2植体可有效减少口内细菌附着以及菌斑形成,我国学者研究发现[5],光催化TiO2:C涂层可有效改善种植体材料的抗菌性,对变形链球菌、血链球菌、牙龈卟啉单胞菌抗菌性强,可改善种植体周围炎的发生率。此外,光催化纳米TiO2对诊室医疗设备及环境空气中金黄色葡萄球菌、大肠杆菌、白色念珠菌的杀灭率均高达99%以上,对乙肝表面抗原也有破坏作用,并可使内毒素降解,表现出了良好的消毒效果[6]。
但纳米TiO2只有在紫外光照射下才能激发产生作用,大大限制了在可见光环境下的应用。本课题组的合作单位北京科技大学在前期研究中使用氮掺杂技术成功制备了氮掺杂纳米二氧化钛(纳米N-TiO2)喷剂,使得该材料在可见光照射下即可被激发,突破了这一应用局限[7,8]。
其中金黄色葡萄球菌、大肠埃希氏菌、白色念珠菌分别是革兰氏阳性菌、革兰氏阴性菌和真菌的代表菌种,也是医疗环境中物体表面的常见病菌,所以将其作为抑菌试验的杀灭对象具有代表性[9]。本研究是在实验室条件下探究纳米N-TiO2对以上3种病菌的抑菌效果,为进一步深入研究本材料对其他病菌的抑菌效果和将该材料的实际抑菌应用提供实验依据。
本实验所用的抑菌材料氮掺杂纳米二氧化钛(纳米N-TiO2)喷剂是成品材料,为测定其真实抑菌性能故要求实验中不应改变它的性质,同时目前尚无氮掺杂纳米二氧化钛在24h以内的抑菌效果报告,故本实验根据《消毒技术规范(2012年版)》设计,采用“载体浸泡定量杀菌试验”和“抑菌环试验”两种方法,前者在前期预实验的基础上设计0.5、1、2、3、4h共5个时间段进行检测,后者按该规范进行观察[10]。
1.材料和方法
1.1 实验试剂
1.1.1 抑菌剂 纳米N-TiO2喷剂(主要有效成分为氮掺杂的锐钛矿型纳米TiO2,平均粒径<65nm,喷剂pH=7-8;不溶于水,不溶于稀碱、稀酸,溶于热浓硫酸、盐酸、硝酸,相对密度3.8-3.9g/cm2,热稳定性好,室温条件下可稳定存储超过120d以上,由北京科技大学提供),有效成分是1 wt%(质量分数)的纳米N-TiO2悬浊液。
1.1.2 实验菌株和培养基
(1)金黄色葡萄球菌(CGMCC 1.2465),培养基为营养肉汤培养基;
(2)大肠埃希氏菌(CGMCC 1.3373),培养基为LB培养基;
(3)白色念珠菌(CCTCC AY 93025),培养基为沙氏培养基。
1.1.3 其他试剂
(1)稀释液:1%胰蛋白胨生理盐水溶液(TPS);
(2)洗脱液:含0.1%吐温-80的磷酸盐缓冲液(PBS)。
1.2 实验器材
(1)超净台:海尔生物安全柜,型号HR40-ⅡA2型,青岛海尔医用低温科技有限公司;
(2)恒温培养箱:振荡培养箱SPX-150B-D型,箱内自带40w功率日光灯,上海博迅实业有限公司医疗设备厂;
(3)移液器:Genex Beta(20-200μL、100-1000μL),芬兰百得实验室仪器苏州有限公司;
(4)漩涡混合器:VORTEX-5型,上海书培实验设备有限公司;
(5)游标卡尺:沪制01130048,上海恒量量具有限公司。
1.3 实验方法
1.3.1 载体浸泡定量杀菌试验
(1)试验用菌悬液的制备:取以上菌种24h的新鲜培养斜面,在无菌条件下取单个菌落投入相应的液体培养基中,分别在37℃环境下振荡培养至一定时间(金黄色葡萄球菌和大肠杆菌为6 h,白色念珠菌为12 h),吸取1 mL菌悬液装入无菌玻璃试管中,稀释至约为3×108cfu/mL的浓度。
(2)菌片的制备:制备10mm×10mm无菌干燥的脱脂白平纹布片作为载体,吸取10μL稀释菌悬液滴染于载体,并置于37℃无菌环境下缓慢干燥制成菌片备用。
(3)杀菌试验:实验组将菌片轻轻放入装有5mL纳米N-TiO2喷剂的无菌平皿中,并使两者充分接触,然后将平皿置于室温25℃、日光灯照射(日光灯功率40w,平皿距离日光灯约30cm)环境下,作用至预定时间;对照组操作同上,以TPS代替纳米N-TiO2喷剂。
(4)培养计数:作用至相应时间后,在无菌环境下将菌片取出,投入装有5 mL洗脱液的试管中,用漩涡混合器振荡混合30 s,将菌从载体上洗下获得菌悬液,然后按照《活菌培养计数技术》进行培养计数。
(5)结果计算:以上试验重复3次,计算杀灭对数值:
杀灭对数值(KL)=对照组菌落对数值(Na0)-实验组菌落对数值(Nas),其中,a为作用时间(h),0表示对照组,s表示实验组。
(6)评判标准:杀灭对数值KL≥3者,判定为有抑菌效果;3次结果均有抑菌效果者为消毒合格。
1.3.2 抑菌环试验
(1)试验用菌悬液的制备:操作同1.3.1,将菌悬液稀释至约3×106cfu/mL的浓度。
(2)抑菌试验样片的制备:实验组取直径为5mm无菌干燥的滤纸片,每片滴加20μL纳米N-TiO2喷剂,在37℃无菌环境下干燥后备用;对照组取同样的滤纸片,每片滴加无菌蒸馏水。
(3)染菌平板的制备:在无菌环境下用无菌棉拭子蘸取1.3.1制备的菌悬液,在相应的固体培养基平板上均匀涂抹3次,每涂抹1次后将平板应转动60°继续涂抹,最后将棉拭子绕平板边缘涂抹一周,最后盖好平皿,置室温干燥5min。
(4)抑菌试验样片的放置:每个平板贴放4个实验组样片和1个对照组样片,其中实验组样片放在平板四周,对照组样片放在平板中心。注意样片的药液面必须与琼脂面完全密合,各样片中心点之间相距25mm以上,与平板的周缘相距15mm以上。贴放完毕后,将培养皿倒置(药液面接受光照),置于室温25℃、日光灯照射(日光灯功率40w,平皿距离日光灯约30cm)环境下培养18h。
(5)结果测量:试验重复3次。用游标卡尺(精度0.02mm)测量抑菌环的直径(包括贴片)并记录。测量抑菌环时,应选均匀而完全无菌生长的抑菌环进行,测量其直径应以抑菌环外沿为界。
(6)评判标准:实验组样片抑菌环直径>7mm者,判定为有抑菌效果;抑菌环直径小于或等于7mm者,判为无抑菌作用;3次重复试验均有抑菌作用结果者,判定为消毒合格;同时,对照组应无抑菌环产生,否则试验无效。
2.结果
2.1 载体浸泡定量杀菌试验 纳米N-TiO2喷剂对3种病菌作用0.5,1,2,3,4h,再经培养计数后计算得出的杀灭对数值分别见表1至表3。结果显示纳米N-TiO2喷剂对金黄色葡萄球菌作用1h以及对大肠埃希氏菌、白色念珠菌作用0.5h达到杀灭对数值>3。
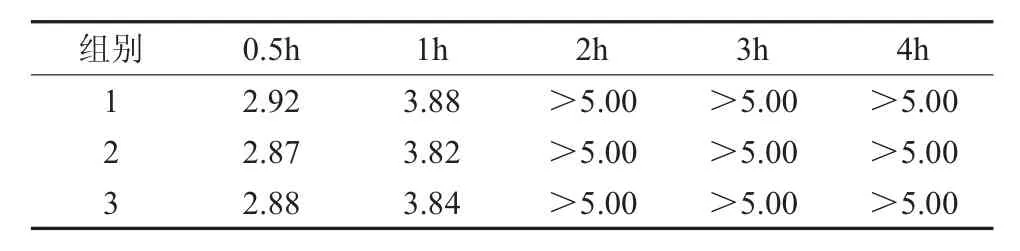
表1 纳米N-TiO2喷剂对金黄色葡萄球菌的杀灭对数值
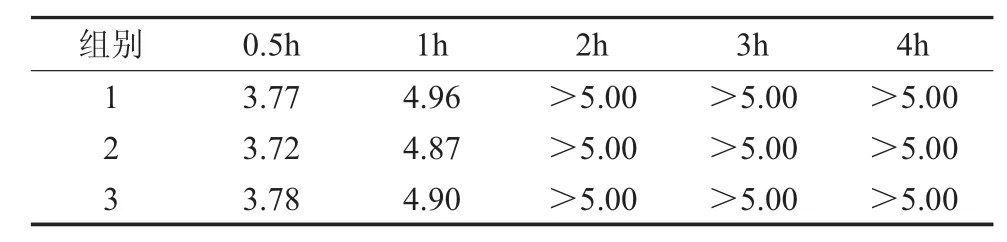
表2 纳米N-TiO2喷剂对大肠埃希氏菌的杀灭对数值
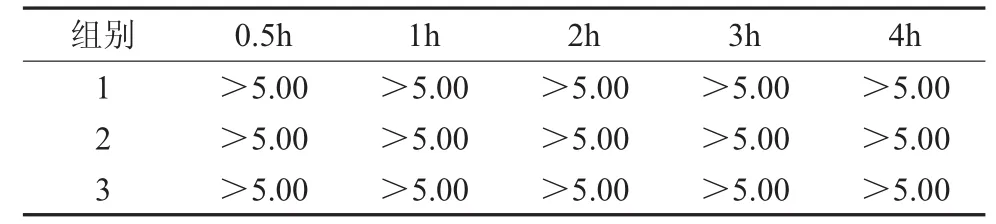
表3 纳米N-TiO2喷剂对白色念珠菌的杀灭对数值
2.1 抑菌环试验 实验组样片对3种病菌产生的抑菌环直径见表4至表6,同时对照组样片均未产生抑菌环。结果显示,纳米N-TiO2喷剂对金黄色葡萄球菌、大肠埃希氏菌、铜绿假单胞菌、鲍氏不动杆菌作用18h后产生直径>7mm的清晰抑菌环,而对白色念珠菌则未产生抑菌环(图1-图3)。
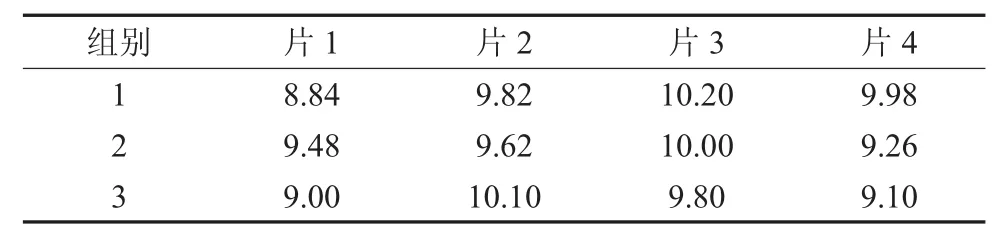
表4 纳米N-TiO2喷剂对金黄色葡萄球菌产生的抑菌环直径(mm)
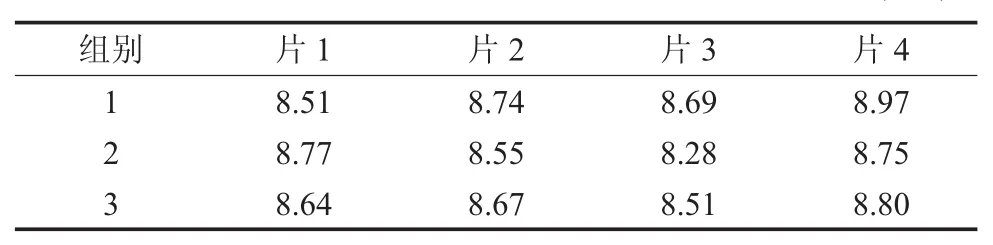
表5 纳米N-TiO2喷剂对大肠埃希氏菌产生的抑菌环直径(mm)

表6 纳米N-TiO2喷剂对白色念珠菌产生的抑菌环直径(mm)
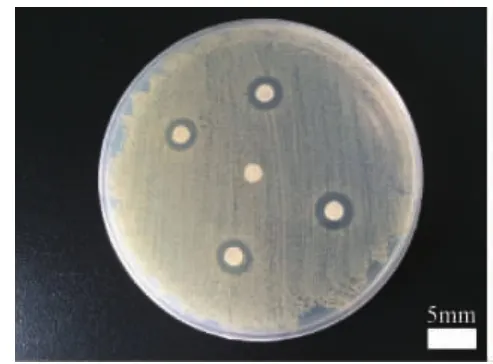
图1 纳米N-TiO2喷剂对金黄色葡萄球菌产生抑菌环图注:抑菌环直径>7mm
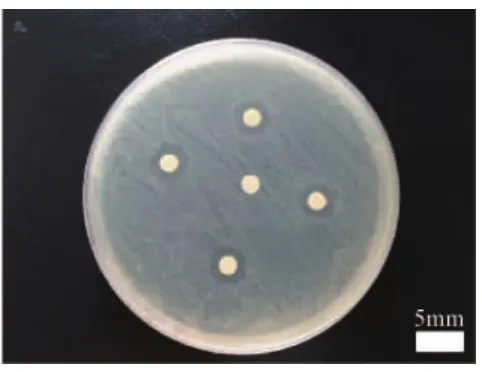
图2 纳米N-TiO2喷剂对大肠埃希氏菌产生抑菌环图注:抑菌环直径>7mm

图3 纳米N-TiO2喷剂对白色念珠菌未产生抑菌环
3.讨论
抗菌剂一般分有机抗菌剂、无机抗菌剂和天然抗菌剂。有机抗菌剂抗菌机理主要是与细菌和霉菌的细胞膜表面的阴离子相结合或与巯基反应,破坏蛋白质和细胞膜的合成系统,从而抑制细菌和霉菌的繁殖[11]。有机抗菌剂具有杀菌迅速,杀菌力强等优点,但同时具有残留物有一定毒性、稳定性差易分解、效果持续时间短等缺点。无机抗菌剂包括重金属类和光催化类。无机抗菌剂的优点是具有安全性、耐热性、耐久性、持续性,不足之处是部分材料价格昂贵,不具有有机抗菌剂的速效性[12]。天然抗菌剂大多数是从动植物中提炼精制而成的,使用安全,无毒副作用,但加工困难、耐热性差。
纳米TiO2作为近年来新发现的一种新型无机光催化型抗菌剂,因具有来源丰富、价格低廉、清洁无污染、化学性质稳定[13]受到各国科学家的广泛关注。纳米TiO2主要成分为氮掺杂N-TiO2粉,粒径在10-15nm,相对密度3.8-3.9g/cm3热稳定性佳,易去除,广泛应用于污水处理、空气净化、医药和化妆品等领域。由于TiO2的禁带宽度(3.2eV)较大,相当于波长为387nm光的能量[14],正好处于紫外区,故以纳米TiO2作为光催化剂产生光催化氧化反应需要紫外线作为光源。紫外光在太阳光能中只占3%-5%,而占太阳能45%的可见光不能被利用,极大限制了纳米TiO2材料的应用环境范围,因此将纳米TiO2的光响应拓宽至可见光区具有重要的研究意义。
迄今国内外研究者对此做了大量工作,如表面光敏化[15]、半导体复合[16]、贵金属沉积[17]、金属元素掺杂[18]、非金属元素掺杂[19]等。北京科技大学曹文斌课题组[20]自2003年开始相关研究,采用同步晶化与氮掺杂工艺制备了氮掺杂纳米二氧化钛粉体,实现了纳米粉体的规模化制备,在此基础上进一步制备了以无机助剂为分散系的纳米N-TiO2喷剂。本产品可以高效利用室内波长在520nm以下的自然光线,在室内自然光照射环境下将光能转化为化学能,使纳米N-TiO2表面发生电子跃迁,跃迁产生的电子和空穴在纳米材料表面与所吸附的氧气和水反应,产生大量羟基自由基(·OH)和超氧自由基(O2-),这两种基团具有很强的化学反应活性,足以将构成蛋白质等有机物的C-H、C-O、C-N等化学键分解,最终生成无毒无味无污染的二氧化碳(CO2)、水(H2O)及一些简单的无机物,故而能够连续破坏与之接触的细菌的细胞壁和细胞膜,使细菌丧失了受损的细胞壁和细胞膜的修复功能,引起细胞内容物的流失,最终导致细胞死亡,达到杀灭或抑制细菌的目的[21]。纳米N-TiO2在起到杀菌作用的同时自身作为催化剂并不发生任何变化,反应的分解产物也不会产生二次污染,具有长效持久、绿色无污染的突出优点。
本研究的目的是为了检测成品材料纳米N-TiO2喷剂对3种代表病菌的抑菌效果,只有在尽量不改变喷剂的各项理化性质的前提下才能反映喷剂的真实抑菌性能。故选用“载体浸泡定量试验”和“抑菌环试验”这两种方法,由于前者的试验结果具有定量比较性,后者则具有直观比较性。
“载体浸泡定量试验”的结果显示,在该试验条件下纳米N-TiO2喷剂对金黄色葡萄球菌、大肠埃希氏菌、白色念珠菌分别作用1h、0.5h、0.5h即能达到消毒效果,对三种病菌的抑菌效果依次为金黄色葡萄球菌<大肠埃希氏菌<白色念珠菌。“抑菌环试验”的结果显示,在该试验条件下纳米N-TiO2喷剂对金黄色葡萄球菌、大肠埃希氏菌具有明显的抑菌效果,对白色念珠菌不具有抑菌效果。由此可见,纳米N-TiO2喷剂对金黄色葡萄球菌、大肠埃希氏菌的试验结果是一致的,但对于白色念珠菌来说结果却不太一致。
白色念珠菌属于真菌,真菌具有双相性,可以在不同条件下以酵母相或菌丝相为主存在。有研究表明,真菌的表型转换是其重要的致病因素,菌丝的形成使真菌更易入侵和逃避宿主的免疫防御[22],而真菌菌丝的形成与诸多因素有关,如培养基成分、温度、CO2诱导剂、真菌孢子浓度[23,24]等。为了初步验证涂板的真菌菌液浓度对抑菌环大小的影响,以大肠埃希氏菌为参照,在“抑菌环试验”中将涂板的大肠埃希氏菌、白色念珠菌浓度稀释在原试验的基础上再稀释10倍,结果仍旧同前一致,对大肠埃希氏菌平板产生了大于7mm的抑菌环(图4),对白色念珠菌平板依旧不产生抑菌环(图5)。根据以上试验结果,猜测由于纳米N-TiO2的光催化抑菌效果相对有机抑菌材料来讲比较缓慢,在“抑菌环试验”中光催化反应初期产生的羟基自由基(·OH)和超氧自由基(O2-),无法完全杀灭所接触到的所有白色念珠菌,同时又可能促使一定比例的真菌体在这种刺激下从抗性较弱的酵母相转化为抗性很强的菌丝相,由于和培养琼脂紧密接触的菌体可以获得充足的营养来源,以致光催化杀灭作用无法继续杀灭试验样片周围一定范围内的剩余菌丝相白色念珠菌,待白色念珠菌培养到一定时间后即能在肉眼状态下可见琼脂板上没有产生抑菌环。金黄色葡萄球菌的细胞壁含90%的肽聚糖和10%的磷壁酸,大肠埃希氏菌则具有由肽聚糖组成的细胞壁,带有鞭毛具备一定的运动能力,但通过上述试验证明这两种细菌的细胞壁结构显然在羟基自由基(·OH)和超氧自由基(O2-)的强氧化能力下即可被破坏致细菌死亡。在“抑菌环试验”中观察到纳米N-TiO2对白色念珠菌未产生抑菌环,并不能说明纳米N-TiO2对白色念珠菌无消毒效果,“载体浸泡定量试验”中由于病菌完全浸泡在纳米N-TiO2喷剂内,无充足营养来源,其结果显示纳米N-TiO2对白色念珠菌的杀灭能力反而比对金黄色葡萄球菌和大肠埃希氏菌还要强。
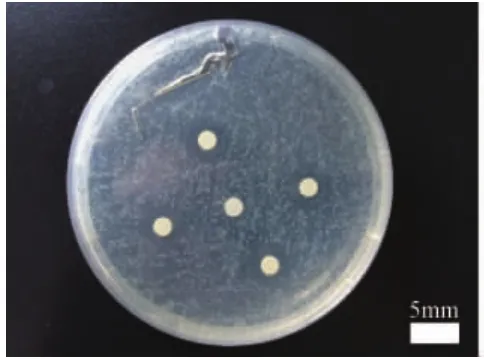
图4 纳米N-TiO2喷剂对大肠埃希氏菌产生抑菌环图注:抑菌环直径>7mm

图5 纳米N-TiO2喷剂对白色念珠菌未产生抑菌环
通过本研究,确定了纳米N-TiO2喷剂对金黄色葡萄球菌、大肠埃希氏菌、白色念珠菌均具有良好的抑菌效果,在不同的实验环境中对不同病菌效果的抑菌效果也是有差异的。北京科技大学曹文斌课题组[25]研发纳米N-TiO2可拓宽TiO2光响应范围,提高光催化率及抑菌效率[26]。本课题组前期进行了纳米N-TiO2的体外细胞毒性研究,初步证实纳米N-TiO2具有人体应用的生物安全基础[27],又通过研究证实了纳米N-TiO2喷剂对口腔科光固化灯光导棒具有很强的消毒作用[28]。本次实验采用功率为40W的日光灯模拟室内自然光作为光源,在本条件下进行的实验结果为纳米N-TiO2的在室内可见光环境下的广泛应用提供了实验依据。需要注意的是,要将本材料在临床中进一步推广应用,还涉及到对其他医院环境污染病菌的抑菌效果、材料的生物安全性以及在实际环境中多种病菌污染、其他有机物干扰、气温湿度影响等情况下的消毒效果等问题,需要在以后继续开展研究逐步解决。
[1] Fujish ima A.TiO2Photocatalysis and Related Surface Phenomena[C].the 60th annual meeting of the international society of electrochemistry.2009
[2] Xing Y,Li X,Zhang L,et al.Effect of TiO2nanoparticles on the antibacterial and physical properties of polyethylenebased film[J].Progress in Organic Coatings,2012,73(2-3):219-224
[3] Tamma PD,Srinivasan A,Cosgrove SE,et al.Infectious Disease Clinics of North America.Antimicrobial stewardship.Preface[J].Infect Dis Clin North Am,2014,28(2):xi
[4] 麦理想,张 晟,王春阳,等.纳米TiO2:C薄膜涂层的构建及对大肠杆菌的抗菌性能研究[J].中山大学学报(自然科学版),2011,50(6):82-87
[5] Aita H,Hori N,Takeuchi Met al.The effect of ultraviolet functionalization of titaniu m on integration with bone[J].Biomaterials,2009,30(6):1015-1025
[6] Li Y H,Cao W B,Wei Y,et al.Preparation of Nitrogendoped Nano-TiO2Powders[J].Journal of Inorganic Materials,2006,21(5):1067-1072
[7] Xu J,Liu Q,Lin S,et al.One-step synthesis of nanocrystalline N-doped TiO2powders and their photocatalytic activity under visible light irradiation[J].Research on Chemical Intermediates,2012,39(4):1655-1664
[8] Liu W X,Jiang P,Shao W N,et al.A novel approach for the synthesis of visible-light-active nanocrystalline N-doped TiO2photocatalytic hydrosol[J].Solid State Sciences,2014,33(24):45-48
[9]YouC,HanC,WangX,et al.Theprogressofsilver nanoparticles in the antibacterial mechanism,clinical application and cytotoxicity[J].Molecular Biology Reports,2012,39(9):9193-9201
[10]卫生部卫生与法规监督司.消毒技术规范[S].北京:中华人民共和国卫生部,2002:45-75
[11]赵 欣,朱健健,李 梦.我国抗菌剂的应用与发展现状[J].材料导报,2016,30(7):68-73
[12]Mahdavi H,Rahmani O,Shahverdi AR.Polyacrylamide/reduced graphene oxide-Ag nanocomposite as highly efficient antibacterial transparent film[J].Journal of the Iranian Chemical Society,2016:1-10
[13]Nan B.N-doped TiO2:Preparation by Hydrothermal Reaction-thermolysis Process and Photocatalytic Activity[J].Chinese Journal of Inorganic Chemistry,2007,23(1):101-108
[14]Foster H A,Ditta I B,Varghese S,et al.Photocatalytic disinfection using titanium dioxide:spectrum and mechanism of antimicrobial activity[J].Applied Microbiology&Biotechnology,2011,90(6):1847-68
[15]梅乐夫,梁开明.氮掺杂TiO2-ZrO2复合光催化薄膜的研究[J].稀有金属材料与工程,2008,37(5):758-761
[16]Li H,Bian Z,Jian Z,et al.Mesoporous Au/TiO2nanocomposites with enhanced photocatalytic activity[J].Journal of the American Chemical Society,2007,129(15):4538-4539
[17]Tieng S,Kanaev A,Chhor K,et al.New homogeneously doped Fe(III)-TiO2photocatalyst for gaseous pollutant degradation[J].Applied Catalysis A General,2011,399(1):191-197
[18]吴雪炜,吴大建,刘晓峻.硼(氮、氟)掺杂对TiO2纳米颗粒光学性能的影响[J].物理学报,2010,59(7):4788-4793
[19]Xu J,Wang F,Liu W,et al.Nanocrystalline N-Doped Powders: Mild HydrothermalSynthesisand Photocatalytic Degradation of Phenol under Visible Light Irradiation[J].International Journal of Photoenergy,2013,2013(2013):937-942
[20]司家文,胡启凡,孙惠强.种植体表面抗菌涂层技术[J].口腔颌面修复学杂志,2011,12(2):119-122
[21]Monteoliva L,Martinezlopez R,Pitarch A,et al.Quantitative proteome and acidic subproteome profiling of Candida albicans yeast-to-hypha transition[J].Journal of Proteome Research,2011,10(2):502-517
[22]I˙lknur Tatlıdil,Münevver Sökmen,ChrisBreen,et al.Degradation of C andida albicans,on TiO2,and Ag-TiO2,thin films prepared by sol-gel and nanosuspensions[J].Journal of Sol-Gel Science and Technology,2011,60(1):23-32
[23]Ibrahim H M M,et al.Photocatalytic degradation of methylene blue and inactivation of pathogenic bacteria using silver nanoparticles modified titanium dioxide thin films[J].World Journal of Microbiology&Biotechnology,2015,31(7):1049-1060
[24]吴绍熙,郭宁如.真菌的分子生物学[J].中国真菌学杂志,2007,2:231-239
[25]曹文斌,许军娜,刘文秀,等.可见光活性氮掺杂纳米二氧化钛研究进展[J].材料工程,2015,43(3):83-90
[26]张小宁,曹文斌,李艳红,等.氮掺杂纳米TiO2改性涂料及其抗菌性能[J].中国涂料,2005,20(11):26-28
[27]唐晓君,施生根,卢 怡.氮掺杂纳米TiO2抗菌剂的体外细胞毒性研究[J].口腔颌面修复学杂志,2014,15(5):269-273
[28]唐晓君,施生根,卢 怡,等.氮掺杂纳米二氧化钛对光固化灯光导棒消毒效果的研究[J].实用口腔医学杂志,2015,31(3):331-334
