D-异抗坏血酸油酸酯的制备及其结构表征*
2017-02-01刘国琴王灵利刘新旗
刘国琴 王灵利 刘新旗
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640;2.北京工商大学 北京食品营养与人类健康高精尖创新中心∥食品学院,北京 100048)
维生素C又称L-抗坏血酸,是一种常见的天然抗氧化剂,具有较强的抗氧化能力[1]和生理活性,但其多羟基的亲水结构限制了它在油基食品中的使用[2].为了增强其脂溶性,使其更好地应用在脂类食品中,在L-抗坏血酸结构上引入脂肪酸对其进行结构修饰,得到的L-抗坏血酸脂肪酸酯具有良好的脂溶性[3].目前关于L-抗坏血酸脂肪酸酯的研究较为广泛,已经合成L-抗坏血酸棕榈酸酯[4]、L-抗坏血酸月桂酸酯[5]、L-抗坏血酸油酸酯[6]、L-抗坏血酸亚油酸酯[7]等多种L-抗坏血酸脂肪酸酯.其中L-抗坏血酸棕榈酸酯已经被批准作为食品添加剂应用于食品行业,而且是我国目前唯一可以应用于婴幼儿食品的抗氧化剂[8].
D-异抗坏血酸是L-抗坏血酸的旋光异构体,分子结构中含有活性连烯二醇结构,是优良的天然抗氧化剂[9].D-异抗坏血酸较L-抗坏血酸有更强的抗氧化能力且价格低廉,但同L-抗坏血酸一样亲油性差,不能很好地应用在油基食品中,故很多学者将目光转向对D-异抗坏血酸改性的研究.目前主要集中在D-异抗坏血酸月桂酸酯[10]、D-异抗坏血酸棕榈酸酯[11]、D-异抗坏血酸棕榈酸酯[12- 13]以及D-异抗坏血酸混合脂肪酸酯[14]的制备和性质研究.因此可见,关于D-异抗坏血酸脂肪酸酯的研究多见于D-异抗坏血酸饱和脂肪酸酯,而D-异抗坏血酸不饱和脂肪酸酯的研究鲜见报道.与饱和脂肪酸相比,修饰得到的不饱和脂肪酸酯与油脂有更好的相容性且不饱和脂肪酸有更好的营养性.因此,文中以不饱和脂肪酸——油酸为酰基供体,叔戊醇为溶剂,Lipozyme 435固定化酶为催化剂合成D-异抗坏血酸油酸酯(D-isoascorbyl oleate,IAO),并根据单因素的实验结果,用JMP软件[15](SAS软件研究所)建立各因素与得率的Box-Behnken数学模型对其合成工艺进行优化,验证因子间的相互作用并得到最优工艺条件.JMP软件可以更直观地预测响应模式对取值范围内任意取值下的实验结果,以期获得准确可靠的最优条件组合.
1 材料与设备
1.1 材料与试剂
D-异抗坏血酸(98%)、油酸(90%),西格玛奥德里奇(上海)贸易有限公司生产;Lipozyme 435脂肪酶,酶活力9 160 PLU/g(PLU指每分钟生成1 μmol丙基月桂酸酯所需的酶的量为一个单位),诺维信(中国)生物科技有限公司生产;4A分子筛,天津科密欧化学试剂有限公司生产;叔戊醇、乙酸乙酯、正己烷,均为分析纯;甲醇、乙腈,均为色谱纯.
1.2 仪器与设备
VERTEX 33傅里叶变换红外光谱仪,德国Bruker公司生产;AVANCE III HD 600超导核磁共振波谱仪,德国Bruker公司生产;Agilent 1100/Esquire HCT PLUS液相色谱-质谱联用仪,德国Bruker公司生产;DionexUltiMate3000高效液相色谱仪,美国DIONEX公司生产.
1.3 实验方法
1.3.1 IAO的合成和萃取分离
将一定量的油酸、D-异抗坏血酸、脱水处理过的叔戊醇、4A分子筛加入到锥形瓶中,在 50 ℃条件下搅拌 30 min 后,再加入一定量的 Lipozyme 435脂肪酶.反应完成后抽滤除去分子筛和脂肪酶.然后取 200 μL 的滤液用甲醇稀释后进液相色谱(HPLC)分析并计算 IAO 得率.剩余的滤液经旋蒸除去溶剂,得到的固体产物用乙酸乙酯和水萃取,将乙酸乙酯层减压蒸馏除去溶剂后再用正己烷洗涤 3~5 次后,氮吹,得到 IAO 产品.
1.3.2 萃取产物的HPLC分析
取一定量的滤液用甲醇稀释,用HPLC技术对合成的IAO进行定量分析,采用紫外检测器,检测波长为250 nm,进样量10 μL,流速1 mL/min,C18色谱柱(Eclipse XDB-C18,5 μm,4.6×250 mm),流动相采用乙腈/水/甲酸体积比为90∶10∶0.05,运行时间20 min.根据面积归一化法,按下式计算得率.

(1)
式中,AIAO和AD-异抗坏血酸分别表示IAO和D-异抗坏血酸的峰面积.
1.3.3 萃取产物的傅里叶变换红外光谱(FTIR)分析
将样品与干燥的KBr混合压片,进行红外扫描,扫描范围400~4 000 cm-1,仪器分辨率优于7.5 px-1.根据IAO和D-异抗坏血酸的FTIR图谱上吸收峰的变化判断待测化合物中的官能团及其结构.
1.3.4 萃取产物的核磁共振波谱(NMR)分析
将得到的IAO用氘代氯仿溶解,室温条件下进行NMR分析,1H NMR和13C NMR的频率分别为600 MHz和151 MHz,以四甲基硅烷为内标物.
1.3.5 IAO合成的单因素试验
以IAO得率为指标,分别选取油酸与D-异抗坏血酸油酸摩尔比3∶1,反应时间20 h,酶添加量5%,温度50 ℃,油酸浓度0.6 mol/L,分子筛添加量100 g/L.固定其它影响因素,分别考察油酸与D-异抗坏血酸摩尔比1∶1、2∶1、3∶1、4∶1、5∶1,反应时间为10、15、20、25、30 h,酶添加量(质量分数)为1%、3%、5%、7%、9%,根据Lipozyme 435脂肪酶的最适催化温度,同时保证反应速率和优化效率,分别选取反应温度为45、50、55、60、65 ℃,底物(以油酸计)浓度为0.3、0.4、0.5、0.6、0.7 mol/L,分子筛添加量为0、50、100、150、200 g/L时的IAO得率变化.确定最适反应条件,同时为响应面优化实验因素和参数的选择提供参考.
1.3.6 响应面法实验设计
以IAO得率(Y)为响应值,根据单因素的实验结果,选取反应时间(X1)、温度(X2)、分子筛添加量(X3)3个影响较大的因素,设计三因素三水平的响应面实验.试验设计如表1所示.根据Box-Behnken设计的15个试验结果用二次多项式回归模型拟合:
Y=β0+∑βiXi+∑βiiXi2+∑∑βijXiXj
(2)
式中,Y为IAO得率,β0、βi、βii、βij分别为截距、一次项、二次项、交互作用项的回归系数.Xi、Xj为影响因素.
表1 响应面试验的因素和水平
Table 1 Analytical factors and levels for response surface metho-dology

因素水平低(-1)中(0)高(1)X1反应时间/h182430X2反应温度/℃455055X3分子筛添加量/(g·L-1)50100150
1.4 数据分析
采用Origin 8.0、SPSS 20.0、JMP 10.0.0进行数据处理和绘图,实验数据均表示为3次平行实验结果的平均值±标准差.
2 结果与讨论
2.1 IAO的合成
按1.3.1的方法合成IAO,其化学反应方程式如图1所示.酶催化合成IAO反应液中各组分的HPLC图谱如图2所示.D-异抗坏血酸和IAO的保留时间分别为2.22和8.73 min.
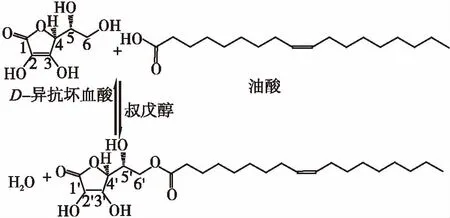
图1 酶催化合成IAO的化学反应式
Fig.1 Reaction formula for lipase-catalysed synthesis of IAO
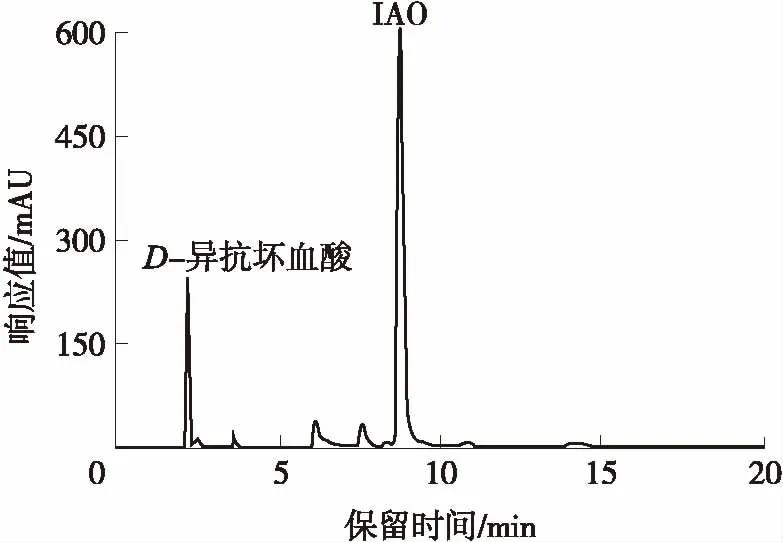
图2 合成IAO反应液的HPLC图谱
2.2 IAO的结构鉴定
2.2.1 IAO产品的HPLC分析
按1.3.1的方法萃取分离得到IAO产品,用甲醇稀释后进行HPLC分析,其色谱图如图3所示.萃取分离后的产物主要为IAO.
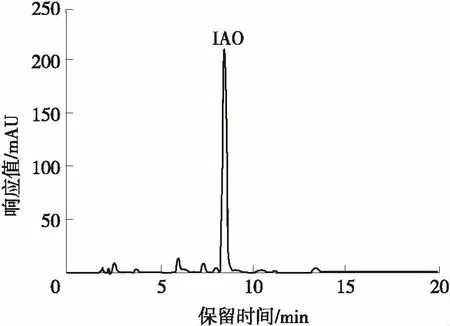
图3 IAO产品的HPLC图谱Fig.3 HPLC chromatogram of extracted IAO products
2.2.2 IAO产品的FTIR分析
对萃取分离得到的IAO产品进行FTIR分析,D-异抗坏血酸和IAO的FTIR图谱如图4所示.
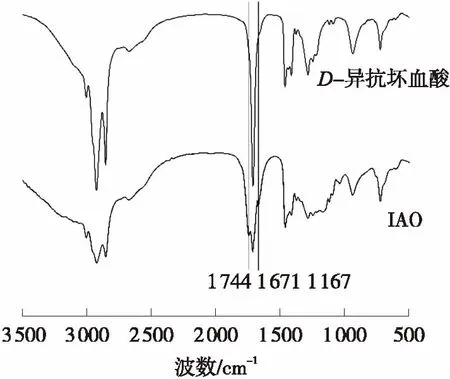
图4 D-异抗坏血酸和IAO的FTIR图谱
Fig.3 FTIR spectra ofD-isoascorbyl acid and extracted IAO products

2.2.3 IAO产品的NMR分析
根据1.3.4中的NMR分析方法对分离后的样品分别进行1H NMR和13C NMR分析,其NMR图谱如图5和图6所示.由NMR图谱可知,13C NMR(151 MHz,Chloroform-d):179.92(C-1′);152.08(C-2′);119.10(C-3′);75.34(C-4′);70.54(C-5′);68.74(C-6′);174.73(C-7);34.02(C-8);25.64(C-9);29.08(C-10);29.33(C-11,C-19);29.69(C-12);29.78(C-13,C-18);27.16(C-14,C-17);130.02(C-15);129.72(C-16);29.53(C-20);29.15(C-21);31.92(C-22);22.69(C-20);14.12(C-24);1H NMR(600 MHz,Chloroform-d):δ5.31~5.24(m,1H),2.30~2.25(m,1H),1.97~1.91(m,2H),1.57(q,J=7.4 Hz,1H),1.31~1.15(m,11H),0.81(t,J=6.9 Hz,2H).与D-异抗坏血酸的13C NMR图谱[11]对比可知,sn-6′位上碳原子的化学位移由61.70增至68.74.1H NMR数据显示,sn-5′位上有羟基,而sn-6′位上无羟基.
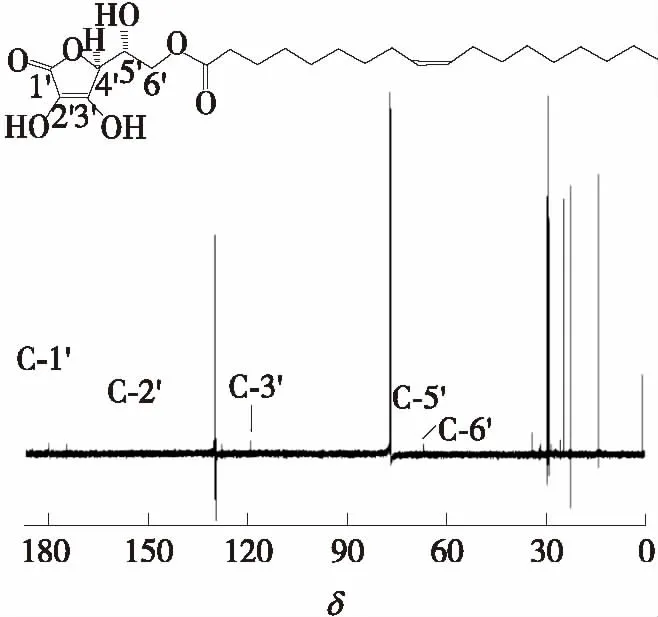
图5 IAO产品的13C NMR图谱Fig.3 13C NMR spectra of extracted IAO products
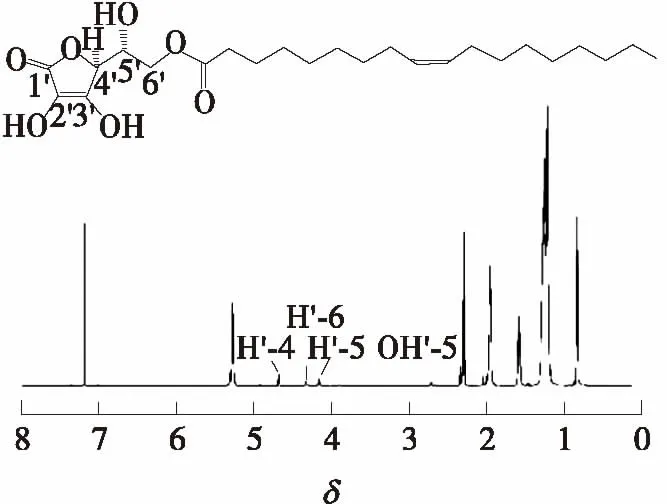
图6 IAO产品的1H NMR图谱Fig.6 1H NMR spectra of extracted IAO products
结合FTIR和NMR的结果可以判定油酸和D-异抗坏血酸的酯化反应发生在D-抗坏血酸的sn-6位的羟基上,其产物为D-异抗坏血酸-6-油酸酯.
2.3 IAO合成的单因素试验
用1.3.5的方法进行单因素试验,结果如图7所示.由图7(a)-(f)可知,随着油酸与D-异抗坏血酸摩尔比的增加、油酸浓度的增大,产物得率呈现先增加后下降的趋势.综合考虑实验得率和有机试剂用量等,本研究选取油酸与D-异抗坏血酸摩尔比3∶1, 油酸浓度为0.6 mol/L.随着反应时间的延长,产物得率呈现先增加后降低的趋势,当反应时间为30 h时产物得率急剧下降,这可能是因为随着时间的延长,生成的水分越多,在一定的时间内水分被分子筛除去,但过长时间的搅拌破坏分子筛的孔穴结构,降低其除水效果,当体系中的水分活度超过酶的最适水分活度后,水分会通过毛细管和渗透作用进入脂肪酶,改变了酶活性,使反应向水解方向进行,而限制了酯化合成反应.随着酶添加量的增加,产物得率呈现先增加后平稳的趋势,这可能是因为脂肪酶在有机相中催化合成IAO的过程中,水分含量逐渐增加,不仅阻碍IAO的催化合成,而且在油水界面脂肪酶会催化IAO的水解.而随着酶添加量的增加,反应速率增大,水分含量快速增加,从而加速IAO水解反应的进行,同时降低其合成反应速率,最终IAO得率趋于平衡.综合考虑生产成本,本研究选取酶添加量为3%.而分子筛可以除去反应过程中产生的水分,减弱水分对酶催化作用的影响,从而促进IAO的合成.随着分子筛的增加,产物得率不断增加,在200 g/L时达到最大值,而添加量达到100 g/L后其得率无显著差异,综合考虑成本和响应面优化的准确性,选择50~150 g/L的分子筛添加量做进一步的优化.综合分析图7中6个因素可知,反应温度、反应时间和分子筛添加量对IAO得率影响较大,所以本研究将对这3个因素做进一步优化.
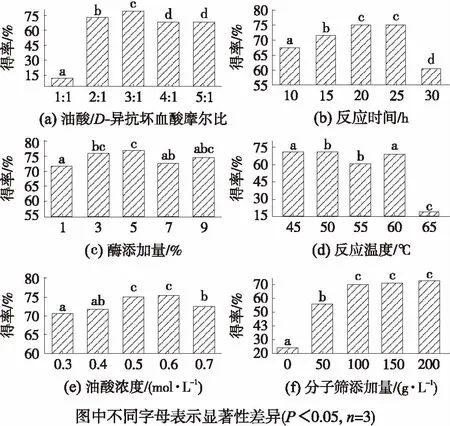
图7 不同因素对IAO得率的影响
Fig.7 Effect of different factors on lipase-catalyzed synthesis of IAO
2.4 响应面优化合成工艺
2.4.1 回归模型的建立
根据单因素的实验结果,本研究选取X1、X2、X3为自变量,IAO得率为响应值,设计响应面的实验方案,其结果如表2所示.
表2 响应面试验设计与结果
Table 2 Experimental design and results of the response surface
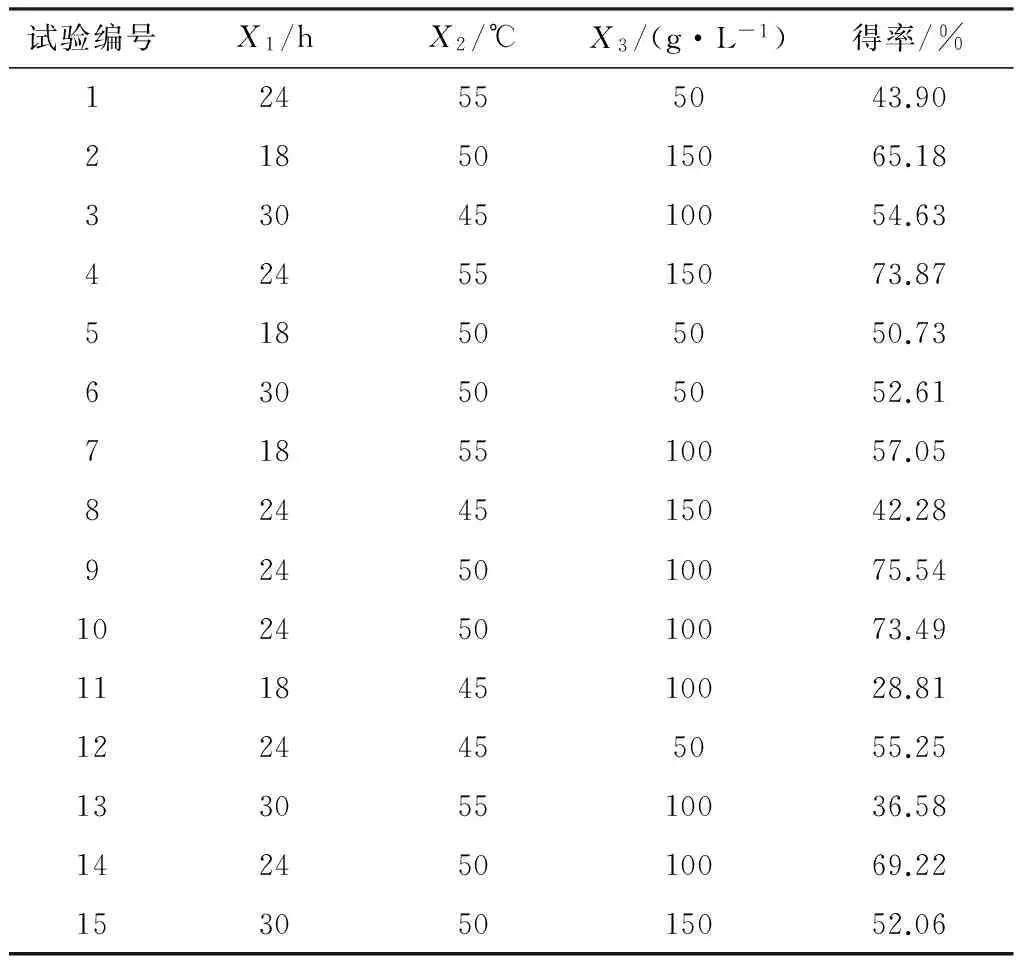
试验编号X1/hX2/℃X3/(g·L-1)得率/%124555043.902185015065.183304510054.634245515073.87518505050.73630505052.617185510057.058244515042.289245010075.5410245010073.4911184510028.811224455055.2513305510036.5814245010069.2215305015052.06
2.4.2 模型建立及方差分析
利用JMP 10.0.0对表2的试验数据进行多元回归拟合,其二次多项回归方程为
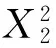


表3 回归模型方差分析表1)Table 3 Analysis of variance for regression equation
续表
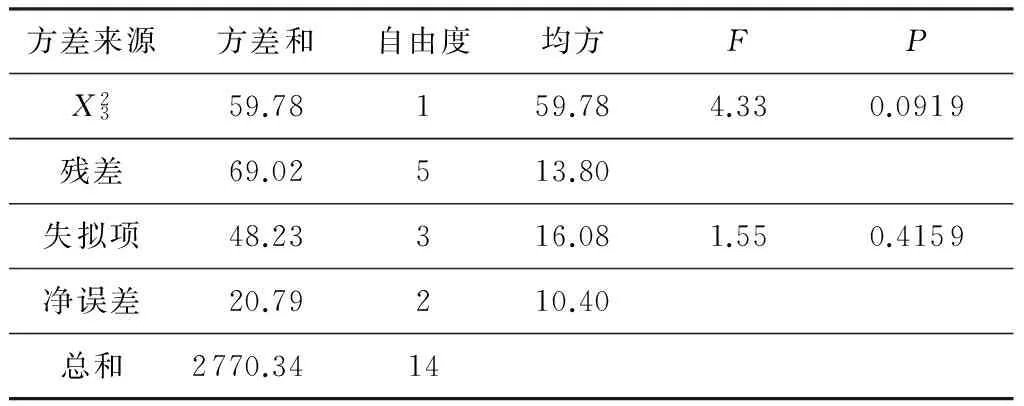
方差来源方差和自由度均方FPX2359.78159.784.330.0919残差69.02513.80失拟项48.23316.081.550.4159净误差20.79210.40总和2770.3414
1)*表示显著,**表示极显著.
2.4.3 响应面法作图分析结果
为了更直观地描述各因子之间的相互作用,优化出最适的工艺条件,结合JMP软件拟合出该模型的响应面立体图(图中黑点表示实际值)和交互作用图,如图8和图9所示.
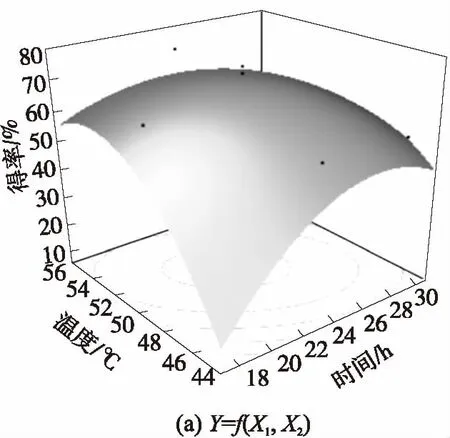
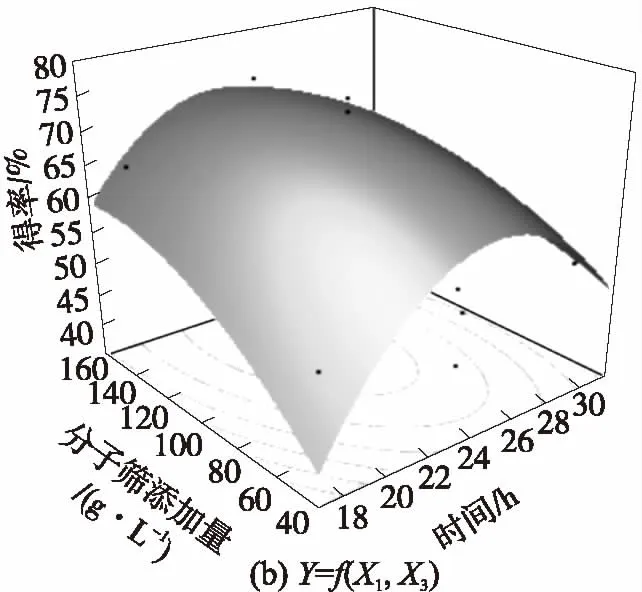
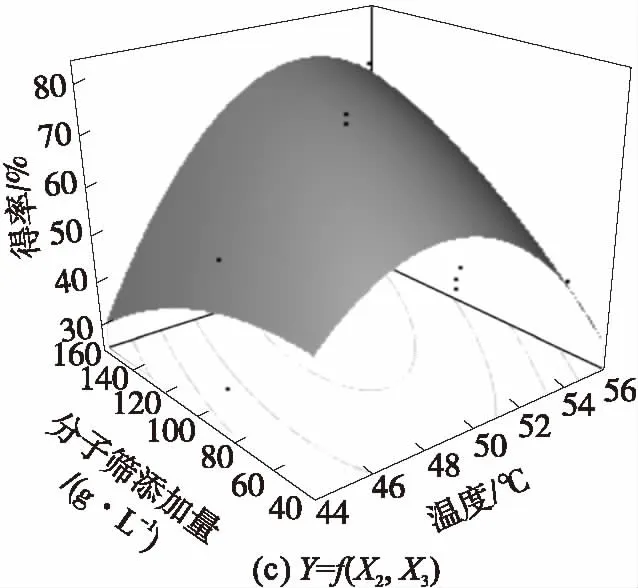
图8 IAO得率的响应面立体图和等高线图
Fig.8 Response surface and contour curve of conversion rate of IAO
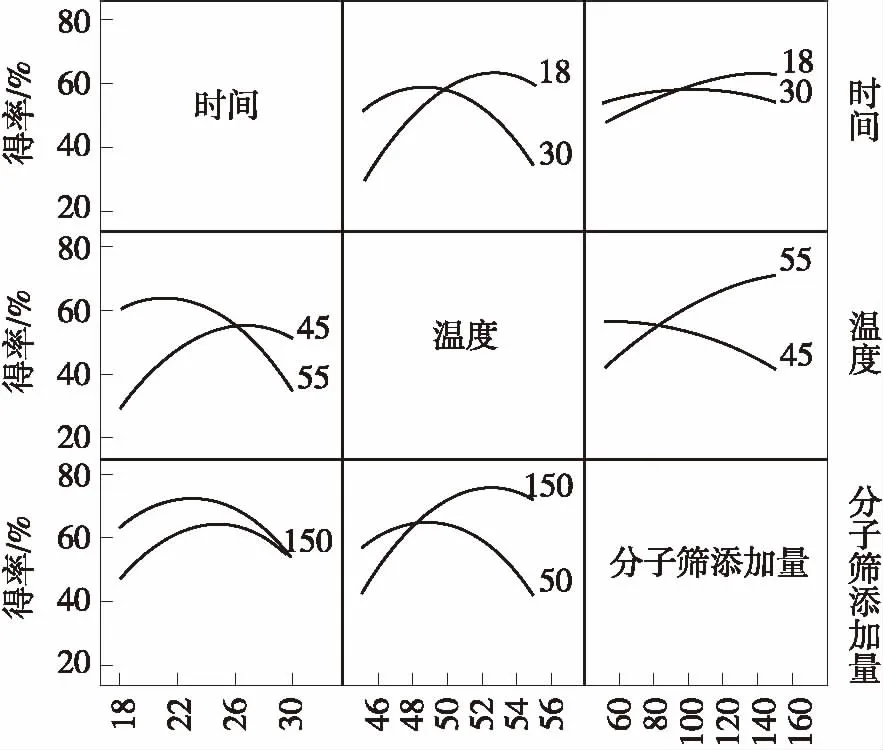
图9 反应时间、反应温度和分子筛添加量间的交互作用图
Fig.9 Interaction among reaction temperature,reaction time,and molecular sieve amounts
由图8和图9可以对X1、X2、X3任意两个因素的交互作用进行分析.交互作用图中,曲线弯曲程度越大,交叉现象越明显表明这种因素的变化随着相应的变量因素的变化而明显变化,即二者的交互作用越明显.由图9可知,X1与X2、X2与X3的交互作用很显著,而X1与X3的交互作用不显著.同时结合方差分析结果,可以得出X1、X2、X33个因素对反应得率影响的大小依次是:X2>X3>X1.
2.4.4 响应面优化结果及模型验证试验
本研究将意愿设到最大化,得到的结果如图10所示,由图可知 IAO合成的最优工艺条件为:反应时间21.3 h,反应温度53.3 ℃,分子筛添加量150 g/L,IAO最大得率为78.40%.为了验证模型的可靠性,按照优化得到的最佳工艺条件进行3次平行试验,IAO得率为(74.65±1.50)%,与预测值接近,因此可以用此模型指导IAO的合成.
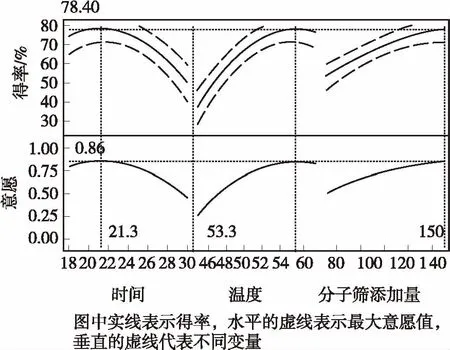
图10 预测值刻画器Fig.10 Prediction profile
3 结论
本研究旨在合成一种新型的脂溶性抗氧化剂,选用比L-异抗坏血酸价格低廉且抗氧化能力更高的D-异抗坏血酸与油酸为研究对象,采用单因素和响应面试验设计对IAO的制备工艺进行优化,得到最佳的工艺条件:油酸与D-异抗坏血酸摩尔比3∶1,反应时间21.3 h,酶添加量3%,反应温度53.3 ℃,油酸浓度为0.6 mol/L,分子筛添加量150 g/L,IAO预测得率为78.40%,与此条件下的实验值(74.65±1.50)%接近,相对误差为4.78%.用FTIR、1H和13C NMR对合成分离后的产物进行结构表征,结果表明合成的IAO的结构主要为D-异抗坏血酸-6-油酸酯.
[1] REKHA C,POORNIMA G,MANASA M,et al.Ascorbic acid,total phenol content and antioxidant activity of fresh juices of four ripe and unripe citrus fruits [J].Chemical Science Transactions,2012,1(2):303- 310.
[2] JIANG X J,HU Y,JIANG L,et al.Optimization of enzymatic synthesis ofL-ascorbyl palmitate by solvent engineering and statistical experimental designs [J].Biotechnology and Bioprocess Engineering,2013,18(2):350- 357.
[3] 王灵利,刘国琴,曹刘霞.响应面法优化L-抗坏血酸油酸酯合成及性能研究 [J].食品工业科技,2011(11):226- 231.
WANG Ling-li,LIU Guo-qin,CAO Liu-xia.Optimization ofL-ascorbate oleate production using response surface methodology and its properties [J].Science and Techno-logy of Food industry,2011(11):226- 231.
[4] LERIN L A,RICHETTI A,DALLAGO R,et al.Enzymatic synthesis of ascorbyl palmitate in organic solvents:Process optimization and kinetic evaluation [J].Food and Bioprocess Technology,2012,5(3):1068- 1076.
[5] CHANG S W,YANG C J,CHEN F Y,et al.Optimized synthesis of lipase- catalyzed l- ascorbyl laurate by Novozym435 [J].Journal of Molecular Catalysis B:Enzymatic,2009,56(1):7- 12.

[7] SONG Q X,ZHAO Y,XU W Q,et al.Enzymatic synthesis ofL-ascorbyl linoleate in organic media [J].Bioprocess and Biosystems Engineering,2006,28(4):211- 215.
[8] KARMEE S K.Lipase catalyzed synthesis of ester-based surfactants from biomass derivatives [J].Biofuels,Bioproducts and Biorefining,2008,2(2):144- 154.
[9] SELLECK R.Flavonoid and antioxidant such as ascorbic acid,erythorbic acid or alpha lipoic acid extend shell life:U.S.Patent 6,749,875 [P].2004- 06- 15.
[10] PARK K M,SUNG H,LEE J H,et al.Lipase-catalysed synthesis of erythorbyl laurate in acetonitrile [J].Food chemistry,2011,129(1):59- 63.
[11] SUN W J,ZHAO H X,CUI F J,et al.D-isoascorbyl palmitate:lipase-catalyzed synthesis,structural characterization and process optimization using response surface methodology [J].Chemistry Central Journal,2013,7(1):1.
[12] LIU Z,SHEN Y,LI W,et al.Process optimization and kinetic evaluation for biosynthesis of D-isoascorbyl stearate [J].Bioprocess and Biosystems Engineering,2015,38(5):833- 839.
[13] CUI F J,ZHAO H X,SUN W J,et al.Ultrasound-assisted lipase- catalyzed synthesis ofD-isoascorbyl palmitate:process optimization and Kinetic evaluation [J].Chemistry Central Journal,2013,7(1):1- 10.
[14] 郑大贵,祝显虹,余泗莲,等.酶法合成异VC混合脂肪酸酯及其抗氧化性能 [J].食品研究与开发,2013,34(14):6- 9.
ZHENG Da-zui,ZHU Xian-hong,YU Si-lian,et al.Lipase-catalyzed synthesis ofD-isoascorbyl mixed-fatty acid esters and their antioxidation activities [J].Food Research and Development,2013,34(14):6- 9.
[15] SALL J,LEHMAN A,STEPHENS M L,et al.JMP start statistics:a guide to statistics and data analysis using JMP [M].[S.l.] :SAS Publishing,2012.
