Survivin抑制剂YM155对视网膜母细胞瘤Y79细胞线粒体凋亡途径的影响*
2017-01-19张晓娟宋秋颖
卫 冬, 张晓娟, 刘 洁, 宋秋颖△
(牡丹江医学院红旗医院 1眼科, 2放射科, 黑龙江 牡丹江 157011)
Survivin抑制剂YM155对视网膜母细胞瘤Y79细胞线粒体凋亡途径的影响*
卫 冬1, 张晓娟2, 刘 洁1, 宋秋颖1△
(牡丹江医学院红旗医院1眼科,2放射科, 黑龙江 牡丹江 157011)
目的: 探讨人生存素(survivin)抑制剂YM155{4,9-二氢-1-(2-甲氧基乙基)-2-甲基-4,9-二氧代-3-(2-吡嗪甲基)-1H-萘并[2,3-d]咪唑鎓溴化物}对视网膜母细胞瘤Y79细胞凋亡、线粒体膜电位(Δψm)和细胞色素C(Cyt C)的影响,探讨其诱导Y79细胞凋亡的线粒体机制。方法: 体外培养Y79细胞,分别以0、0.5、1、2、4、8 nmol/L的YM155进行处理,采用CCK-8法和溴脱氧尿嘧啶核苷(bromodeoxyuridine,BrdU)掺入标记法检测YM155对Y79细胞增殖的抑制作用。Y79细胞随机分为4组:对照组、阳性对照组[加入10 nmol/L拓扑替康(topotecan)]和低剂量(1 nmol/L)、高剂量(2 nmol/L) YM155组。每组设3个复孔,处理24 h。分别采用TUNEL染色和Annexin V-FITC/PI双染法检测凋亡的情况;采用JC-1活细胞染色检测Δψm的变化;采用免疫荧光分析检测Cyt C的分布;采用Western blot法检测survivin和线粒体内Cyt C的蛋白表达。结果: 与对照组比较,YM155对Y79细胞增殖具有明显抑制作用,并诱导Y79细胞凋亡(P<0.05);YM155显著降低Y79细胞的Δψm,促进Cyt C由线粒体释放至胞浆,降低线粒体内Cyt C的水平(P<0.05)。结论: YM155对Y79细胞增殖具有抑制作用,并诱导细胞凋亡,其机制可能是通过线粒体介导的细胞凋亡途径实现的。
视网膜母细胞瘤; YM155; 细胞凋亡; 线粒体凋亡途径
视网膜母细胞瘤(retinoblastoma,RB)是一种严重的致残致死的小儿眼内恶性肿瘤,通常在出生后的第1年发病,往往好发于一侧眼球,发病率约1/17 000,近年来发病率有上升趋势[1],危害着许多儿童的健康。有关于RB的确切发病机制,目前仍然不清楚,但是有研究表明,凋亡抑制蛋白人生存素(survivin)表达升高可能是RB的发病机制之一[2-3]。Survivin是凋亡抑制蛋白家族成员中分子质量最小的蛋白质,在正常分化成熟组织中几乎不表达,但是对肿瘤细胞的增殖、凋亡、细胞周期以及血管形成起重要的调节作用,尤其是其强大的抑制凋亡能力,作为近年来发现的抗凋亡作用最强的细胞调节因子之一,已经成为肿瘤治疗一个新的重要靶点[4-5]。YM155 是一种咪唑类化合物,也是survivin的第一个特异性抑制剂,可明显抑制肿瘤细胞survivin的表达水平,在肿瘤治疗研究中得到了广泛的关注。研究表明,YM155对多种肿瘤细胞有抑制作用,如乳腺癌、肾癌、胃癌、白血病等[6-9]。但是,有关于YM155对RB的作用却鲜见报道,因此本研究以YM155和Y79细胞为研究对象,旨在探讨YM155对Y79细胞的抑制作用以及诱导凋亡是否与线粒体途径有关。
材 料 和 方 法
1 材料
1.1 细胞株 视网膜母细胞瘤Y79细胞由中国科学院上海细胞库提供。复苏Y79细胞,培养在含有10%热灭活胎牛血清的 RPMI-1640培养液(含碳酸氢钠2.0 g/L、青霉素1×105U/L和链霉素100 mg/L)中,37 ℃、5% CO2及饱和湿度下培养。待细胞生长到对数生长期的时候,1 200 r/min离心5 min,收集细胞,Hank 液洗涤细胞2次,然后用不含有BSA的RPMI-1640培养液悬浮细胞,制备成单细胞悬液,用于后续实验。
1.2 药物及配制 YM155(Selleckchem;纯度>98%),溶解于ddH2O,配制成10 nmol/L储备液,-20 ℃冰箱保存,临用时以RPMI-1640培养液稀释到所需浓度。
1.3 主要试剂 拓扑替康(贵州汉方制药有限公司);RPMI-1640培养液(HyClone);胎牛血清(Gibco);BrdUIn-SituDetection Kit(BD);TUNEL细胞凋亡原位检测试剂盒和Annexin V-FITC/PI试剂盒(南京凯基生物有限公司);DAPI(上海碧云天公司);线粒体抽提试剂盒和Hoechst 33258染料(Biowest);JC-1线粒体膜电位(Δψm)检测试剂盒(Genmed);鼠抗人survivin和细胞色素C(cytochrome C,Cyt C)单克隆抗体(Santa Cruz);辣根过氧化物酶(HRP)标记抗鼠IgG II抗(Sigma)。
2 方法
2.2 Y79细胞凋亡的检测 (1) 使用TUNEL细胞凋亡原位检测试剂盒检测YM155对Y79细胞凋亡的影响。取对数生长期Y79细胞,按照每孔1×106个细胞接种于6孔板中,37 ℃、5% CO2及饱和湿度下过夜培养。对照组加入等体积RPMI-1640培养液;阳性对照组加入10 nmol/L拓扑替康;低剂量YM155组加入1 nmol/L YM155;高剂量YM155组加入2 nmol/L YM155。各组细胞均在37 ℃、5% CO2及饱和湿度下培养24 h。PBS冲洗 3 min、2次,然后-20 ℃甲醇固定15 min。1 mL PBS冲洗 3 min、3次,加入50 μL TUNEL反应液,避光37 ℃孵育1 h。1 mL PBS冲洗3 min、2次,Hoechst 33258染料37 ℃避光染色10 min。Olympus BX43荧光显微镜观察细胞核的形态。每个图片随机选取6个高倍视野,计算凋亡指数(apoptotic index,AI; %)=TUNEL阳性细胞数/细胞总数×100%。(2) Annexin V-FITC/PI双染流式细胞术分析:分组同上。1 200 r/min离心5 min,收集细胞,1 mL PBS冲洗2次,然后加入490 μL 1×上样缓冲液混匀。最后加入50 mg/L Annexin V-FITC和PI液各5 μL,37 ℃、5% CO2及饱和湿度下培养60 min,BD FACScan流式细胞仪检测Y79细胞的凋亡情况。每组设6个平行孔。
2.3 激光共聚焦显微镜检测Δψm分组同2.2。1 200 r/min离心5 min,收集细胞,1 mL PBS冲洗2次,加入2 μL JC-1液,37 ℃、5% CO2及饱和湿度下培养130 min。以LSM510 META激光共聚焦显微镜按照JC-1 Δψm检测试剂盒说明书步骤测量荧光信号。按照JC-1不同形式所发射的荧光不同,以红色/绿色荧光比值(FL2/FL1)表示Δψm的变化。ImageJ软件计算FL2/FL1。每组测量6次。
2.4 免疫荧光分析 分组同2.2。待细胞爬满爬片,取出,1 mL PBS冲洗2次,3.7%低聚甲醛固定30 min,1 mL PBS冲洗2次,5% BSA室温封闭15 min,0.2% Triton X-100处理15 min,然后与抗Cyt C小鼠单克隆抗体(1∶50稀释)一起于37 ℃、5% CO2及饱和湿度下培养1 h。1 mL PBS冲洗2次,加入FITC 标记山羊抗小鼠IgG II 抗(1∶400稀释),37 ℃、5% CO2及饱和湿度下培养30 min,DAPI处理10 min,LSM510 META激光共聚焦显微镜观察荧光信号。每组设6个平行孔。
2.5 Western blot法检测survivin和Cyt C的蛋白水平 分组同2.2。1 200 r/min离心5 min,收集细胞,加入含有25 mmol/L HEPES、1% Tris-HCl、50 mmol/L NaCl、1 mmol/L EDTA、1 mmol/L EGTA、1 mmol/L PMSF和1 mg/L亮肽素的冰冷的裂解缓冲液(pH 7.4),10 000 r/min 4 ℃离心10 min,弃沉渣,收集上清液,BCA法测定总蛋白浓度。取30 μg蛋白上样后进行10% SDS-PAGE。当电泳完成后,电转至0.45 μm PVDF膜上,5%脱脂奶粉PBST(含25 mmol/L Tris-HCl、150 mmol/L NaCl和0.1% Tween 20, pH 7.5)4 ℃封闭2 h。然后分别加入鼠抗人survivin和Cyt C单克隆抗体(1∶1 000稀释)4 ℃孵育过夜。PBS洗涤后,加入HRP标记的 II 抗(1∶2 000稀释)室温孵育2 h。PBST洗涤 5 min、3次,ECL化学发光试剂显色,Bio-Rad凝胶成像系统对各组条带进行计值及统计分析。Cyt C检测的线粒体提取过程严格按照线粒体抽提试剂盒说明操作。β-actin抗体孵育方法与上述方法相同,蛋白的相对表达强度=目标蛋白表达强度/β-actin蛋白表达强度。每份样品检测6次。
3 统计学处理
计量数据采用Graphpad 5.0软件进行描述性统计。计量数据用均数±标准差(mean±SD)表示,首先对数据的正态分布和方差齐性进行检验,经检验所有数据符合正态分布,继之多组间均数比较,采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 YM155对Y79细胞细胞增殖的影响
库存管理子系统可以多维度管理库存物料,主要有货位管理、批次管理、序列号管理和出入库管理、预警管理、盘点管理。可以从类别、库别、货位、批次、项目等不同的角度来管理库存物品的数量、库存成本和资金占用情况。可以按不同的需要反映库存的分布情况,同时,库存管理还能满足传统的收发存汇总表,能够定义分部门统计等功能。
CCK-8实验检测结果显示,Y79细胞经0、0.5、1、2、4、8 nmol/L YM155处理24 h、48 h和72 h后,YM155以浓度和时间依赖性抑制Y79细胞的活力,相对细胞活力显著降低,与对照组比较,差异具有统计学意义(P<0.05);YM155作用24 h、48 h和72 h的IC50分别为(2.59±0.31)nmol/L、(1.76±0.23)nmol/L和(1.44±0.20)nmol/L。BrdU掺入法检测结果显示,Y79细胞经0、0.5、1、2、4、8 nmol/L YM155处理24 h后,BrdU阳性细胞数和标记指数显著降低,与对照组比较,差异具有统计学意义(P<0.05)。以上结果提示,YM155可以抑制Y79细胞增殖,见图1。
2 YM155诱导Y79细胞凋亡
2.1 TUNEL染色结果 TUNEL染色检测结果显示,对照组Y79细胞核呈蓝色,边缘光滑完整,均匀淡染。低剂量YM155组、高剂量YM155组和阳性对照组Y79细胞部分染色质出现浓缩状态和边缘化,细胞核裂解为碎块,产生凋亡小体,与对照组比较,差异具有统计学意义(P<0.05),见图2。
2.2 Annexin V-FITC/PI双染流式细胞术分析结果 流式细胞术检测结果显示,低剂量YM155组、高剂量YM155组和阳性对照组Y79细胞凋亡率显著升高,且呈剂量依赖性,与对照组比较,差异有统计学意义(P<0.05),见图3。
3 线粒体膜电位的变化
JC-1活细胞染色结果显示,对照组Y79细胞红绿荧光变化不明显;低剂量YM155组、高剂量YM155组和阳性对照组Y79细胞出现明显红绿荧光变化,FL2/FL1显著减小,Δψm降低,且呈浓度依赖性,与对照组比较,差异具有统计学意义(P<0.05),见图4。
4 YM155对Y79细胞Cyt C分布的影响
对照组Y79细胞胞浆内仅见微弱的荧光信号;低剂量YM155组、高剂量YM155组和阳性对照组Y79细胞,胞浆内出现明显增强的荧光信号,见图5。
5 Western blot检测YM155对Y79细胞survivin和Cyt C蛋白水平的变化
Western blot分析结果显示,低剂量YM155组、高剂量YM155组和阳性对照组Y79细胞的survivin蛋白表达逐渐下调,而Cyt C的蛋白表达逐渐上调,与对照组比较,差异具有统计学意义(P<0.05),见图6。

Figure 1.The effect of YM155 at different concentrations on the proliferation of Y79 cells. A: the results of CCK-8 assay; B: the results of BrdU incorporation assay. Mean±SD.n=6.*P<0.05,**P<0.01vs0 nmol/L.
图1 不同浓度YM155对Y79细胞增殖的影响

Figure 2. Induction of Y79 cell apoptosis by YM155 observed by TUNEL staining. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图2 YM155诱导Y79细胞凋亡的TUNEL染色结果
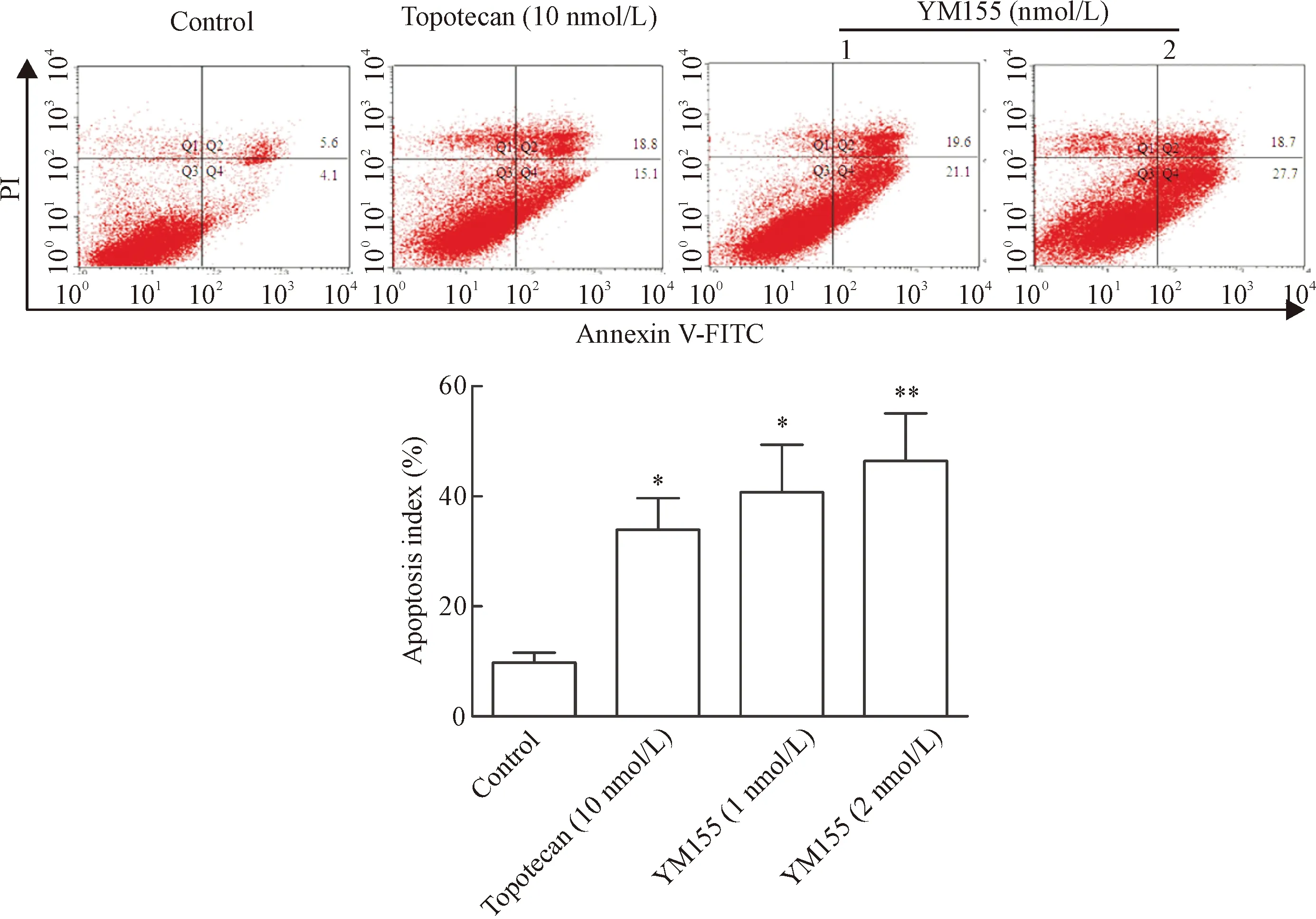
Figure 3. The results of flow cytometry analysis for determining the Y79 cells apoptosis induced by YM155. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图3 YM155诱导Y79细胞凋亡的流式细胞术结果

Figure 4. The JC-1 staining of the Y79 cells. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图4 Y79细胞JC-1活细胞染色结果
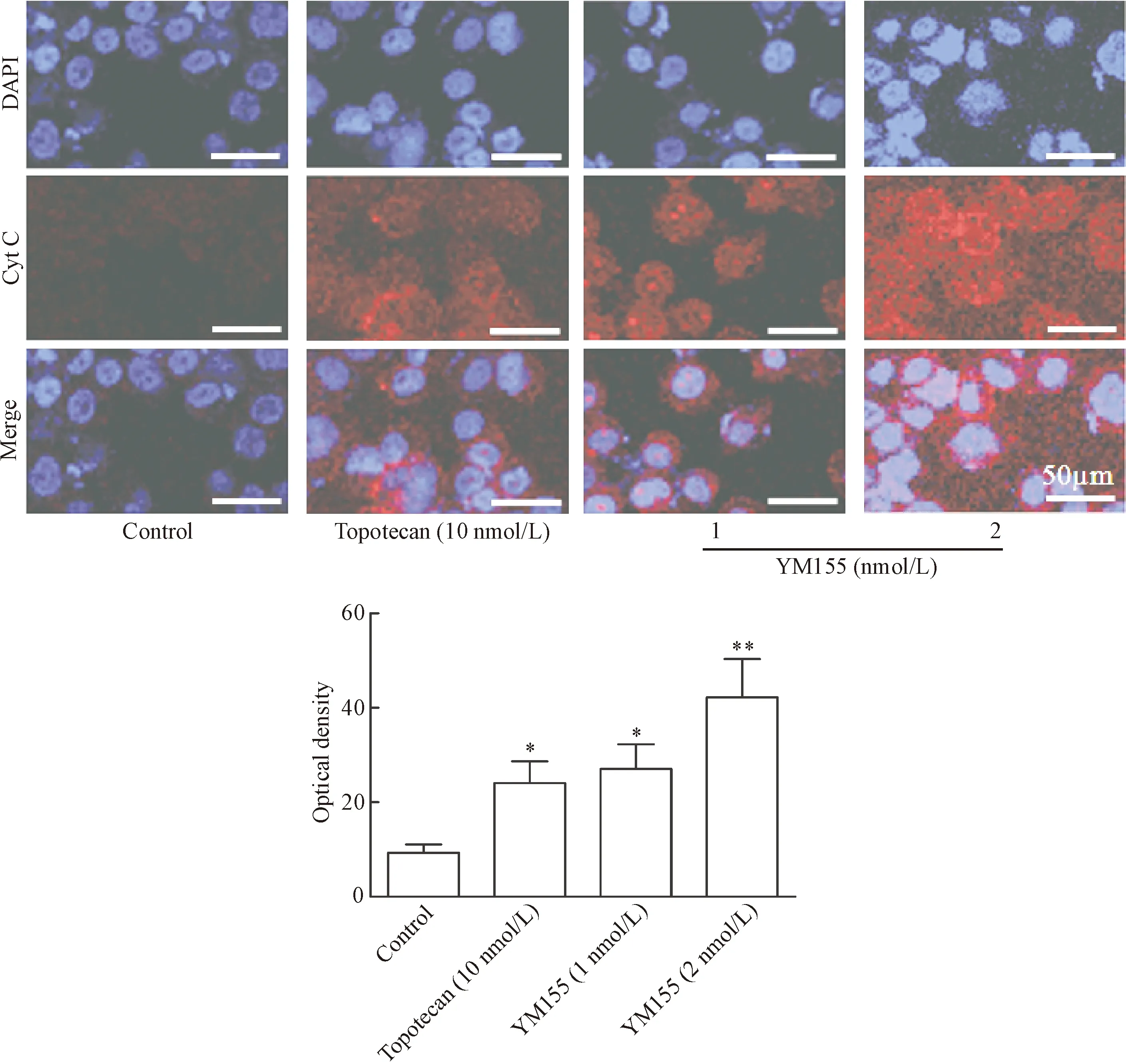
Figure 5.The immunofluorescence of Cyt C in the Y79 cells. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图5 Y79细胞Cyt C免疫荧光染色的结果观察
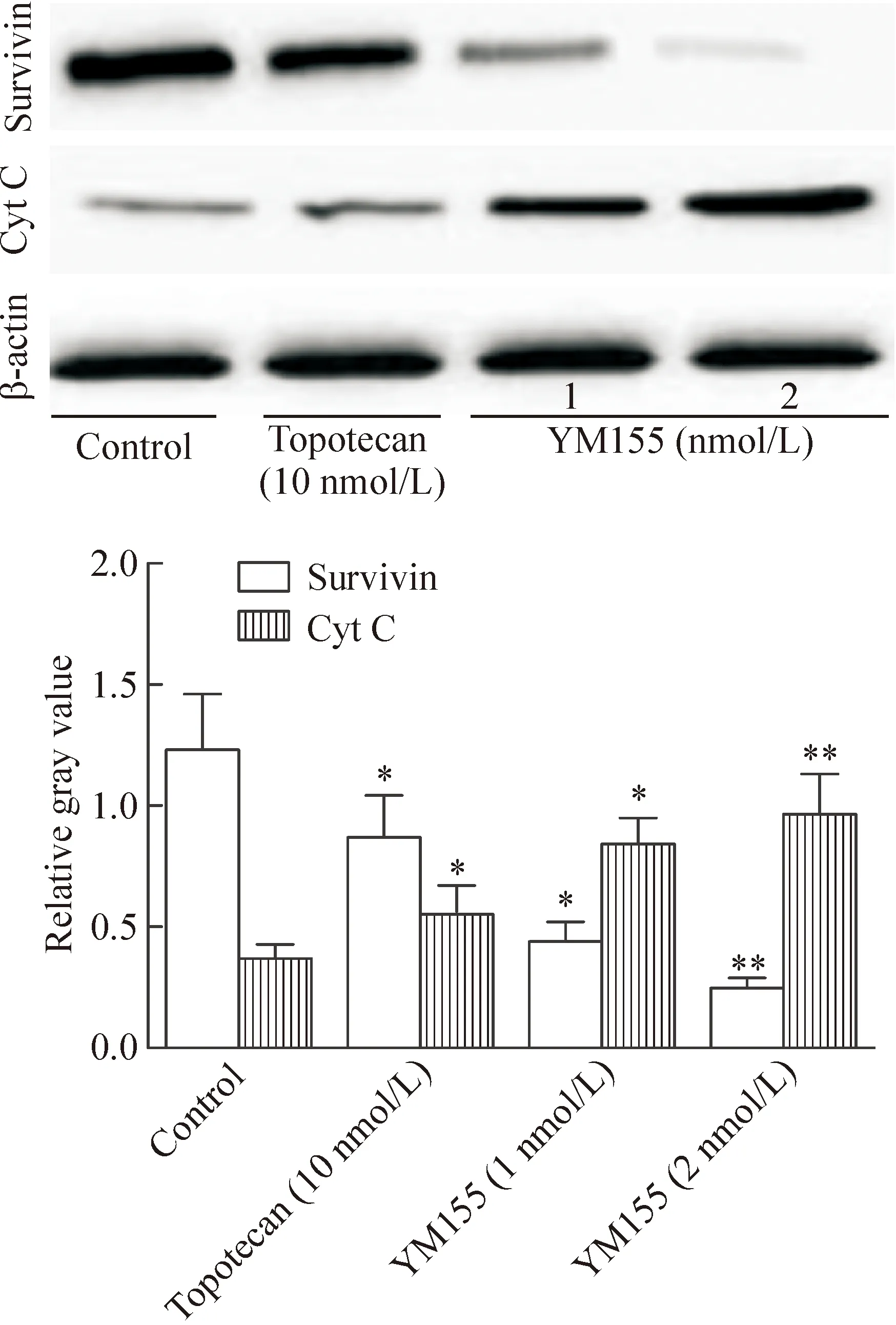
Figure 6. The Western blot results of survivin and Cyt C protein levels in the Y79 cells. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图6 Y79细胞Western blot结果
讨 论
基于survivin表达升高,是RB的发病机制之一[2-3],本研究以survivin抑制剂YM155和Y79细胞为研究对象,探讨YM155潜在的对RB治疗作用。虽然RB的细胞株比较多,如HXO-RB44细胞、SO-RB50细胞和Y79细胞等,但是研究凋亡的大多采用Y79细胞,而且Y79细胞的研究技术非常成熟,故此,本研究以Y79细胞作为RB的代表细胞。本研究结果证实,YM155可显著抑制Y79细胞survivin的表达。本研究结果发现,YM155对Y79细胞增殖有一定抑制作用,提示YM155可作为RB的潜在药物。同时流式细胞术和TUNEL染色分析证实,YM155可诱导Y79细胞凋亡。细胞凋亡是由一系列复杂的信号传导通路和基因调控的一种生理性死亡过程,对保持自身平衡十分重要,肿瘤的生长速率很难控制,这与凋亡能力的减弱和增殖能力的提升密切相关[11]。涉及细胞凋亡的信号通路包括线粒体介导的凋亡通路和死亡受体介导的凋亡通路,其中线粒体途径和死亡受体途径为诱导细胞凋亡的主要途径[12-13]。线粒体是凋亡信号转导途径中起关键调节作用的细胞器,在凋亡过程中具有重要的调控作用,其Δψm是反映线粒体内膜通透性的最佳指标之一[14]。Cyt C是一种水溶性小分子物质,位于线粒体中,是线粒体呼吸链的重要组成部分,在细胞凋亡中发挥着重要作用,是最早被发现的线粒体释放的促凋亡蛋白[15]。Δψm的破坏被认为是细胞凋亡级联反应过程中最早发生的事件之一[16]。当Δψm降低后,线粒体膜肿胀、通透性增高,Cyt C从内膜脱落出来并释放到胞质中,与凋亡蛋白酶激活因子及caspase-3前体相互作用,形成复合物,激活下游的效应caspase,从而诱导凋亡[17]。
本研究发现,在YM155诱导Y79细胞凋亡的过程中,也检测到Δψm的平行下降,表明YM155诱导Y79细胞凋亡可能与Δψm有关。以上结果初步提示,YM155诱导Y79细胞凋亡可能是通过线粒体介导的细胞凋亡途径实现的。
为了进一步证实在YM155诱导Y79细胞凋亡过程中是否有Cyt C由线粒体释放至胞浆,本研究采用免疫荧光和Western blot分析相结合的方法检测Cyt C的分布和表达。结果发现,Y79细胞胞浆Cyt C荧光强度显著增强,线粒体内Cyt C表达显著降低。以上结果提示,在YM155诱导Y79细胞凋亡过程中确实存在Cyt C由线粒体释放至胞浆,参与诱导凋亡。
综上所述,YM155具有明显抑制Y79细胞增殖的作用,诱导其凋亡,其诱导Y79细胞凋亡机制可能是通过线粒体介导的细胞凋亡途径实现的。至于caspase-3及其底物、多聚核糖ADP聚合酶是否参与此过程,本研究将做进一步探讨。
[1] Houston SK, Murray TG, Wolfe SQ, et al. Current update on retinoblastoma[J]. Int Ophthalmol Clin, 2011, 51(1):77-91.
[2] 黄海东, 李莉洋, 郭 颖, 等. PTEN和survivin基因在视网膜母细胞瘤组织中的表达及临床意义[J]. 武警医学, 2014, 25(1):24-26.
[3] Shehata HH, Abou Ghalia AH, Elsayed EK, et al. Detection of survivin protein in aqueous humor and serum of re-tinoblastoma patients and its clinical significance[J]. Clin Biochem, 2010, 43(4-5):362-366.
[4] Carruthers KH, Metzger G, Choi E, et al. A therapeutic role for survivin in mitigating the harmful effects of ionizing radiation[J]. Sarcoma, 2016, 2016:1830849.
[5] 陈立波. 苦参碱对宫颈癌Hela 细胞增殖、凋亡及Survivin 基因表达的影响[J]. 中国实验方剂学杂志, 2013, 19(15):235-238.
[6] Véquaud E, Séveno C, Loussouarn D, et al. YM155 potently triggers cell death in breast cancer cells through an autophagy-NF-kB network[J]. Oncotarget, 2015, 6(15):13476-13486.
[7] Koike H, Nitta T, Sekine Y, et al. YM155 reverses rapamycin resistance in renal cancer by decreasing survivin[J]. J Cancer Res Clin Oncol, 2014, 140(10):1705-1713.
[8] 成小姣, 丁燕飞, 朱黎明, 等. YM155对人胃癌细胞株MKN28的作用及其机制研究[J]. 胃肠病学, 2013, 18(2):82-85.
[9] 丁亦含, 樊晓东, 吴晶晶, 等. Survivin 抑制剂YM155 对K562 细胞凋亡和自噬的影响[J]. 中国实验血液学杂志, 2015, 23(2):375-380.
[10]Ferrario A, Luna M, Rucker N, et al. Targeting survivin enhances chemosensitivity in retinoblastoma cells and orthotopic tumors[J]. PLoS One, 2016, 11(4): e0153011.
[11]邵淑丽, 刘 锐, 隋文静, 等. 大蒜素诱导结肠癌HT-29细胞凋亡[J]. 基因组学与应用生物学, 2015, 34(2):227-233.
[12]刘盛楠, 邵淑丽, 王维熠, 等. 川楝素诱导人肺癌A549细胞凋亡[J]. 中国细胞生物学学报, 2015, 37(8):1087-1094.
[13]范蕊芳, 刘玲玲, 张 玲, 等. 唑来膦酸抑制U937 细胞增殖及诱导凋亡[J]. 中国病理生理杂志, 2016, 32(7):1021-1026.
[14]蒋时红, 吴耀松, 刘 燕. 胃康舒宁促胃癌细胞凋亡机制与线粒体凋亡途径[J]. 中国实验方剂学杂志, 2013, 19(21):203-206.
[15]富 苏, 范吉平, 王新志. 通络化痰胶囊对H2O2所致的PC12细胞凋亡的保护作用及机制[J]. 中国实验方剂学杂志, 2013, 19(2):188-192.
[16]齐一鸣, 黄俊琪. 2型登革病毒通过线粒体途径诱导EA. hy926细胞凋亡[J]. 中国病理生理杂志, 2013, 29(3):385-389.
[17]王立宏, 武兴斌, 王 利, 等. 银杏叶提取物对非小细胞肺癌PC-9细胞增殖的影响[J]. 中国中医药信息杂志, 2015, 22(5):65-68.
(责任编辑: 陈妙玲, 罗 森)
Effects of survivin inhibitor YM155 on mitochondrial apoptotic pathway of retinoblastoma Y79 cells
WEI Dong1, ZHANG Xiao-juan2, LIU Jie1, SONG Qiu-ying1
(1DepartmentofOphthalmology,2DepartmentofRadiology,HongqiHospitalofMudanjiangMedicalUniversity,Mudanjiang157011,China.E-mail:songqiuying1980@qq.com)
AIM: To investigate the effects of survivin inhibitor YM155 {4,9-dihydro-1-(2-methoxyethyl)-2-methyl-4,9-dioxo-3-(2-pyrazinylmethyl)-4,9-dihydro-1H-naphtho[2,3-d]imidazolium bromide} on the apoptosis, mitochondrial membrane potential (Δψm) and cytochrome C (Cyt C) of retinoblastoma Y79 cells, and to analyze the mitochondrial mechanisms of apoptosis.METHODS: Y79 cells were culturedinvitroand treated with YM155 at concentrations of 0, 0.5, 1, 2, 4 and 8 nmol/L. The cells in control group were treated without YM155. The proliferation of Y79 cells were measured by CCK-8 assay and bromodeoxyuridine (BrdU) labeling assay. Y79 cells were randomly divided into 4 groups: control group (with equal volume of RPMI-1640 nutrient medium), positive control group (10 nmol/L topotecan), low-dose (1 nmol/L) YM155 group and high-dose (2 nmol/L) YM155 group. The effects of YM155 on the apoptosis, the changes of Δψm, the mitochondrial distribution and the protein level of Cyt C in the Y79 cells were evaluated by flow cytometry with Annexin V-FITC/PI staining, JC-1 staining, immunofluorescence analysis and Western blot, respectively. RESULTS: Compared with control group, YM155 significantly inhibited the proliferation of Y79 cells and induced apoptosis (P<0.05). YM155 significantly reduced Δψmof the Y79 cells, promoted Cyt C which released from mitochondria to the cytosol and reduced the protein level of Cyt C in the mitochondria (P<0.05). CONCLUSION: YM155 inhibits Y79 cell proliferation and induces apoptosis, and the possible mechanisms may be involved in the mitochondrium-mediated apoptotic pathway.
Retinoblastoma; YM155; Apoptosis; Mitochondrial apoptotic pathway
1000- 4718(2017)01- 0026- 07
2016- 06- 27
2016- 10- 17
黑龙江省卫生计生委科研课题(No. JS215H623)
R730.23
A
10.3969/j.issn.1000- 4718.2017.01.005
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0453-6586082; E-mail: songqiuying1980@qq.com
