微贮玉米秸秆对道寒杂交断奶羔羊瘤胃发酵及微生物区系的影响
2017-01-18郭云霞郝庆红刘月琴张英杰任淑月
郭云霞 郝庆红 刘月琴 张英杰 任淑月
(1.河北农业大学动物科技学院,保定071001;2.河北农业大学生命科学学院,保定071001)
微贮玉米秸秆对道寒杂交断奶羔羊瘤胃发酵及微生物区系的影响
郭云霞1,2郝庆红2刘月琴1*张英杰1任淑月2
(1.河北农业大学动物科技学院,保定071001;2.河北农业大学生命科学学院,保定071001)
本试验旨在研究微贮玉米秸秆对道寒杂交断奶羔羊瘤胃发酵及微生物区系的影响,为微贮玉米秸秆促进营养物质消化吸收研究提供理论依据。试验选用平均体重为(24.62±3.59) kg的道寒杂交断奶羔羊80只,采用单因子完全随机试验设计分为5组(每组16只),分别饲喂以微贮玉米秸秆替代0(对照)、25%、50%、75%、100%青贮玉米秸秆的全混合日粮(TMR)。预试期15 d,正试期60 d。结果表明:在饲喂4 h后,瘤胃液pH除25%添加组较对照组稍有下降(P>0.05)外,50%、75%、100%添加组分别较对照组提高了1.39%(P>0.05)、4.16%(P<0.05)、7.45%(P<0.01);随着微贮玉米秸秆添加量的增加,瘤胃液总挥发性脂肪酸的含量呈先上升后降低趋势,25%、50%、75%添加组分别较对照组升高了0.93%(P>0.05)、4.18%(P>0.05)、5.19%(P<0.05),100%添加组与对照组相近(P>0.05);各添加组瘤胃液乙酸/丙酸均低于对照组,25%、50%、75%、100%添加组分别较对照组下降了12.44%(P<0.05)、4.93%(P>0.05)、12.21%(P<0.05)、9.86%(P<0.05)。变性梯度凝胶电泳(DGGE)图谱分析得出,微贮玉米秸秆替代适量青贮玉米秸秆促进了瘤胃液纤维降解菌的增殖,抑制了蛋白质降解菌的增殖。综上可知,以微贮玉米秸秆替代75%青贮玉米秸秆配制TMR更有利于提高道寒杂交断奶羔羊的瘤胃发酵水平。
断奶羔羊;微贮玉米秸秆;瘤胃液;挥发性脂肪酸;DGGE
1 材料与方法
1.1 试验设计
选取80只体况良好、健康的平均体重为(24.62±3.59) kg的道寒杂交断奶羔羊,采用单因子完全随机试验设计将供试羊随机分成5组(表1),分栏饲养,每组16只。预试期为15 d,期间对试验羊的健康状况进行检查,并编号。正试期为60 d,每天分别在08:00和16:00饲喂,自由饮水,定期对羊舍进行清扫及消毒,保证羊舍干燥卫生。
1.2 微贮玉米秸秆的制作
微贮玉米秸秆制作:添加发酵菌剂(枯草芽孢杆菌N-8∶枯草芽孢杆菌N-10∶酵母菌=4∶4∶3,活菌数均为1.0×1010CFU/g,每吨秸秆添加100 g)和硫酸铵(每吨秸秆添加3%)混合均匀后厌氧发酵30 d,启用。试验所用微贮玉米秸秆与青贮玉米秸秆的营养成分见表2。
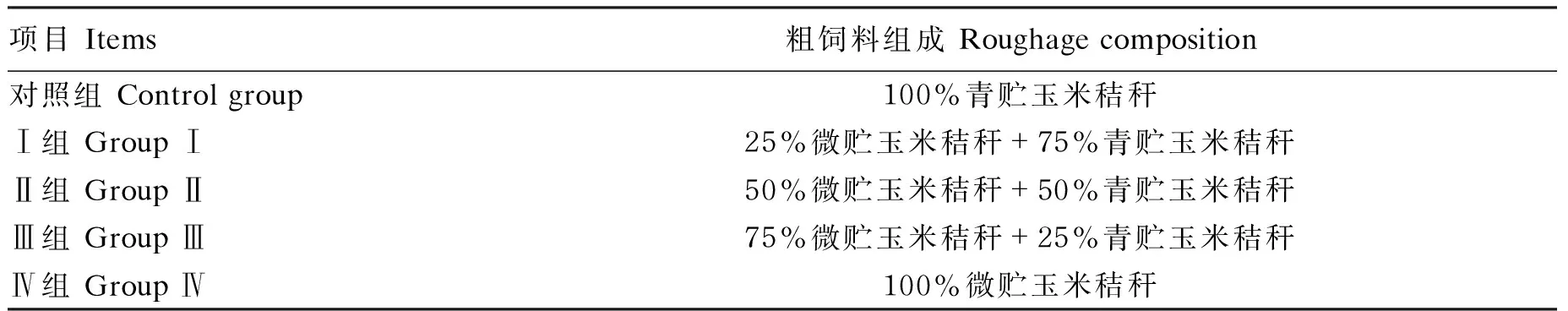
表1 试验设计
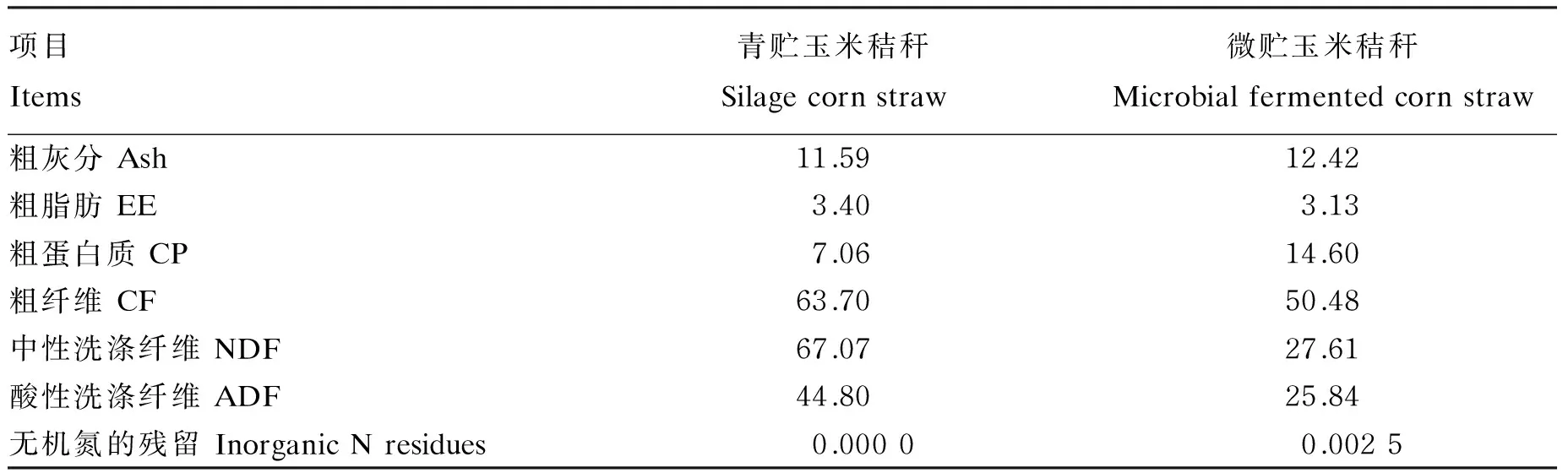
表2 青贮玉米秸秆与微贮玉米秸秆的营养成分(干物质基础)
1.3 试验饲粮配制
参考NRC(2007)饲养标准制订全混合日粮(TMR)配方(表3)。随着羊体重的增加,按日增重200 g左右进行饲喂量的调整,共3期,每期20 d。第1期每天每只羊干物质饲喂量为1.0 kg,第2期和第3期逐渐增加到1.1 kg左右,以保证羊只生长的需要。
1.4 检测指标
1.4.1 瘤胃液pH
饲养试验结束当天,对照组、Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组饲喂时间分别为07:00、10:00、13:00、16:00、19:00,屠宰时间分别为11:00、14:00、17:00、20:00,屠宰后立即采集瘤胃液。每组选取5只进行屠宰,采用4层纱布过滤进行瘤胃液的采集,每只采集10 mL,采集后立即测定pH(pHS-3C pH测定仪)。
1.4.2 瘤胃液细菌计数
将瘤胃液取5 mL放入冰盒中,带回实验室后取1 mL瘤胃液采用10倍梯度稀释法稀释至10-5、10-6、10-73个稀释度,涂布于营养琼脂(NA)培养基上,9 cm平板的接种量为100 μL,每个稀释度至少3个平行,37 ℃厌氧恒温培养48 h,选择菌落数为30~300的平板进行计数。

表3 全混合日粮组成及营养水平(风干基础)
1)多维和矿物微量元素为每千克全混合日粮提供Multi-vitamin and mineral trace elements provide the following per kg of TMR: VA 10 260 IU,VE 301 IU,VD 2 200 IU,Fe 57.86 mg,Zn 42.73 mg,Mn 33.65 mg,Cu 9.34 mg,Se 0.19 mg,I 0.76 mg,Co 0.23 mg。
2)营养水平为实测值。Nutrient levels are measured values.
1.4.3 瘤胃液VFA含量的测定
将瘤胃液经4层纱布过滤,滤液经7 500 r/min离心5 min,过微孔滤膜,参照Mkhize等[7]的方法利用气相色谱(Agilent MSD-5975C)-质谱仪(Agilent GC-7890A)直接进样分析瘤胃液中VFA的含量。采用自动进样器(Agilent 7683B Series),毛细管柱(Agilent HP-INNOWA:30 m×0.250 mm×0.25 μm;火焰离子化检测器(FID)。
色谱条件:载气为氮气(N2)(144.58 kPa,总流量24 mL/min);进样口温度250 ℃;质谱仪四极杆温度150 ℃;离子源温度230 ℃;采用程序升温,初始温度100 ℃,时间3 min,以5 ℃/min的速率升温至150 ℃,运行13 min,再以30 ℃/min的速率升温至210 ℃;进样量为1 μL。
1.4.4 瘤胃液中菌群丰度的测定
取饲喂4 h后的瘤胃液,采用十六烷基三甲基溴化铵(CTAB)手提法提取样品基因组总DNA。以样品基因组DNA为模板,采用细菌通用引物GC-338F和518R(表4)扩增样品16S rDNA高变区序列,为了在后续的变性梯度凝胶电泳(DGGE)中提高其分辨率,采用GC夹技术,即在其上游引物338F前加上GC重复序列。采用变性梯度为35%~55%、浓度为7%的聚丙烯酰胺凝胶在1×TAE缓冲液中于150 V、60 ℃下电泳5 h。
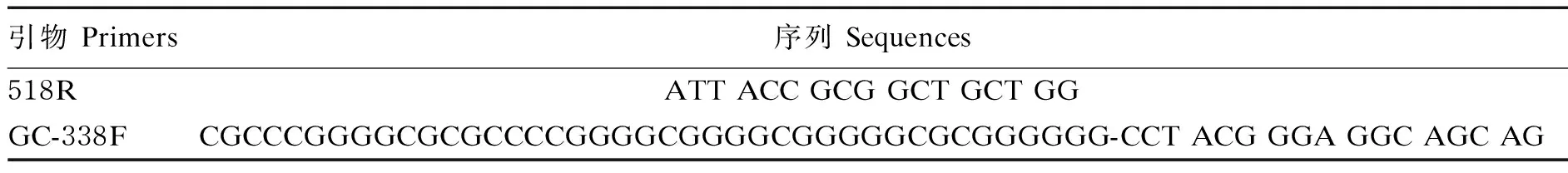
表4 引物序列
采用T-gradient PCR仪(Biometra,德国)进行PCR扩增,Gel-Doc2000凝胶成像仪(Bio-Rad,美国)进行成像。
PCR扩增体系(50 μL)为:10×PCR buffer 5 μL、dNTP(2.5 mmol/L)3.2 μL、rTaq(5 U/μL)0.4 μL、GC-338F(20 μmol/L)1 μL、518R(20 μmol/L)1 μL、模板DNA 50 ng,补双蒸水(ddH2O)至50 μL。
PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃复性45 s,72 ℃延伸1 min,30个循环;最终72 ℃延伸10 min。
PCR产物采用OMEGA公司的DNA Gel Extraction Kit纯化回收。测序结果采用DNAstar和Cluster软件进行序列分析,下载最相似的菌株序列作为系统发育树的参考序列,然后采用MEGA5.0软件利用邻接(neighbor-joining)法构建系统发育树,自展数(bootstrap)为1 000。
1.5 数据分析与统计
试验数据采用Excel 2013软件进行整理,利用SPSS 17.0进行统计分析,通过单因素方差分析进行显著性检验,试验结果以平均值±标准差(mean±SD)表示。P<0.01为差异极显著,P<0.05为差异显著。
2 结果与分析
2.1 微贮玉米秸秆对瘤胃发酵的影响
2.1.1 微贮玉米秸秆对瘤胃液pH和总菌数的影响
由表5可知,添加微贮玉米秸秆后,饲喂4 h后的瘤胃液pH除Ⅰ组有所下降外,其他试验组均呈上升趋势,Ⅱ组、Ⅲ组、Ⅳ组分别较对照组提高了1.39%(P>0.05)、4.16%(P<0.05)、7.45%(P<0.01),同时Ⅳ组还极显著高于Ⅰ组、Ⅱ组(P<0.05),但与Ⅲ组无显著差异(P>0.05)。各微贮玉米秸秆添加组瘤胃液总菌数均高于对照组,其中Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组与对照组相比分别增加了20.69%(P<0.01)、17.24%(P>0.05)、34.48%(P<0.01)、10.34%(P>0.05)。

表5 微贮玉米秸秆对瘤胃液pH和总菌数的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference(P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). The same as below.
2.1.2 微贮玉米秸秆对瘤胃液VFA含量的影响
由表6可知,饲粮中添加不同量的微贮玉米秸秆后瘤胃液乙酸含量有不同程度下降,与对照组相比,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组分别下降了10.56%(P<0.01)、2.81%(P>0.05)、7.83%(P<0.01)、15.03%(P<0.01)。与对照组相比,Ⅰ组、Ⅱ组、Ⅲ组瘤胃液丙酸含量分别提高了0.59%(P>0.05)、2.01%(P>0.05)、4.73%(P>0.05),但Ⅳ组则出现极显著降低(P<0.01)。饲粮中添加不同量的微贮玉米秸秆后瘤胃液丁酸、异丁酸、戊酸含量表现为显著或极显著升高(P<0.05或P<0.01),己酸含量表现为显著或极显著降低(P<0.05或P<0.01)。与对照组相比,Ⅰ组、Ⅱ组、Ⅲ组瘤胃液总VFA含量分别升高了0.93%(P>0.05)、4.18%(P>0.05)、5.19%(P<0.05),Ⅳ组接近对照组,差异不显著(P>0.05)。与对照组相比,第Ⅰ组、Ⅱ组、Ⅲ组瘤胃液乙酸/丙酸分别下降了12.44%(P<0.05)、4.93%(P>0.05)、12.21%(P<0.05)、9.86%(P<0.05)。
2.2 微贮玉米秸秆对瘤胃微生物区系的影响
2.2.1 瘤胃液中菌群的聚类分析
DGGE图谱中所有样品均产生了清晰、丰富的条带,说明瘤胃液中微生物的菌种丰度均较高,同时也可看到不同组别的条带在数目和颜色深浅上有所差异,说明不同组瘤胃液中细菌种类和数量存在差异。DGGE图谱聚类分析表明,玉米秸秆微贮可以影响瘤胃的微生物区系。由图1可知,5组样品聚成两大簇,其中对照组、Ⅰ组、Ⅱ组聚为一簇,Ⅲ组、Ⅳ组聚为一簇。由戴斯系数比较PCR-DGGE图谱的相似性可知,Ⅰ组、Ⅱ组之间的相似值大于0.61,说明这2个组之间瘤胃菌群的相似性较高;Ⅲ组与除对照组外的其他组之间的相似值均小于0.40,表明此组与其他3组的相似性较低。由此可见,随着玉米秸秆微贮添加量的增加,瘤胃内菌群的相似性逐渐降低。

表6 微贮玉米秸秆对瘤胃液VFA含量的影响

A2、B2、C2、D2、E2分别代表对照组、Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组。图2同。
A2, B2, C2, D2 and E2 are control group, groupⅠ, group Ⅱ, group Ⅲ and group Ⅳ, respectively. The same as Fig.2.
图1 各组瘤胃液中菌群的聚类分析
Fig.1 Cluster analysis of microflora in ruminal fluid among groups
2.2.2 主要电泳条带的序列测定及分析
按不同组中条带亮度的不同,选取16条DGGE凝胶条带(图2中标注的16条条带)回收后,以GC-338F和518R为引物进行PCR扩增,获得目的DNA片段。PCR产物纯化后连接到pMD18-T载体上,转化至大肠杆菌DH5α感受态细胞中,筛选阳性克隆测序。测序结果与GenBank中的序列进行比对,得到条带所代表的细菌类型。每个回收条带选取3个克隆进行序列测定,序列比对分析结果见表7。结果表明,切胶回收条带所代表的细菌与现有数据库中的细菌有很高的同源性,大部分在90%以上,有的同源性甚至达到了100%。
由序列比对分析结果可知,条带1和8已鉴定与原虫相似性为99%。由DGGE图谱可知,随着微贮玉米秸秆添加量的增加,条带1和8的亮度先逐渐减弱后增强,均在添加量为100%时最亮;图谱上条带2、6、7已鉴定与拟杆菌门中的拟杆菌相似性在90%以上,在Ⅲ组中条带6、7亮度有增强的趋势;条带3、4与瘤胃普氏菌相似性为98%,是瘤胃中重要的纤维降解菌,随着微贮玉米秸秆添加量的增加,条带亮度逐渐增强;条带5、9、11已鉴定与不可培养瘤胃细菌类群相似,相似性达到99%,鉴定为不可培养瘤胃细菌,随着微贮玉米秸秆添加量的增加,条带5的亮度在Ⅲ组、Ⅳ组高于其他组,而条带9、11的亮度则是逐渐增强;条带10、16已鉴定为与变形杆菌门中的变形菌门类群的相似度为90%,随着微贮玉米秸秆添加量的增加,其亮度逐渐减弱;条带14、15与厚壁菌门类群的相似度分别为99%和98%,鉴定为反刍月形单胞菌,随着微贮玉米秸秆添加量的增加,其亮度逐渐增强;条带15鉴定为不可培养毛螺旋菌,随着微贮玉米秸秆添加量的增加,其亮度呈下降趋势,以对照组最亮。
采用MEGA5.0软件,邻接法构建系统发育树(图3),自展数为1 000,其中条带1和8的相似类群属于原虫,不参加构建系统发育树。
3 讨 论
瘤胃发酵水平直接影响营养物质的利用率。瘤胃内环境的稳定主要体现在瘤胃液pH上,而pH的变动与饲粮的类型和采食后的时间密切相关[3]。当粗饲料占饲粮比例由2/3降低至1/4时,瘤胃液pH在饲喂4 h后由6.2下降至5.9,这可能是精料含量过多,瘤胃微生物快速降解碳水化合物,导致pH降低[8];反之,饲粮中粗纤维的含量越高,瘤胃液pH越高,高的pH利于瘤胃纤维素降解菌的增殖。据报道,纤维素分解菌(如琥珀酸生成菌、白瘤胃球菌、黄瘤胃球菌等)对酸的耐受性较差,其最适pH为6.0~7.0,当瘤胃液pH下降至6.0时则抑制纤维素菌的生长[9-10]。本试验结果表明,在精粗比为1∶2的条件下,通过添加微贮玉米秸秆配制TMR,在饲喂4 h后,随着微贮玉米秸秆添加量的增加,瘤胃液pH先下降后逐渐上升,其中添加75%和100%微贮玉米秸秆的组的瘤胃液pH分别为6.01和6.20,与对照组相比分别提高了4.16%和7.45%,差异显著或极显著。这可能是由于微贮玉米秸秆中含有可降解秸秆中纤维素和木质素的芽孢菌(枯草芽孢杆菌和酵母菌活菌),饲喂4 h后,瘤胃微生物发酵产生VFA,导致瘤胃液pH降低,但是随着微贮玉米秸秆添加量的增加,瘤胃液pH有明显的升高,表明适量微贮玉米秸秆的添加有助于提高瘤胃的发酵水平,且微贮玉米秸秆中含有数量很高的活性芽孢菌,可短时间提高瘤胃内降解纤维素菌的数量,这与冯伟业[11]的报道一致。
纤维素菌数量增多,饲粮在瘤胃内发酵产生的VFA含量增加,表明微生物发酵能力增强。VFA是瘤胃中碳水化合物发酵的主要产物,主要包含乙酸、丙酸、丁酸等。乙酸主要用于氧化供能,丙酸则被肝脏转变为体组织成分,用于生长、繁殖,另外丙酸产量与甲烷的产生量之间呈负相关,因此,丙酸含量上升可以减少生成甲烷的能量损失[12]。VFA含量的变化与饲粮中粗饲料比例密切相关。当饲粮中粗饲料比例由30%提高至50%时,总VFA合成量增加,其中乙酸和丁酸产量下降,丙酸产量则上升[13-15]。从由不同精粗比(3∶7、4∶6、5∶5)试验中得知,在饲喂0~4 h阶段,随着粗饲料比例的增加,乙酸含量呈下降趋势,而丙酸浓度呈上升趋势[16]。本试验采集饲喂4 h后的瘤胃液,随着微贮玉米秸秆添加量的增加,乙酸含量下降趋势增大,丙酸含量升高趋势降低,与对照组相比,添加75%微贮玉米秸秆的组瘤胃液乙酸含量降低了7.83%,丙酸含量增加了4.73%,总VFA含量增加了5.19%,乙酸/丙酸降低了12.21%,促进了营养物质的消化吸收。
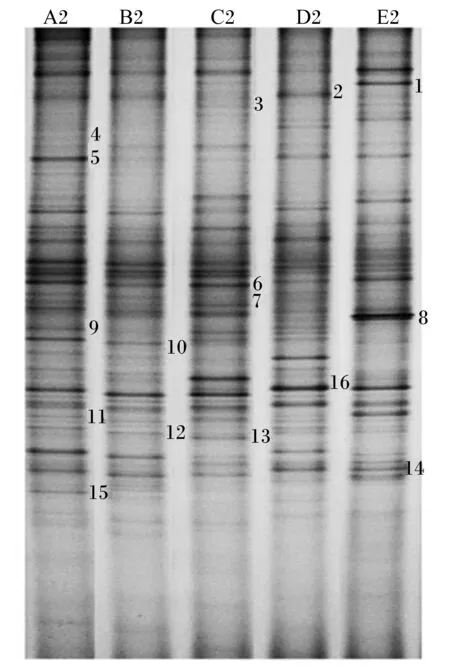
图2 DGGE电泳图
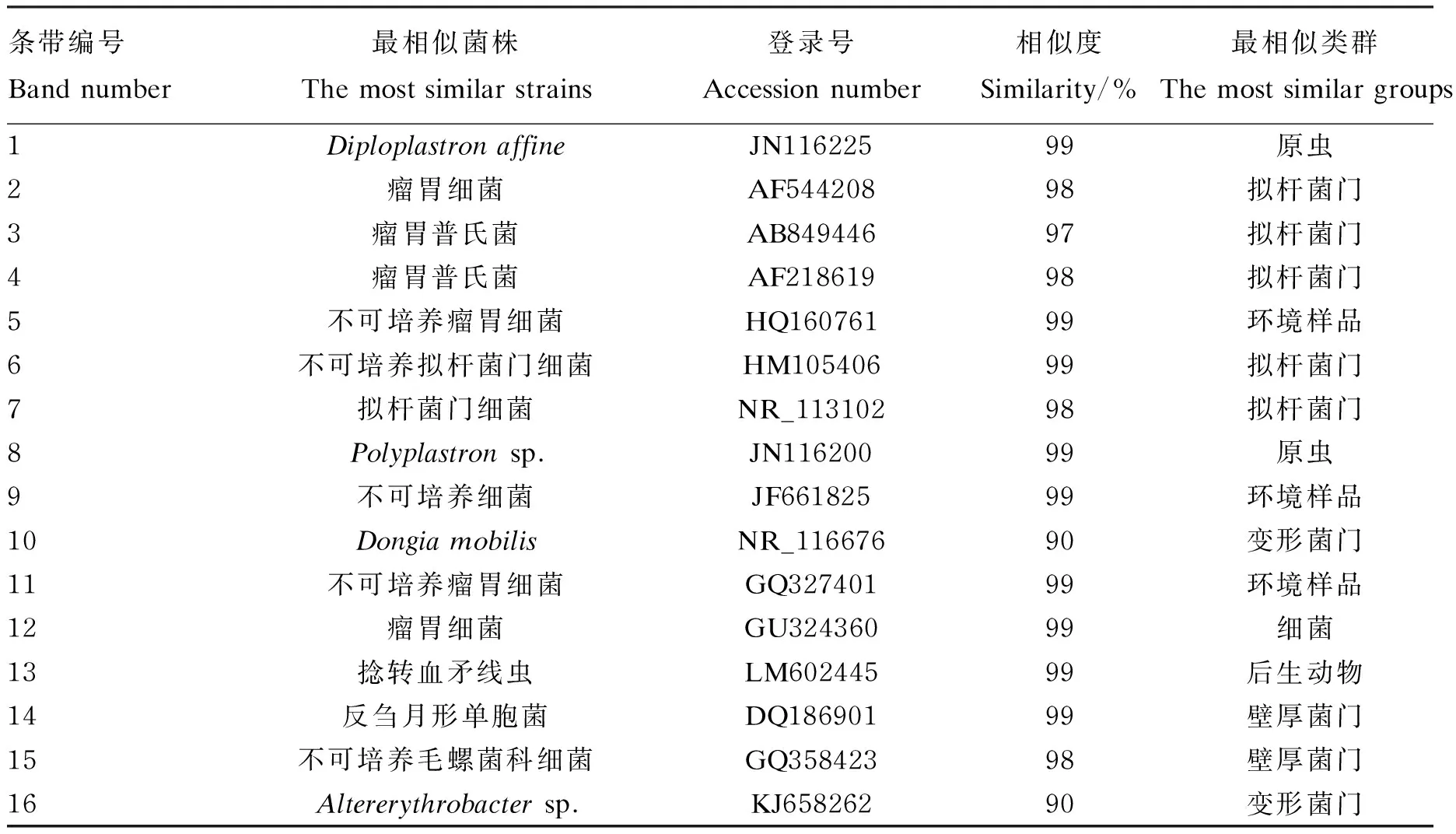
条带编号Bandnumber最相似菌株Themostsimilarstrains登录号Accessionnumber相似度Similarity/%最相似类群Themostsimilargroups1DiploplastronaffineJN11622599原虫2瘤胃细菌AF54420898拟杆菌门3瘤胃普氏菌AB84944697拟杆菌门4瘤胃普氏菌AF21861998拟杆菌门5不可培养瘤胃细菌HQ16076199环境样品6不可培养拟杆菌门细菌HM10540699拟杆菌门7拟杆菌门细菌NR_11310298拟杆菌门8Polyplastronsp.JN11620099原虫9不可培养细菌JF66182599环境样品10DongiamobilisNR_11667690变形菌门11不可培养瘤胃细菌GQ32740199环境样品12瘤胃细菌GU32436099细菌13捻转血矛线虫LM60244599后生动物14反刍月形单胞菌DQ18690199壁厚菌门15不可培养毛螺菌科细菌GQ35842398壁厚菌门16Altererythrobactersp.KJ65826290变形菌门
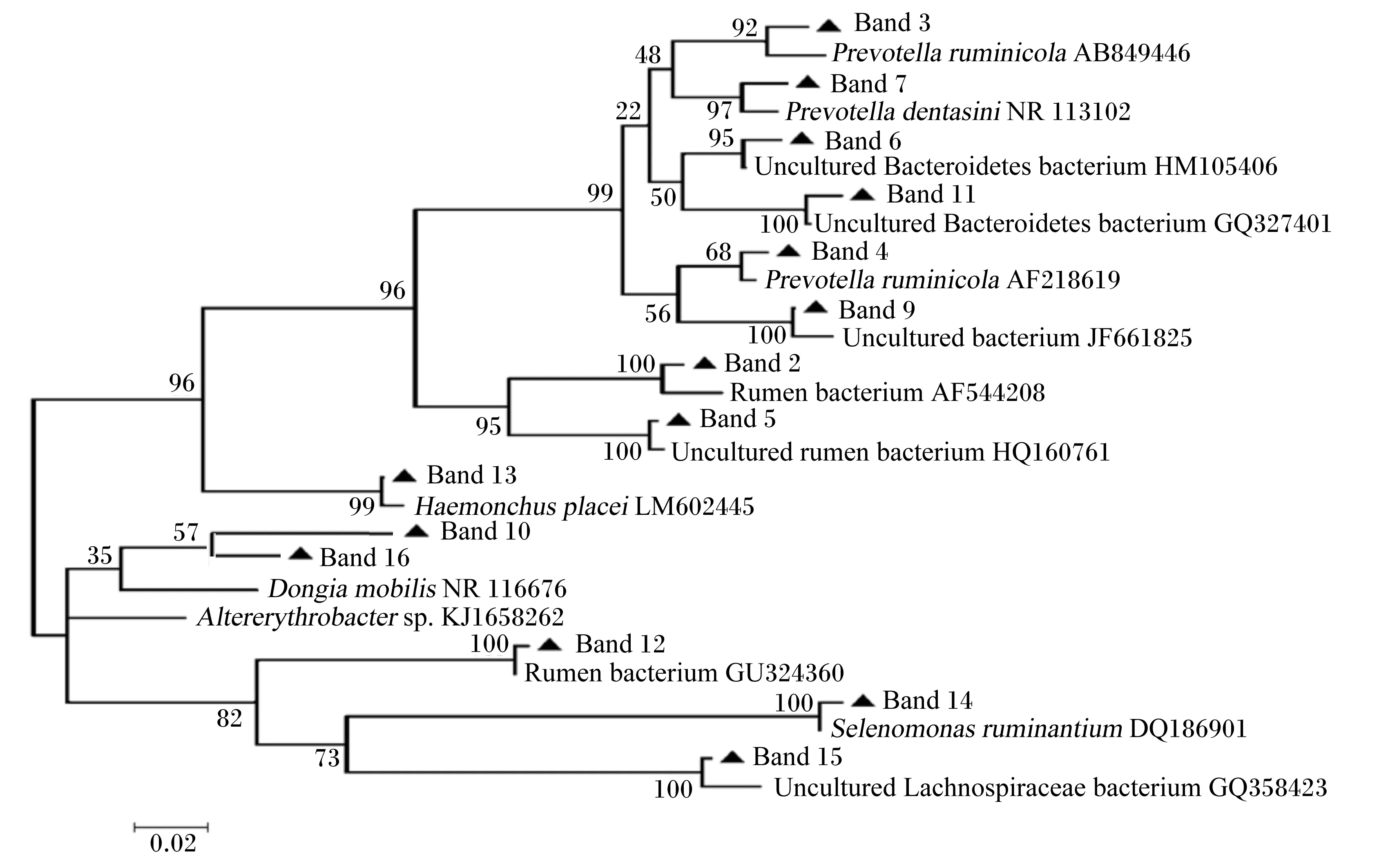
Band:条带;Prevotellaruminicola:瘤胃普氏菌;UnculturedBacteroidetesbacterium:不可培养拟杆菌门细菌;Uncultured bacterium:不可培养细菌;Rumen bacterium:瘤胃细菌;Uncultured rumen bacterium:不可培养瘤胃细菌;Haemonchusplacei:捻转血矛线虫;Selenomonasruminantium:反刍月形单胞菌;Uncultured Lachnospiraceae bacterium:不可培养毛螺菌科细菌。
图3 系统发育树
Fig.3 Phylogenetic tree
瘤胃发酵水平的调节最终依靠的是瘤胃内强大的菌群,瘤胃内的细菌可帮助反刍动物消化纤维素和合成大量菌体蛋白。其中纤维的分解主要依靠真菌的强穿透能力和细菌的发酵特性,使植物纤维组织的内部张力先降低、组织变得疏松,细菌再进一步降解发酵[17]。粗饲料显著影响瘤胃微生物区系,粗饲料比例的升高可显著促进瘤胃内蛋白降解细菌、纤维素降解菌、乳酸菌等的增殖,降低瘤胃原虫的数量[18]。参照文献[19],本试验利用DGGE技术对瘤胃液中菌群丰度进行了测定,试验所得DGGE图谱中各组样品均产生了清晰、丰富的条带,说明瘤胃液中各菌种丰度都较高,同时不同组间瘤胃液中细菌的种类和数量存在差异。由本试验结果可知,由于原虫为低等生物,用细菌引物也能扩增出来,瘤胃原虫对于细菌的吞食可导致氮在瘤胃中的无效循环,而原虫与甲烷菌关系密切,原虫数量降低促进甲烷菌的增殖[20],进而降低能量的损耗,降低瘤胃原虫数量可促进营养物质的消化吸收利用率。随着微贮玉米秸秆添加量的增加,原虫数量先出现下降的趋势,以微贮玉米秸秆添加量为75%时条带亮度最低,但是在添加量为100%时原虫数量又出现增加,表明用微贮秸秆完全替代青贮玉米秸秆不利于瘤胃的发酵。瘤胃普氏菌是瘤胃重要的木质素降解菌,属拟杆菌门,其在进化树上形成了很大的簇,随着微贮玉米秸秆添加量的增加,瘤胃内瘤胃普氏菌和拟杆菌数量增加,表明木质素降解能力增强。此外,厚壁菌门类群中的反刍月形单胞菌是瘤胃内一种主要的乳酸发酵菌,占瘤胃细菌总数的50%以上,可对瘤胃内淀粉进行分解,微贮玉米秸秆添加量为75%和100%时瘤胃液中反刍月行单胞菌数量增多,可加快瘤胃内淀粉的降解。随着微贮玉米秸秆添加量的增加,DGGE图谱中变形菌门和不可培养毛螺旋菌条带的亮度逐渐降低,表明在饲喂4 h后蛋白质的降解速度减慢。由此可以看出,微贮玉米秸秆替代适量青贮玉米秸秆影响了瘤胃微生物区系,可促进木质素和纤维素、淀粉降解菌的增殖,降低蛋白质降解菌的增殖,加快碳水化合物的降解,促进营养物质的消化吸收。
4 结 论
① 以微贮玉米秸秆替代75%青贮玉米秸秆配制TMR,在饲喂4 h后道寒杂交断奶羔羊瘤胃液pH即可达到6.01,利于瘤胃液纤维降解菌的增殖,同时降低蛋白质降解菌的数量。
② 以微贮玉米秸秆替代75%青贮玉米秸秆配制TMR饲喂道寒杂交断奶羔羊,可促进瘤胃内总VFA的合成,利于营养物质的消化吸收。
[1] 李红亚,李术娜,王树香,等.产芽孢木质素降解菌MN-8的筛选及其对木质素的降解[J].中国农业科学,2014,47(2):324-333.
[2] 韩颖洁.微生物发酵秸秆对肉羊生产性能和营养物质表观消化率的影响[D].硕士学位论文.保定:河北农业大学,2015.
[3] 刘洁,刁其玉,赵一广,等.饲粮不同NFC/NDF对肉用绵羊瘤胃pH、氨态氮和挥发性脂肪酸的影响[J].动物营养学报,2012,24(6):1069-1077.
[4] BANNINK A,FRANCE J,LOPEZ S,et al.Modelling the implications of feeding strategy on rumen fermentation and functioning of the rumen wall[J].Animal Feed Science and Technology,2008,143(1/2/3/4):3-26.
[5] 经语佳,高健,郑亚洲,等.6种长链脂肪酸对瘤胃微生物体外发酵挥发性脂肪酸浓度的影响[J].动物营养学报,2014,26(1):252-259.
[6] PENNER G B,TANIGUCHI M,GUAN L L,et al.Effect of dietary forage to concentrate ratio on volatile fatty acid absorption and the expression of genes related to volatile fatty acid absorption and metabolism in ruminal tissue[J].Journal of Dairy Science,2009,92(6):2767-2781.
[7] MKHIZE N T,MSAGATI T A M,MANABA B B,et al.Determination of volatile fatty acids in wastewater by solvent extraction and gas chromatography[J].Physics and Chemistry of the Earth,2014,67/68/69:86-92.
[8] FERNANDO S C,PURVIS Ⅱ H T,NAJAR F Z,et al.Rumen microbial population dynamics during adaptation to a high-grain diet[J].Applied and Environmental Microbiology,2010,76(22):7482-7490.
[9] STEWART C S.Factors affecting the cellulolytic activity of rumen contents[J].Applied and Environmental Microbiology,1977,33(3):497-502.
[10] 刘欢,李德允.不同水分TMR对绵羊瘤胃纤维分解酶活力与微生物生态的影响[J].延边大学农学学报,2013,35(2):160-164.
[11] 冯伟业.不同品质粗饲料日粮及添加酵母培养物对绵羊瘤胃内主要纤维分解菌及纤维物质降解的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2008.
[12] KLIEVE A V,OUWERKERK D.Comparative greenhouse gas emissions from herbivores[C]//Proceedings of the 7th International Symposium on the Nutrition of Herbivores.Beijing:China Agricultural University Press,2007.
[13] 华金玲,郭亮,王立克,等.不同精粗比日粮对黄淮白山羊瘤胃挥发性脂肪酸影响[J].东北农业大学学报,2013,44(6):58-62.
[14] 熊本海,卢德勋,张子仪.瘤胃乙酸与丙酸摩尔比例的改变对瘤胃发酵及血液指标的影响[J].畜牧兽医学报,2002,33(6):537-543.
[15] WANAPAT M,GUNUN P,ANANTASOOK N,et al.Changes of rumen pH,fermentation and microbial population as influenced by different ratios of roughage (rice straw) to concentrate in dairy steers[J].The Journal of Agricultural Science,2014,152(4):675-685.
[16] 华金玲,郭亮,王立克,等.不同精粗比日粮对黄淮白山羊瘤胃内环境的影响[J].中国兽医学报,2013,33(6):913-917.
[17] 王秋菊,胡海权,崔一喆.反刍动物瘤胃生理及代谢调控[J].饲料博览,2006(11):44-46.
[18] HUNG L V,WANAPAT M,CHERDTHONG A.Effects of Leucaena leaf pellet on bacterial diversity and microbial protein synthesis in swamp buffalo fed on rice straw[J].Livestock Science,2013,151(2/3):188-197.
[19] KOCHERGINSKAYA S A,AMINOV R I,WHITE B A.Analysis of the rumen bacterial diversity under two different diet conditions using denaturing gradient gel electrophoresis,random sequencing,and statistical ecology approaches[J].Anaerobe,2001,7(3):119-134.
[20] DOHME F,MACHMÜLLER A,ESTERMANN B L,et al.The role of the rumen ciliate protozoa for methane suppression caused by coconut oil[J].Letters in Applied Microbiology,1999,29(3):187-192.
*Corresponding author, professor, E-mail: liuyueqin66@126.com
(责任编辑 菅景颖)
Effects of Microbial Fermentation Corn Straw on Rumen Fermentation and Microbial Diversity of Dorset×Thin-Tailed Han Weaned Lambs
GUO Yunxia1,2HAO Qinghong2LIU Yueqin1*ZHANG Yingjie1REN Shuyue2
(1.CollegeofAnimalScienceandTechnology,HebeiAgriculturalUniversity,Baoding071001,China; 2.CollegeofLifeScience,HebeiAgriculturalUniversity,Baoding071001,China)
This study was to evaluate the effects of microbial fermented corn straw on microbial diversity of Dorset×thin-tailedHanweaned lambs, and to provide theoretical basis for studies on the microbial fermented corn straw promoting the digestion and absorption of nutrients. Eighty Dorset×thin-tailedHanweaned lambs with the average body weight of (24.62±3.59) kg were randomly assigned to 5 groups and each group had 16 lambs, in which 0 (control), 25%, 50%, 75% and 100% silage corn straw were substituted by microbial fermented corn straw, respectively. Preliminary trial period was 15 days and formal experimental period was 60 days. The results showed as follows: after feeding 4 h, except the 25% addition group decreased a little (P>0.05), the pH of ruminal fluid in 50%, 75% and 100% addition groups increased by 1.39% (P>0.05), 4.16% (P<0.05) and 7.45% (P<0.01) compared with the control group, respectively; with the microbial fermented corn straw addition increasing, the total volatile fatty acid (VFA) content in ruminal fluid was firstly increased and then down, which in 25%, 50% and 75% addition groups increased by 0.93% (P>0.05), 4.18% (P>0.05) and 5.19% (P<0.05) compared with the control group, respectively, but it showed no significant difference between in control group and 100% addition group (P>0.05); the acetate/propionate in ruminal fluid in addition groups was lower than that in control group, and that in 25%, 50%, 75% and 100% groups decreased by 12.44% (P<0.05), 4.93% (P>0.05), 12.21% (P<0.05) and 9.86% (P<0.05) compared with the control group, respectively. By the analysis results of denaturing gradient gel electrophoresis (DGGE), using microbial fermented corn straw to substitute appropriate silage corn straw could improve the proliferation of fiber degradation bacterium and inhibit the proliferation of protein degradation bacterium in ruminal fluid. In conclusion, using microbial fermented corn straw to substitute 75% silage corn straw in TMR is optimum to improve the level of ruminal fermentation of Dorset×thin-tailedHanweaned lambs.[ChineseJournalofAnimalNutrition, 2017, 29(1):239-248]
weaned lambs; microbial fermented corn straw; ruminal fluid; volatile fatty acids; DGGE
10.3969/j.issn.1006-267x.2017.01.027
2016-07-21
国家肉羊现代产业技术体系建设项目(CARS-39);国家绒毛用羊产业技术体系建项目(CARS-40-21)
郭云霞(1978—),女,河北新乐人,高级实验师,博士研究生,从事农业微生物及羊繁殖调控研究。E-mail: gyx310@163.com
*通信作者:刘月琴,教授,硕士生导师,E-mail: liuyueqin66@126.com
S816
A
1006-267X(2017)01-0239-10
