氧化鱼油对黄颡鱼生长性能和抗氧化指标的影响及精氨酸的干预作用
2017-01-18卓丽欣赵红霞黄燕华曹俊明王国霞孙育平
卓丽欣 赵红霞 黄燕华 曹俊明* 王国霞 陈 冰 孙育平
(1.上海海洋大学水产与生命学院,上海201306;2.广东省农业科学院动物科学研究所,广州510640;3.广东省动物育种与营养公共实验室,广州510640;4.广东省畜禽育种与营养研究重点实验室,广州510640)
氧化鱼油对黄颡鱼生长性能和抗氧化指标的影响及精氨酸的干预作用
卓丽欣1,2,3,4赵红霞2,3,4黄燕华2,3,4曹俊明2,3,4*王国霞2,3,4陈 冰2,3,4孙育平2,3,4
(1.上海海洋大学水产与生命学院,上海201306;2.广东省农业科学院动物科学研究所,广州510640;3.广东省动物育种与营养公共实验室,广州510640;4.广东省畜禽育种与营养研究重点实验室,广州510640)
本试验旨在研究饲料中添加氧化鱼油对黄颡鱼(Pelteobagrusfulvidraco)生长性能、体成分、血清生化指标和血清、肝脏抗氧化指标的影响以及添加精氨酸对其的干预作用。选取初始体重为(4.41±0.05) g的健康黄颡鱼幼鱼600尾,随机分为6组,每组4个重复,分别投喂含2.5%新鲜鱼油(FF组)、1.5%新鲜鱼油+1.0%氧化鱼油(FO1组)、0.5%新鲜鱼油+2.0%氧化鱼油(FO2组)、2.5%新鲜鱼油+0.48%L-精氨酸盐酸盐(FFA组)、1.5%新鲜鱼油+1.0%氧化鱼油+0.48%L-精氨酸盐酸盐(FOA1组)、0.5%新鲜鱼油+2.0%氧化鱼油+0.48%L-精氨酸盐酸盐(FOA2组)的6种饲料,投喂期为56 d。结果显示:在FF、FO1、FO2组中,随着氧化鱼油添加量的增加,黄颡鱼的增重率、特定生长率和蛋白质沉积率均逐渐降低,饲料系数和摄食率均逐渐升高,均在FO2组达到极值,与其他2组差异达到显著水平(P<0.05);氧化鱼油饲料添加精氨酸后,在FFA、FOA1、FOA2组上述指标没有产生显著性差异(P>0.05),其中FOA1、FOA2组的增重率分别比FO1、FO2组升高3.0%和9.9%。双因素方差分析结果显示,氧化鱼油对黄颡鱼增重率和摄食率的影响达到显著水平(P<0.05),氧化鱼油与精氨酸对黄颡鱼特定生长率、蛋白质沉积率和饲料系数的影响存在交互作用(P<0.05)。FO1组肝体比显著低于FF组(P<0.05),FO2组肠体比与FFA、FOA2组相比显著降低(P<0.05),氧化鱼油与精氨酸对黄颡鱼肝体比的影响存在交互作用(P<0.05)。FOA1组全鱼粗脂肪含量与FO1组相比显著降低(P<0.05)。在FF、FO1、FO2组中,随着氧化鱼油添加量的增加,黄颡鱼血清总抗氧化能力(T-AOC)逐渐降低,FO2组显著低于FF组(P<0.05);氧化鱼油饲料添加精氨酸后,黄颡鱼血清T-AOC分别升高77.0%(FOA1组vs.FO1组)和137.4%(FOA2组vs.FO2组),其中后者达显著水平(P<0.05)。双因素方差分析结果显示,氧化鱼油对血清丙二醛(MDA)含量的影响达到显著水平(P<0.05),氧化鱼油和精氨酸对黄颡鱼血清T-AOC的影响存在交互作用(P<0.05)。结果表明,在饲料中添加一定量的氧化鱼油会抑制黄颡鱼的生长并降低血清的抗氧化能力,但添加一定量的精氨酸可以缓解氧化鱼油对黄颡鱼生长的抑制作用,并增强其机体的抗氧化能力。
黄颡鱼;氧化鱼油;精氨酸;生长性能;抗氧化指标
黄颡鱼(Pelteobagrusfulvidraco)属鲶形目,鲿科,黄颡鱼属,其蛋白质含量高、营养丰富、味道鲜美,近年来养殖规模日渐扩大,对配合饲料的数量和质量要求均不断提高。饲料的氧化酸败是影响饲料品质和动物生长的重要因素。试验证明,黄颡鱼摄食被氧化的饲料后会降低机体生长性能和免疫抗氧化功能[1]。因此,通过提高黄颡鱼机体的抗氧化能力,降低饲料中氧化物质对其生长性能和抗氧化能力的影响,将对黄颡鱼的健康养殖产生积极的促进作用。

1 材料与方法
1.1 氧化鱼油的制作
氧化鱼油的制作参考殷永风等[11]的方法,并略作改进。将500 g新鲜鱼油装到1 L的大容量烧瓶中,在50 ℃恒温水浴的条件下连续充气氧化。每隔2 d取少量氧化鱼油测定过氧化值(POV),测定方法参照文献[12-13]。当氧化鱼油的POV达到预期值时停止充气,放置在-20 ℃的冰箱中保存备用。
1.2 试验饲料
以鱼粉(粗蛋白质、粗脂肪和粗灰分含量分别为73.7%、7.9%、13.1%)、豆粕(粗蛋白质、粗脂肪和粗灰分含量分别为45.7%、2.6%、6.6%)、菜籽粕(粗蛋白质、粗脂肪和粗灰分含量分别为32.4%、3.5%、6.3%)和玉米蛋白粉(粗蛋白质、粗脂肪和粗灰分含量分别为62.0%、7.4%、2.0%)为主要蛋白质源,高筋面粉为主要糖源,豆油和鱼油为脂肪源,鱼油中新鲜鱼油∶氧化鱼油(质量比)分别为2.5∶0、1.5∶1.0和0.5∶2.0,配制3种试验饲料(FF、FO1、FO2)。在FF、FO1、FO2基础上分别添加0.48%L-精氨酸盐酸盐(纯度≥99%,购自宁波海德氨基酸工业有限公司),配制3种精氨酸饲料(FFA、FOA1、FOA2)。试验饲料组成及营养水平如表1所示。饲料原料经粉碎后过60目筛,按配方准确称取,各种饲料成分逐级混匀后,分别添加相应的油脂,用混合机混合,混合均匀后,加适量水在搅拌机中搅拌均匀,用SLX-80型双螺杆挤压机(华南理工大学科技实业总厂生产)制成直径为1.5 mm条状,再由G-500型造粒机(华南理工大学科技实业总厂生产)制成颗粒饲料,55 ℃烘干,自然冷却后放入密封袋中,置于-20 ℃冰箱中保存备用。
采用出口动植物油脂POV检测方法(SN/T 0801.3—2011)测定6种饲料FF、FO1、FO2、FFA、FOA1、FOA2的POV,其结果分别为12.70、14.09、33.70、12.15、14.06、34.00 meq/kg。
1.3 试验鱼与饲养管理
试验用黄颡鱼幼鱼购自广东省清远市黄沙渔业基地。试验开始前将黄颡鱼在室外水泥池中暂养2周,期间投喂商品饲料,每天2次。养殖试验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖系统中进行,系统由直径80 cm、高70 cm的圆柱形玻璃纤维桶组成,容水量约为300 L。试验开始时,选取初始体均重为(4.41±0.05) g的黄颡鱼幼鱼600尾,随机分为6组,每组4个重复,每个重复25尾鱼,分别投喂6种试验饲料,标记为FF、FO1、FO2、FFA、FOA1和FOA2组。试验期间每天08:30和18:30各投喂1次,投喂量为体重的5%~6%,采用表观饱食投喂。养殖系统采取循环水过滤,养殖用水为曝气的自来水,进水速率为1.5 L/min,定时换水。试验期间自然光源,水温29.5~33.0 ℃,氨氮浓度<0.20 mg/L,亚硝酸盐浓度<0.01 mg/L,溶氧浓度>6.0 mg/L,pH 7.4~7.9。养殖试验为期56 d。

表1 试验饲料组成及营养水平(风干基础)
1)每千克维生素预混料含有One kilogram of vitamin premix contained the following: VA 3 200 000 IU,VB14 g,VB28 g,VB64.8 g,VB1216 mg,VD31 600 000 IU,VE 16 g,VK 4 g,泛酸钙 calcium pantothenate 16 g,叶酸 folic acid 1.28 g,烟酸 nicotinic acid 28 g,肌醇 inositol 40 g,生物素 biotin 64 mg。
2)每千克矿物质预混料含有One kilogram of mineral premix contained the following: MgSO4·H2O 12 g,Ca(IO3)29 g,KCl 36 g,Met-Cu 1.5 g,ZnSO4·H2O 10 g,FeSO4·H2O 1 g,Met-Co 250 mg,NaSeO30.003 6 g。
3)营养水平为实测值。Nutrient levels were measured values.
1.4 样品采集
养殖试验结束后停食24 h,然后记录每桶鱼的总尾数,并称量每桶鱼的总重。从每个重复随机选取18尾鱼,放入120 mg/L的MS-222溶液中麻醉。其中3尾置于-20 ℃保存,用于测定全鱼常规营养成分;5尾测定体重、体长、内脏重、肝脏重和肠道重,用于计算生长性能指标和形态学指标;10尾用于尾静脉取血,室温静置4 h,4 000 r/min离心10 min制备血清,取上清液分装,置于-80 ℃冰箱保存,用于测定血清生化指标和抗氧化指标。
肝脏上清液的制备:称取一定质量的肝脏样品,加9倍体积的0.86%预冷生理盐水,在冰水浴中进行匀浆,3 000 r/min离心10 min,取上清液,于-20 ℃冰箱保存,用于测定肝脏抗氧化指标。
1.5 指标测定及分析
1.5.1 生长性能和形态学指标计算
存活率 survival rate,SR(%)=100×
终末尾数/初始尾数;
增重率(weight gain rate,WGR,%)=100×
[终末体重(g)-初始体重(g)]/初始体重(g);
特定生长率(specific growth rate,SGR,%/d)=
100×[ln终末体重(g)-ln初始体重(g)]/
饲养天数(d);
饲料系数(feed conversion ratio,FCR)=
投饲总量(g)/[终末体重(g)-初始体重(g)];
摄食率(feeding rate,FR,%)=100×
饲料总摄入干物质量(g)/{饲养天数(d)×
[终末均重(g)+初始均重(g)]/2};
蛋白质沉积率(protein deposition rate,PDR,%)=
100×[终末体重(g)×终末鱼体蛋白质含量(%)-
初始体重(g)×初始鱼体粗蛋白质含量(%)]/
[饲料摄入量(g)×饲料粗蛋白质含量(%)];
肥满度(condition factor,CF,g/cm3)=
100×体重(g)/体长(cm)3;
脏体比(viscerosomatic index,VSI,%)=
100×内脏重(g)/体重(g);
肝体比(hepatosomatic index,HSI,%)=
100×肝脏重(g)/体重(g);
肠体比(intestinesomatic index,ISI,%)=
100×肠道重(g)/体重(g)。
1.5.2 饲料及全鱼常规营养成分含量分析
水分含量采用105 ℃烘箱烘干至恒重的方法(GB/T 6435—1986)测定,粗蛋白质含量利用半自动凯氏定氮仪采用凯氏定氮法(GB/T 6432—1994)测定,粗脂肪含量采用乙醚抽提的方法(GB/T 6433—1994)测定,粗灰分含量采用550 ℃灼烧至恒重的方法(GB/T 6438—1992)测定。
1.5.3 血清生化指标分析
血清白蛋白、球蛋白、甘油三酯、胆固醇、葡萄糖、尿素氮含量和谷草转氨酶、谷丙转氨酶、乳酸脱氢酶活性由广州金域医学检验中心采用日立7600全自动生化分析仪测定。
1.5.4 抗氧化指标分析
血清和肝脏上清液用试剂盒进行抗氧化指标测定,试剂盒均购自南京建成生物工程研究所,具体测定方法参照试剂盒所附说明书。超氧化物歧化酶(SOD)活性采用羟胺法测定,谷胱甘肽过氧化物酶(GSH-Px)活性采用比色法测定,过氧化氢酶(CAT)活性采用可见光法测定,总抗氧化能力(T-AOC)采用比色法测定,丙二醛(MDA)含量采用2-硫代巴比妥酸(TBA)法测定。
1.6 数据统计
试验数据用平均值±标准差(mean±SD,n=4)表示,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),利用Duncan氏法分析比较各组之间的数据,当P<0.05时,组间差异显著。采用SAS 9.0软件进行双因素方差分析(two-way ANOVA),差异显著性水平为P<0.05。
2 结 果
2.1 生长性能和形态学指标
由表2可知,各组黄颡鱼的存活率均为100.00%,未出现死亡情况。在FF、FO1、FO2组中,随着氧化鱼油添加量的增加,黄颡鱼的增重率、特定生长率和蛋白质沉积率均逐渐下降,且均在FO2组有最低值,与其他2组差异达到显著水平(P<0.05);饲料系数和摄食率呈现相反变化,且在FO2组有最高值,与其他2组显著达显著水平(P<0.05)。在FFA、FOA1、FOA2组中,黄颡鱼的增重率、特定生长率、蛋白质沉积率、饲料系数和摄食率没有显著性差异(P>0.05)。FOA1、FOA2组黄颡鱼的增重率与FO1、FO2相比分别升高3.0%和9.9%,饲料系数分别降低2.7%和7.4%,但差异未达显著水平(P>0.05)。经双因素方差分析,氧化鱼油对黄颡鱼增重率和摄食率的影响达到显著水平(P<0.05),氧化鱼油和精氨酸对黄颡鱼特定生长率、蛋白质沉积率、饲料系数的影响存在交互作用(P<0.05)。
由表3可知,6组黄颡鱼的肥满度没有显著差异(P>0.05)。FO2组脏体比显著低于FOA1组(P<0.05),其他组间差异不显著(P>0.05)。FF组肝体比显著高于FO1组(P<0.05),其他组间差异不显著(P>0.05)。FO2组肠体比与FFA和FOA2组相比显著降低(P<0.05)。经双因素方差分析,精氨酸对黄颡鱼肠体比的影响达到极显著水平(P<0.01),氧化鱼油和精氨酸对肝体比的影响存在交互作用(P<0.05)。
2.2 全鱼常规营养成分含量
由表4可知,6组黄颡鱼全鱼干物质、粗蛋白质和粗灰分含量无显著差异(P>0.05),但FOA1组粗脂肪含量比FO1组显著降低(P<0.05)。经双因素方差分析,精氨酸对全鱼粗脂肪含量的影响达到显著水平(P<0.05)。
2.3 血清生化指标
由表5可知,6组黄颡鱼血清白蛋白、球蛋白、甘油三酯、胆固醇、尿素氮、葡萄糖含量和谷草转氨酶、谷丙转氨酶、乳酸脱氢酶活性均无显著差异(P>0.05)。
表2 氧化鱼油和精氨酸对黄颡鱼生长性能的影响
Table 2 Influences of oxidized fish oil and Arg on growth performance of yellow catfish (Pelteobagrusfulvidraco)
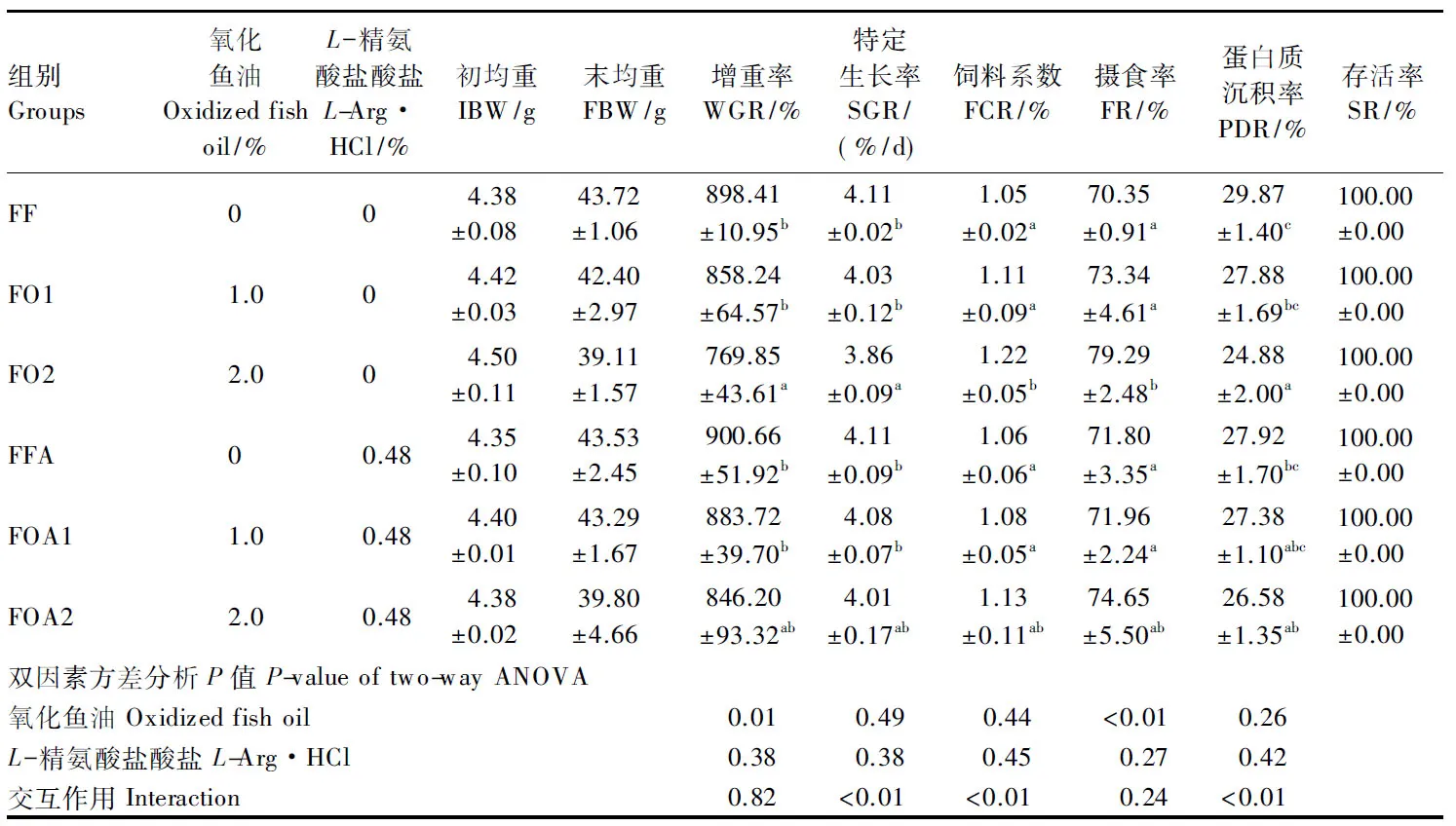
组别Groups氧化鱼油Oxidizedfishoil/%L-精氨酸盐酸盐L-Arg·HCl/%初均重IBW/g末均重FBW/g增重率WGR/%特定生长率SGR/(%/d)饲料系数FCR/%摄食率FR/%蛋白质沉积率PDR/%存活率SR/%FF004.38±0.0843.72±1.06898.41±10.95b4.11±0.02b1.05±0.02a70.35±0.91a29.87±1.40c100.00±0.00FO11.004.42±0.0342.40±2.97858.24±64.57b4.03±0.12b1.11±0.09a73.34±4.61a27.88±1.69bc100.00±0.00FO22.004.50±0.1139.11±1.57769.85±43.61a3.86±0.09a1.22±0.05b79.29±2.48b24.88±2.00a100.00±0.00FFA00.484.35±0.1043.53±2.45900.66±51.92b4.11±0.09b1.06±0.06a71.80±3.35a27.92±1.70bc100.00±0.00FOA11.00.484.40±0.0143.29±1.67883.72±39.70b4.08±0.07b1.08±0.05a71.96±2.24a27.38±1.10abc100.00±0.00FOA22.00.484.38±0.0239.80±4.66846.20±93.32ab4.01±0.17ab1.13±0.11ab74.65±5.50ab26.58±1.35ab100.00±0.00双因素方差分析P值P-valueoftwo-wayANOVA氧化鱼油Oxidizedfishoil0.010.490.44<0.010.26L-精氨酸盐酸盐L-Arg·HCl0.380.380.450.270.42交互作用Interaction0.82<0.01<0.010.24<0.01
同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同(表5除外)。
In the same line, values with no or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below (except Table 5).
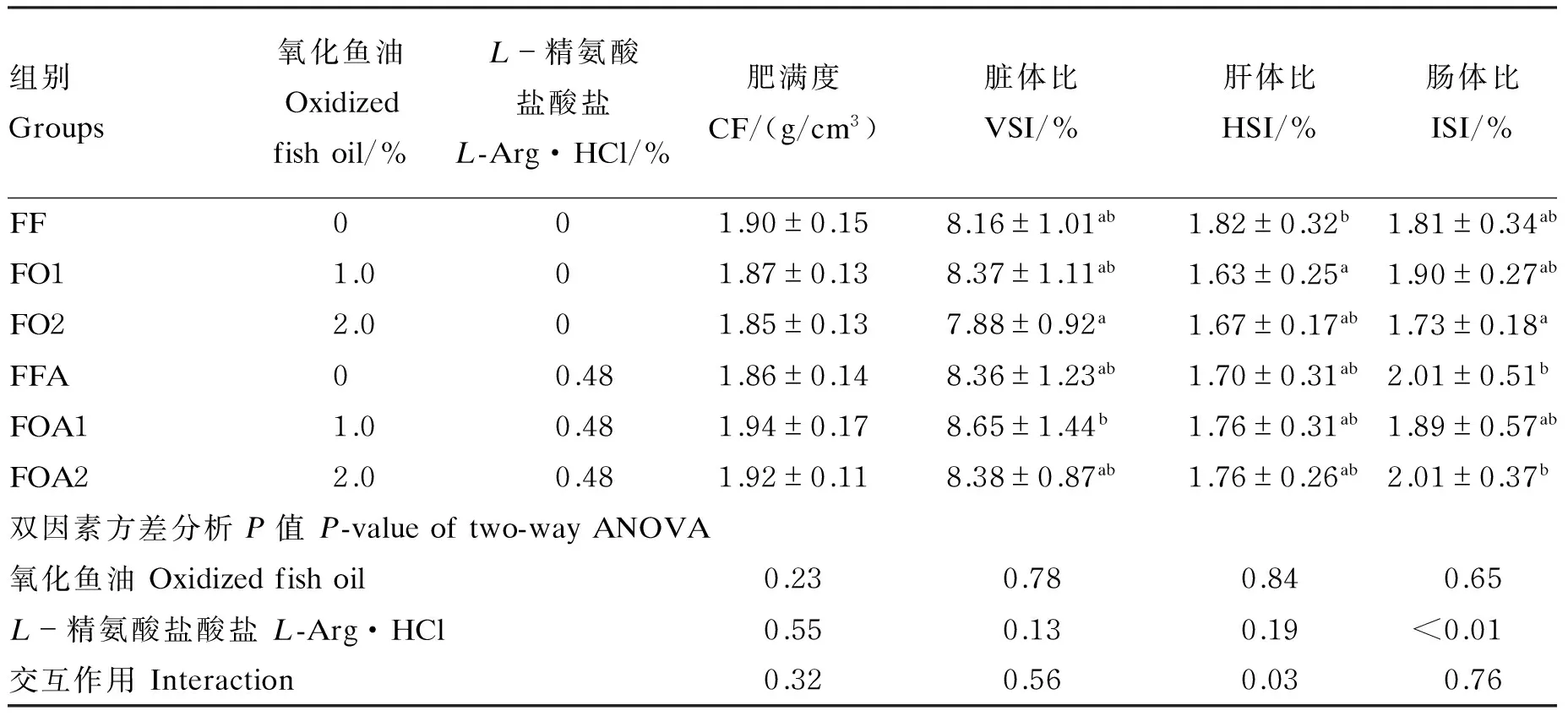
表3 氧化鱼油和精氨酸对黄颡鱼形态学指标的影响
2.4 血清和肝脏抗氧化指标
由表6可知,在FF、FO1、FO2组中,随氧化鱼油添加量的增加,黄颡鱼血清SOD活性呈现下降趋势,GSH-Px活性和MDA含量呈现上升趋势,但均无显著差异(P>0.05);血清T-AOC逐渐降低,FO2组显著低于FF组(P<0.05)。在含氧化鱼油饲料中添加精氨酸后,血清T-AOC分别升高77.0%(FOA1组vs.FO1组)和137.4%(FOA2组vs.FO2组),且后者达到显著水平(P<0.05);血清MDA含量分别降低12.0%(FOA1组vs.FO1组)和17.4%(FOA2组vs.FO2组)。双因素方差分析结果显示,氧化鱼油和精氨酸对血清T-AOC的影响存在交互作用(P<0.05),氧化鱼油对血清MDA含量的影响达到显著水平(P<0.05)。
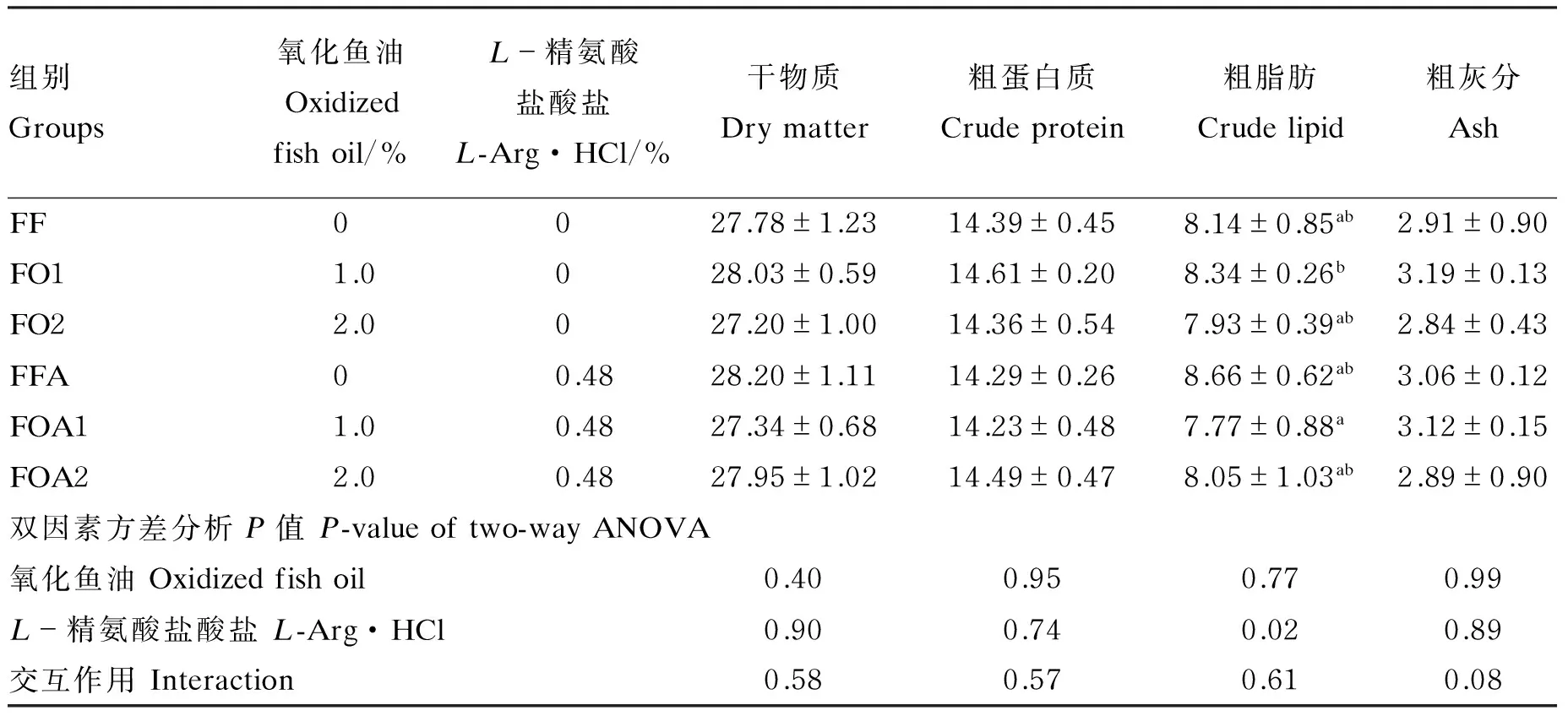
表4 氧化鱼油和精氨酸对黄颡鱼全鱼常规营养成分含量的影响(干物质基础)Table 4 Influences of oxidized fish oil and Arg on whole body unconventional nutritional contents of yellow catfish (Pelteobagrus fulvidraco) (DM basis) %
表5 氧化鱼油和精氨酸对黄颡鱼血清生化指标的影响
Table 5 Influences of oxidized fish oil and Arg on serum biochemical indexes of yellow catfish (Pelteobagrusfulvidraco)

项目Items组别GroupsFFFO1FO2FFAFOA1FOA2白蛋白ALB/(g/L)8.90±0.589.37±0.728.95±0.728.85±0.549.00±0.689.16±0.49球蛋白GLB/(g/L)23.10±2.4325.72±1.9023.58±1.1923.07±0.80523.30±2.0423.63±1.50甘油三酯TG/(mmol/L)5.75±0.706.88±1.056.04±1.125.73±1.156.45±1.046.02±1.70胆固醇CHO/(mmol/L)3.78±0.454.22±0.224.10±0.343.69±0.233.91±0.534.02±0.39谷草转氨酶GOT/(U/L)191.25±18.82189.00±15.64213.25±18.95184.50±22.12188.00±23.54193.67±4.04谷丙转氨酶GPT/(U/L)6.00±1.297.00±2.166.50±2.166.00±0.816.50±2.006.33±1.53尿素氮UN/(mmol/L)0.80±0.220.87±0.350.85±0.130.80±0.140.78±0.080.70±0.17乳酸脱氢酶LDH/(U/L)761.25±99.54799.50±218.66897.00±291.01760.75±103.50766.25±258.12773.67±97.65葡萄糖GLU/(mmol/L)10.55±2.7510.07±3.127.68±0.6410.18±0.479.97±1.059.86±1.77
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
In the same row, values with no or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05).
由表7可知,6组黄颡鱼肝脏SOD、CAT活性,T-AOC和MDA含量均无显著差异(P>0.05),但在FF、FO1、FO2组中,随氧化鱼油添加量的增加,肝脏SOD活性和MDA含量呈现上升趋势。FO2、FOA1组肝脏GSH-Px活性显著高于FF、FO1和FOA2组(P<0.05)。
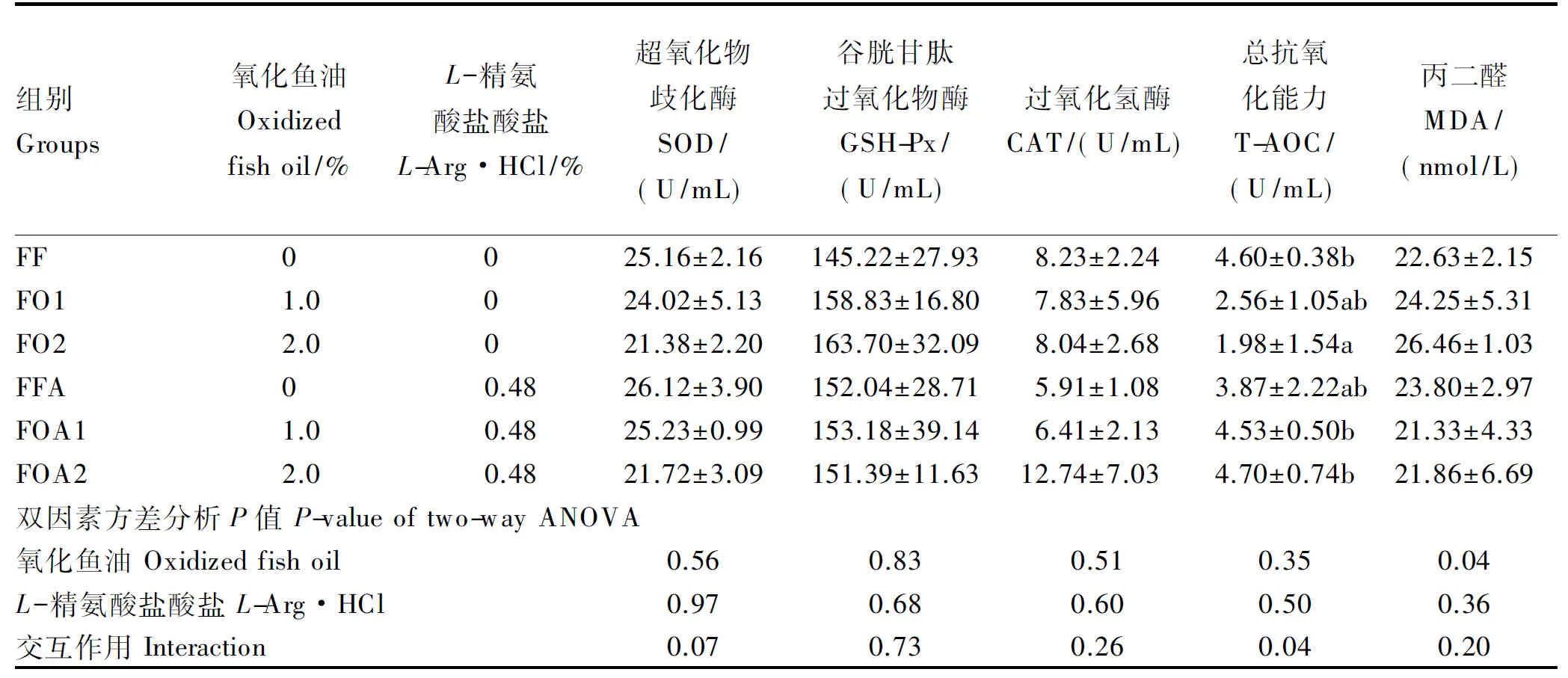
表6 氧化鱼油和精氨酸对黄颡鱼血清抗氧化指标的影响
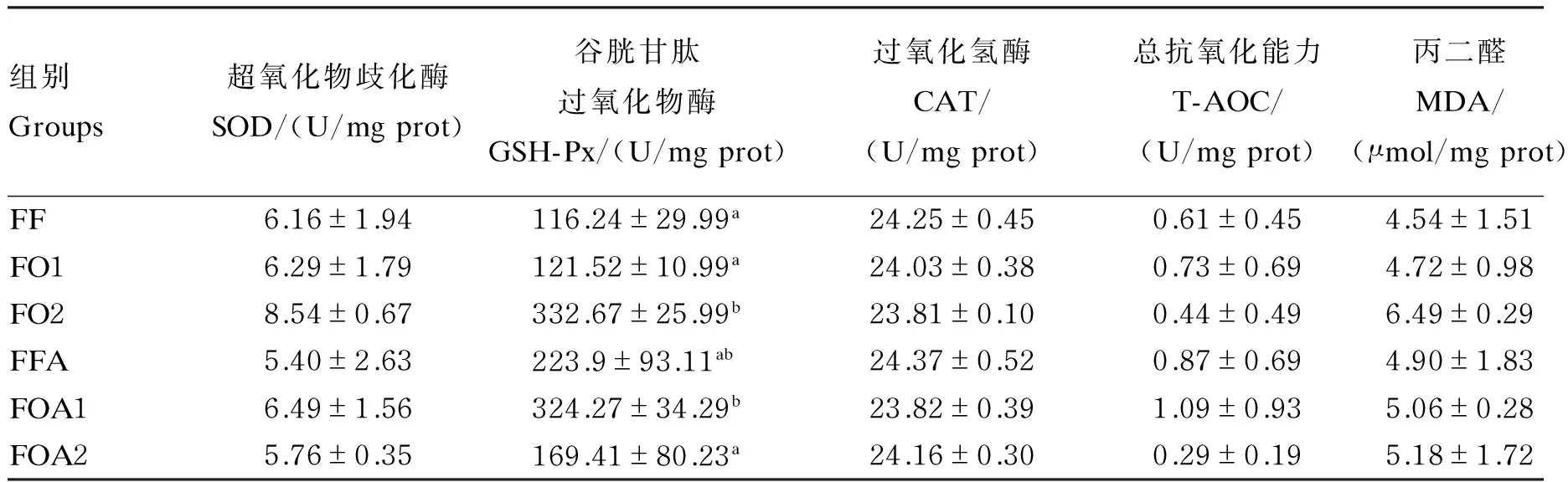
表7 氧化鱼油和精氨酸对黄颡鱼肝脏抗氧化指标的影响
3 讨 论
3.1 氧化鱼油对黄颡鱼生长性能的影响及精氨酸的干预作用

3.2 氧化鱼油对黄颡鱼全鱼常规营养成分含量的影响及精氨酸的干预作用
本试验结果显示,随着饲料中氧化鱼油添加量的增加,黄颡鱼全鱼干物质、粗蛋白质、粗脂肪和粗灰分含量均呈现先上升后下降的趋势,但差异均未达到显著水平,但精氨酸对黄颡鱼全鱼粗脂肪含量具有显著影响。任泽林等[28]研究表明,在氧化产物剂量偏低时,鲤鱼机体通过增加全鱼粗脂肪含量来消弱其氧化稳定性;当氧化产物剂量过高时,全鱼粗脂肪含量下降的原因可能是肝脏等组织器官的脂肪酸合成代谢能力下降所致。本试验中,在氧化鱼油饲料中添加适量精氨酸,可能通过改变黄颡鱼全鱼粗脂肪含量来影响机体的氧化稳定性,其原因可能是精氨酸刺激某些酶类的分泌,从而调控脂肪酸合成和分解代谢途径。
3.3 氧化鱼油对黄颡鱼血清和肝脏抗氧化指标的影响及精氨酸的干预作用
SOD、GSH-Px是生物体抗氧化防御系统重要的物质,可清除体内活性氧自由基,保护细胞膜及细胞内的核酸[31]。本试验结果显示,随着饲料中氧化鱼油添加量的增加,黄颡鱼血清SOD活性呈现下降趋势。该结果与唐筱等[32]及王珺[33]在大黄鱼(PseudosciaenacroceaR.)上的研究结果一致,但与Mourente等[34]在金头鲷(SparusaurataL.)上的研究结果相反。其原因可能是不同鱼种对氧化油脂的耐受度有所不同。本试验结果显示,随着饲料中氧化鱼油添加量的增加,黄颡鱼血清GSH-Px活性呈现上升趋势。该结果与黄凯等[29]在奥尼罗非鱼上的研究结果相一致。其原因可能是氧化鱼油摄入体内后,会提高细胞中氧自由基等生物活性物质的含量,增加抗氧化酶反应底物浓度,进而提高GSH-Px活性。但是当氧化产物含量积累过高时,鱼体内的抗氧化相关酶类的平衡被打破,进而对机体造成毒副作用。T-AOC是用于衡量机体抗氧化系统功能的综合指标,其大小可以反映机体对外来刺激的代偿能力和机体自由基代谢的状态[31]。本试验结果显示,饲料中添加氧化鱼油可降低黄颡鱼血清T-AOC,并在FO2组达到显著水平,说明随着饲料中氧化物质含量的升高,黄颡鱼对外源氧化产物刺激的代偿能力和对机体自由基清除能力逐渐减弱。但在含氧化鱼油饲料中添加适量精氨酸后,黄颡鱼血清T-AOC分别升高77.0%(FOA1组vs.FO1组)和137.4%(FOA2组vs.FO2组)。这说明氧化鱼油饲料中添加适量精氨酸可提高黄颡鱼血清的抗氧化能力,从而缓解黄颡鱼对外源氧化产物刺激所造成的机体抗氧化能力下降。这与精氨酸减缓氧化鱼油对黄颡鱼生长性能的抑制效果相一致。MDA含量常常反映机体内脂质过氧化的程度,间接反映细胞受损伤程度[35-36]。本试验中,随着饲料中氧化鱼油添加量的增加,血清MDA含量呈现上升趋势。经双因素方差分析可知,氧化鱼油对黄颡鱼血清MDA含量的影响达到显著水平,该结果与彭士明等[31]在黑鲷上的研究结果一致,说明随着氧化产物的积累,黄颡鱼机体内脂质过氧化物质的积累量增多,原因可能是体内细胞膜受到损伤,失去选择透过性功能,导致细胞内液外流。该现象间接表明机体内细胞的损伤程度进一步加深。在含氧化鱼油饲料中添加适量精氨酸后,血清MDA含量分别降低12.0%(FOA1组vs.FO1组)和17.4%(FOA2组vs.FO2组)。这可能在于精氨酸通过减少机体内细胞的损伤,或是促进体内细胞增殖,从而替换受损细胞来改善氧化鱼油对机体细胞造成的毒副作用。
在黄颡鱼肝脏中,随着饲料中氧化鱼油添加量的增加,SOD、GSH-Px活性和MDA含量呈现上升趋势。该结果与黄凯等[29]在奥尼罗非鱼和韩雨哲等[16]在花鲈上的研究结果相一致。然而,任泽林等[37]报道,氧化鱼油会降低鲤鱼肝胰脏中SOD和CAT活性;陈拥军[20]则报道,氧化鱼油会降低黑鲈肝胰脏中GSH-Px活性。之所以会出现不同的结果,可能是因为饲料营养成分、养殖条件、试验周期和鱼油氧化程度不同及不同水产动物对油脂耐受能力不同所致。在本试验中,饲料中添加适量精氨酸后,黄颡鱼肝脏GSH-Px活性呈现先上升后下降趋势,但肝脏T-AOC没有出现与在血清中的相似变化规律,其原因和机理有待于进一步研究。
4 结 论
在饲料中添加一定量的氧化鱼油会抑制黄颡鱼的生长并降低血清的抗氧化能力,但添加一定量的精氨酸可以缓解氧化鱼油对黄颡鱼生长的抑制作用,并增强其机体的抗氧化能力。
[1] 张红娟,刘玉梅,刘海燕,等.油脂氧化对水产动物的危害及其预防对策[J].饲料研究,2013(7):68-71.
[2] 罗智,刘永坚,麦康森,等.鱼类精氨酸需求研究进展(英文)[J].水产学报,2004,28(4):450-459.
[3] 万军利,麦康森,艾庆辉.鱼类精氨酸营养生理研究进展[J].中国水产科学,2006,13(4):679-685.
[4] 王连生,徐奇友.鱼类精氨酸营养研究进展[J].东北农业大学学报,2014,45(9):123-128.
[5] ZHOU Q C,ZENG W P,WANG H L,et al.Dietary arginine requirement of juvenile yellow grouperEpinephelusawoara[J].Aquaculture,2012,350/351/352/353:175-182.
[6] POHLENZ C,BUENTELLO A,HELLAND S J,et al.Effects of dietary arginine supplementation on growth,protein optimization and innate immune response of channel catfishIctaluruspunctatus(Rafinesque 1818)[J].Aquaculture Research,2014,45(3):491-500.
[7] LIU Y,CHI L,FENG L,et al.Effects of graded levels of dietary vitamin C on on growth,digestive capacity and intestinal microflora of juvenile Jian carp (Cyprinuscarpiovar.Jian)[J].Aquaculture Research,2011,42(4):534-548.
[8] ZHOU Q C,JIN M,ELMADA Z C,et al.Growth,immune response and resistance to Aeromonas hydrophila of juvenile yellow catfish,Pelteobagrusfulvidraco,fed diets with different arginine levels[J].Aquaculture,2015,437:84-91.
[9] CHENG Z Y,GATLIN Ⅲ D M,BUENTELLO A.Dietary supplementation of arginine and/or glutamine influences growth performance,immune responses and intestinal morphology of hybrid striped bass (Moronechrysops×Moronesaxatilis)[J].Aquaculture,2012,362/363:39-43.
[10] CHEN Q M,ZHAO H X,HUANG Y H,et al.Effects of dietary arginine levels on growth performance,body composition,serum biochemical indices and resistance ability against ammonia-nitrogen stress in juvenile yellow catfish (Pelteobagrusfulvidraco)[J].Animal Nutrition,2016,2(3):204-210.
[11] 殷永风,叶元土,蔡春芳,等.在自制氧化装置中氧化时间对豆油氧化指标的影响[J].安徽农业科学,2011,39(7):4052-4054,4057.
[12] 袁奕彬.饲料用鱼油的质量指标与快速鉴定[J].广东饲料,2009,18(2):32-33.
[13] 赵新淮,张娜,王琳.油脂过氧化值的碘量测定法比较研究[J].中国油脂,2003,28(4):60-62.
[14] 刘伟,张桂兰,陈海燕.饲料添加氧化油脂对鲤体内脂质过氧化及血液指标的影响[J].中国水产科学,1997,4(1):94-96.
[15] 彭士明,陈立侨,叶金云,等.饲料中添加氧化鱼油对黑鲷幼鱼生长的影响[J].水产学报,2007,31(增刊):109-115.
[16] 韩雨哲,姜志强,任同军,等.氧化鱼油与棕榈油对花鲈肝脏抗氧化酶及组织结构的影响[J].中国水产科学,2010,17(4):798-806.
[17] 陈科全,叶元土,蔡春芳,等.饲料中氧化鱼油对草鱼生长及肌肉脂肪酸组成的影响[J].动物营养学报,2015,27(6):1698-1708.
[18] 薛继鹏.三聚氰胺、氧化鱼油和脂肪对瓦氏黄颡鱼生长和体色的影响[D].博士学位论文.青岛:中国海洋大学,2011.
[19] 高淳仁,雷霁霖.饲料中氧化鱼油对真鲷幼鱼生长、存活及脂肪酸组成的影响[J].上海水产大学学报,1999,8(2):124-130.
[20] 陈拥军.鱼油氧化对大口黑鲈幼鱼健康的危害及其控制[D].博士学位论文.广州:中山大学,2014.
[21] REN M C,AI Q H,MAI K S.Dietary arginine requirement of juvenile cobia (Rachycentroncanadum)[J].Aquaculture Research,2014,45(2):225-233.
[22] POHLENZ C,BUENTELLO A,CRISCITIELLO M F,et al.Synergies between vaccination and dietary arginine and glutamine supplementation improve the immune response of channel catfish againstEdwardsiellaictaluri[J].Fish & Shellfish Immunology,2012,33(3):543-551.
[23] CLOSS E I,SIMON A,VÉKONY N,et al.Plasma membrane transporters for arginine[J].The Journal of Nutrition,2004,134(10):2752S-2759S.
[24] NIEVES C,Jr,LANGKAMP-HENKEN B.Arginine and immunity:a unique perspective[J].Biomedicine & Pharmacotherapy,2002,56(10):471-482.
[25] ZEHRA S,KHAN M A.Dietary arginine requirement of fingerling Indian major carp,Catlacatla(Hamilton)[J].Journal of the World Aquaculture Society,2013,44(3):363-373.
[26] ZHOU F,ZHOU J,SHAO Q,et al.Effects of arginine-deficient and replete diets on growth performance,digestive enzyme activities and genes expression of black sea bream,Acanthopagrusschlegelii,juveniles[J].Journal of the World Aquaculture Society,2012,43(6):828-839.
[27] 封福鲜.精氨酸、赖氨酸和苏氨酸对瓦氏黄颡鱼幼鱼生长、代谢及免疫力的影响[D].硕士学位论文.青岛:中国海洋大学,2011.
[28] 任泽林,霍启光,曾虹,等.氧化鱼油对鲤鱼生产性能和肌肉组织结构的影响[J].动物营养学报,2001,13(1):59-64.
[29] 黄凯,阮栋俭,战歌,等.氧化油脂对奥尼罗非鱼生长和抗氧化性能的影响[J].淡水渔业,2006,36(6):21-24.
[30] 苗新,曹娟娟,徐玮,等.核苷酸对大黄鱼生长性能、肠道形态和抗氧化能力的影响[J].水产学报,2014,38(8):1140-1148.
[31] 彭士明,陈立侨,侯俊利,等.氧化鱼油饲料中添加VE对黑鲷幼鱼体脂含量及肝脏抗氧化酶活性的影响[J].上海水产大学学报,2008,17(3):298-304.
[32] 唐筱,王珺,徐后国,等.氧化鱼油和维生素E对大黄鱼SOD和CAT酶活性的影响[J].中国海洋大学学报,2010,40(S1):55-58,64.
[33] 王珺.乙氧基喹啉、氧化鱼油和烟酸铬对大黄鱼与鲈鱼生长性能的影响及其在鱼体组织中残留的研究[J].博士学位论文.青岛:中国海洋大学,2010.
[34] MOURENTE G,DAZ-SALVAGO E,BELL J G,et al.Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (SparusaurataL.) fed dietary oxidised oil:attenuation by dietary vitamin E[J].Aquaculture,2002,214(1/2/3/4):343-361.
[35] KONG X F,WU G Y,LIAO Y P,et al.Effects of Chinese herbal ultra-fine powder as a dietary additive on growth performance,serum metabolites and intestinal health in early-weaned piglets[J].Livestock Science,2007,108(1/2/3):272-275.
[36] 白东清,吴旋,郭永军,等.长期投喂黄芪多糖对黄颡鱼抗氧化及非特异性免疫指标的影响[J].动物营养学报,2011,23(9):1622-1630.
[37] 任泽林,曾虹,霍启光,等.氧化鱼油对鲤肝胰脏抗氧化机能及其组织结构的影响[J].大连水产学院学报,2000,15(4):235-243.
*Corresponding author, professor, E-mail: junmcao@163.com
(责任编辑 菅景颖)
Influences of Oxidized Fish Oil on Growth Performance and Antioxidant Indexes of Yellow Catfish (Pelteobagrus fulvidraco) and the Use of Arginine as an Intervention Measure
ZHUO Lixin1,2,3,4ZHAO Hongxia2,3,4HUANG Yanhua2,3,4CAO Junming2,3,4*WANG Guoxia2,3,4CHEN Bing2,3,4SUN Yuping2,3,4
(1.CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China; 2.InstituteofAnimalScience,GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China; 3.GuangdongPublicLaboratoryofAnimalBreedingandNutrition,Guangzhou510640,China; 4.GuangdongKeyLaboratoryofAnimalBreedingandNutrition,Guangzhou510640,China)
This experiment was conducted to investigate the influences of dietary oxidized fish oil (OF) on the growth performance, body composition, serum biochemical indexes and serum, liver antioxidant indexes of juvenile yellow catfish (Pelteobagrusfulvidraco), and the intervention of arginine (Arg) on them. A total of 600 healthy juvenile yellow catfish with an initial body weight of (4.41±0.05) g were randomly divided into 6 groups with 4 replicates of 25 fish. During 56 d feeding trial, the fish were fed six diets containing 2.5% fresh fish oil (FF group), 1.5% fresh fish oil+1.0% oxidized fish oil (FO1 group), 0.5% fresh fish oil+2.0% oxidized fish oil (FO2 group), 2.5% fresh fish oil+0.48%L-arginine hydrochloride (FFA group), 1.5% fresh fish oil+1.0% oxidized fish oil+0.48%L-arginine hydrochloride (FOA1 group), 0.5% fresh fish oil+2.0% oxidized fish oil+0.48%L-arginine hydrochloride (FOA2 group), respectively. The results showed that among FF, FO1 and FO2 groups, the weight gain rate, specific growth rate and protein deposition rate of yellow catfish showed a downward trend, but feed conversion ratio and feeding rate were reversed. All of them reached the extreme value in the FO2 group, and the difference reached a significant level compared with FF and FO1 groups (P<0.05). While addition of Arg to the oxidized fish oil diets, no significant differences were found in above indexes among FFA, FOA1 and FOA2 groups (P>0.05), but the weight gain rate was increased by 3.0% (FOA1 group vs. FO1 group) and 9.9% (FOA2 group vs. FO2 group), respectively. Two-factor variance analysis results showed that oxidized fish oil had significant influences on weight gain rate and feeding rate (P<0.05), and oxidized fish oil and Arg had significant interactions on specific growth rate, protein deposition rate and feed conversion ratio (P<0.05). The hepatosomatic index in FO1 group was significantly lower than that in FF group (P<0.05), and the intestinesomatic index in FO2 group was significantly decreased compared with FFA and FOA2 groups (P<0.05). Oxidized fish oil and Arg had a significant interaction on hepatosomatic index (P<0.05). The crude lipid content of whole body in FOA1 group was significantly lower than that in FO1 group (P<0.05). Among FF, FO1 and FO2 groups, the serum total antioxidant capacity (T-AOC) showed a downward trend with oxidized fish oil addition increasing, and showed a significant difference between FF and FO2 groups (P<0.05). While addition of Arg to the oxidized fish oil diets, the serum T-AOC was increased by 77.0% (FOA1 group vs. FO1 group) and 137.4% (FOA2 group vs. FO2 group), respectively, and the latter had a significant difference (P<0.05). Two-factor variance analysis results showed that oxidized fish oil had a significant influence on serum malondialdehyde (MDA) content (P<0.05), and oxidized fish oil and Arg had a significant interaction on serum T-AOC (P<0.05). The results indicate that a certain amount of oxidized fish oil addition can reduce the growth and serum antioxidant capacity of yellow catfish, but a certain amount of Arg addition can alleviate the inhibition induced by oxidized fish oil for growth, and enhance the body’s antioxidant capacity.[ChineseJournalofAnimalNutrition, 2017, 29(1):147-157]
yellow catfish; oxidized fish oil; arginine; growth performance; antioxidant indexes
10.3969/j.issn.1006-267x.2017.01.017
2016-07-12
国家自然科学基金项目(31402307);广东省水产饲料和饲料添加剂效价评估公共服务平台建设(2015A040404033)
卓丽欣(1988—),女,河北高碑店人,硕士研究生,从事水产动物营养与饲料的研究。E-mail: 1102267451@qq.com
*通信作者:曹俊明,研究员,博士生导师,E-mail: junmcao@163.com
S963
A
1006-267X(2017)01-0147-11
