番红花花芽分化期显微结构及核酸、可溶性蛋白质量分数的变化1)
2017-01-17张衡锋韦庆翠
张衡锋 韦庆翠
(江苏农牧科技职业学院,泰州,225300)
张焕朝
(南京林业大学)
番红花花芽分化期显微结构及核酸、可溶性蛋白质量分数的变化1)
张衡锋 韦庆翠
(江苏农牧科技职业学院,泰州,225300)
张焕朝
(南京林业大学)
运用扫描电镜技术观察番红花(CrocussativusL.)花芽不同分化期的形态变化,测定不同分化及发育期的核酸和可溶性蛋白质量分数,并分析了核酸与可溶性蛋白质量分数变化的相关性。结果表明:番红花花器官按照萼片—外轮花被—雄蕊—内轮花被—雌蕊的顺序分化,蝎尾状聚伞花序,从花芽分化开始到花器官功能形成共经历65 d左右;番红花花芽分化过程中,RNA质量分数和RNA质量分数/DNA质量分数先升高后降低,DAN、可溶性蛋白质量分数均呈现“升-降-升”的变化趋势,核酸与可溶性蛋白质量分数之间存在显著或极显著相关性。由此说明,番红花属于典型的ABC植物,核酸和蛋白质代谢共同调节番红花花芽的分化和发育,是营养生长过渡为生殖生长及花芽形态建成的生化基础。
番红花; 花芽分化; 显微结构; 核酸; 可溶性蛋白
Scanning electron microscope was applied to observe the formal change ofCrocussativusL. during its different flower bud differentiation stages, measure the contents of nuclein acid and soluble protein in differential growth periods, and study the co-relation between them. The differentiation sequence of its flower organ as follows: sepals outer tepals stamens inner tepals pistils, as for scorpioid cyme, it took about 65 d from the beginning of flower bud differentiation to the formation of floral organ. During the flower bud differentiation process, the contents of RNA/DNA and RNA were increased firstly, and then decreased, and those of DNA and soluble protein presented a “up-down-up” trend, and there was a significant or highly significant correlation between the contents of nucleic acid and soluble protein. Thus,C.sativusL was a typical ABC plant, and nucleic acid and protein metabolism commonly regulated the differentiation and development of flower bud, and was the biochemical basis of the transition from vegetative growth to reproductive growth and flower bud morphogenesis.
番红花(C.sativus)属鸢尾科番红花属多年生三倍体鳞茎类球根花卉,近年来,因其巨大药用开发潜力和较高的园林观赏价值,已成为植物学界的研究热点。番红花原产于伊朗、小亚细亚半岛和希腊等地[1],引种到中国后,由于对其开花规律不了解和对本土栽培技术研究不深入,与原产地相比,中国番红花生产上存在花数量少,种球退化,病害频发,花期过于集中等症结[2-6],而这些问题均与番红花的开花机制及营养代谢密切相关。本研究首次在里下河平原水网地区引种番红花,以花芽分化生理生化机制为切入点,通过电镜观察番红花花芽分化的形态变化过程,测定花芽分化及发育过程中核酸和可溶性蛋白质量分数的动态变化,揭示了番红花花芽分化的形态和生理变化规律,为中国番红花产业高效健康发展提供了理论依据。
1 材料与方法
1.1 试验材料
供试材料为2013年引种到泰州的番红花(CrocussativusL.)组培种球,种植于江苏农牧科技职业学院校内实训基地内(32°27′42″N,119°55′57″E)。泰州地区年降水量1 020.5 mm,全年最高、最低和平均温度分别为38.2、-7.2、14.9 ℃,全年光照时间1 746 h。2013年12月5日大田定植,正常水肥管理,2014年5月1日收获仔球并储藏于阴凉通风处备试。
1.2 试验设计
2014年7月10日挑选500枚生长完好,质量为(25±1)g的种球置于温度25 ℃、湿度75%、光照0 lx的培养箱中培养,当花芽长至7 cm左右时每7 d增加300 lx,21 d后达到最大值1 200 lx,在此光照强度下花朵全部开放。自2014年7月20日开始每3 d取样1次,在体视显微镜下解剖、观察,发现花芽分化后每天取样1次(以第一小花分化为准,样品大小为5 mm×5 mm×7 mm),并立即将花芽置于FAA固定液(V(福尔马林)∶V(冰醋酸)∶V(乙醇)=5∶5∶90)中固定保存,直至花芽分化完成,以备电镜观察、拍照。同时,根据花芽分化及发育各时期不同形态特征,将整个分化及发育过程分为6个关键阶段:营养生长期(VP)、花序原基和小花原基分化期(FP)、雄蕊原基分化期(SP)、雌蕊原基分化期(PP)、花芽发育期(DP)和盛花期(MP),并分别取样。分别挑选15枚正常的球茎,剥去鳞片,洗净、吸干,对花芽进行取样、称量(图1),重复3次,将称好的样品立即液氮冷冻处理,并于冰箱中-76 ℃超低温保存,以备生理生化指标的测定。
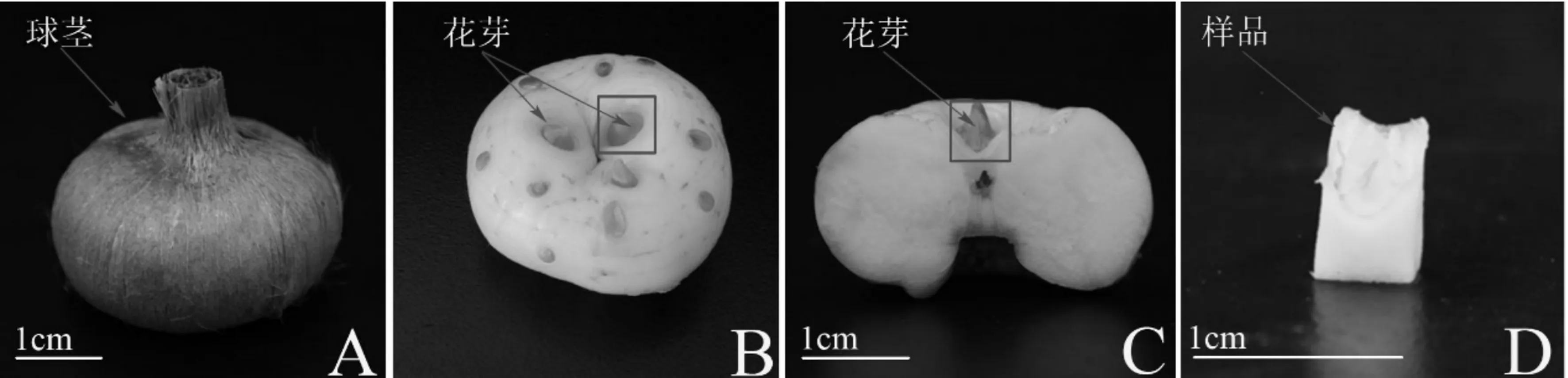
A.带鳞片球茎;B.无鳞片球茎;C.球茎横切面;D.取样样品;图中方框标注花芽取样区。
1.3 测定方法
扫描电镜观察、拍照参照李和平[7]和常钟阳等[8]的方法,并根据番红花花芽特性适当调整;核酸质量分数测定参照朱广廉等[9]的方法,总核酸质量分数采用紫外吸收法测定,DNA质量分数采用二苯胺法测定;可溶性蛋白质量分数测定参照李合生[10]的方法,采用考马斯亮蓝比色法进行测定。
1.4 数据分析
采用Excel2013进行数据处理和制表,并用DPS9.50软件进行统计分析和显著性检验(LSD法)。
2 结果与分析
2.1 花芽分化解剖结构观察
根据番红花花芽分化先后顺序和分化特征,将其整个分化过程划分为6个关键阶段。
营养生长期:生长点保持营养生长状态,生长点呈半球形,生长锥宽度大于高度。随着生长锥的生长和分化,叶原基开始形成,并包被生长锥。随着叶原基分化的深入,在生长锥基部陆续分化出螺旋状着生的幼叶(图2A),该阶段历时约30 d。
花序原基和小花原基分化期:7月下旬,植物茎端由营养生长向生殖生长转变。生长锥迅速伸长,长度可达2~3 mm,呈钝圆锥形,原先光滑的表面开始分化成许多球状的原基突起,这些突起即为花序原基;第一苞片(远轴)几乎与小花原基同时发生(图2B),随着分化的深入,第一苞片向上生长,并将大部分小花花序原基包裹;小花原基进一步分化出第二苞片(近轴),与第一苞片对生,基部始终被第一苞片包裹;第二苞片分化过程中,在第一小花原基下方分化出第二小花原基;一般花序原基只分化出2个小花原基,第三小花原基罕见(图2C),该阶段历时约10 d。
外轮花被原基分化期:小花原基表面出现3个突起,呈等边三角形分布,将小花原基三等分,这3个突起即为外轮花被原基。随着分化的深入,3个外轮花被原基逐渐分化出外轮花被,呈长三角形,内弯(图2D)。
雄蕊原基分化期:在外轮花被的内侧顺时针分化出3个突起,即雄蕊原基,亦呈三角形分布。随着分化的深入,雄蕊原基迅速伸出、加宽,顶面观呈圆形,在发育中后期,雄蕊呈现舌状,外侧面内陷,超出花被片的包裹,花药结构逐渐形成(图2,E-G)。
内轮花被原基分化期:雄蕊原基形成后,在两个外轮花被原基之间近轴处,顺时针分化出内轮花被原基,与外轮花被形成对生。随着分化的深入,逐渐长成与外轮花被一般大小(图2H)。外轮花被原基、雄蕊原基和内轮花被原基分化间隔极短,3个阶段前后历时3~5 d。
雌蕊原基分化期:在雄蕊原基内侧出现3枚雌蕊原基,亦呈等边三角形分布,当雄蕊呈现舌状状态时,雌蕊原基生长点出现3个突起,形态上呈现舌状结构,随着分化深入,雌蕊原基分化出3枚心皮原基,且具有心皮腹沟(图2I);3心皮顶端逐渐靠拢,腹缝线不断内卷、闭合形成子房;子房内部分化出胚珠;在子房顶端3心皮共同分化出花柱(图2J-K);花柱向上生长,顶端横向扩展,分化出3裂柱头(图2L)。雌蕊原基分化与内轮花被原基分化间隔期较长,从发现内轮花被原基到发现雌蕊原基历时20~25 d。
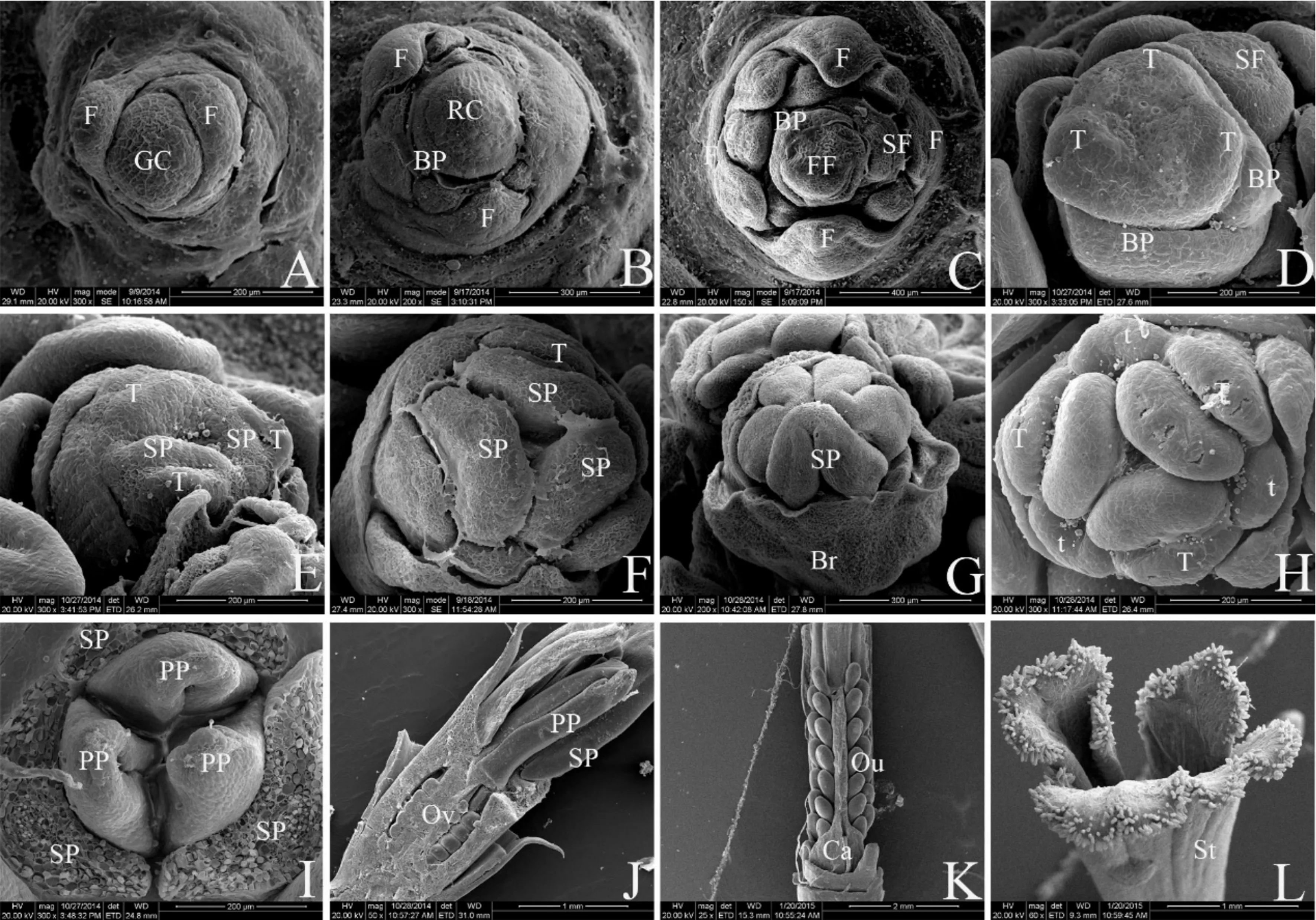
BP.苞片原基;Br.苞片;Ca.心皮;F.叶;FF.第一小花原基;GC.营养生长锥;Ov.子房;Ou.胚珠;PP.雌蕊原基;RC.生殖生长锥;SF.第二小花原基;SP.雄蕊原基;St.柱头;T.外轮花被原基;t.内轮花被原基。
图2 番红花花芽分化解剖结构观察
2.2 不同分化及发育期核酸、可溶性蛋白质量分数的变化
2.2.1 核酸质量分数的变化
按照细胞全能性理论,植物花芽在进行分化之前,分化的所有步骤已在花芽茎尖分生细胞中预先编入程序,分化的过程实际上就是成花基因阻遏不断解除的过程[11],所以,研究核酸质量分数的变化对番红花花芽分化至关重要(表1),在番红花花芽分化及发育过程中,花芽中核酸质量分数发生了极显著变化。RNA质量分数呈现出先升高后降低的变化趋势,在花芽发育期达到最高值1 875.14 μg·g-1,是营养生长期的4.58倍;DNA质量分数则呈现出升高-降低-升高的变化趋势。同样,花芽中RNA质量分数/DNA质量分数也发生了显著变化,也呈现出先升高后降低变化趋势,且各个时期RNA质量分数/DNA质量分数之间均存在极显著差异,最高值出现在雌蕊原基分化期。
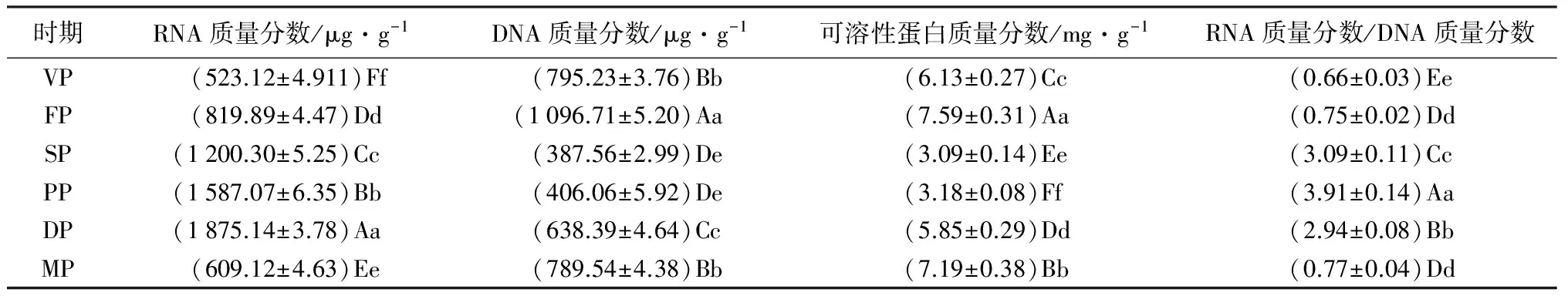
表1 不同发育阶段花芽中核酸、可溶性蛋白质量分数和RNA质量分数/DNA质量分数的变化
注:表中数据根据花芽鲜质量测得;同列不同小写字母表示在0.05水平上差异显著;同列不同大写字母表示在0.01水平上差异极显著。
2.2.2 可溶性蛋白质量分数的变化
可溶性蛋白包括结构蛋白和酶蛋白,在植物花芽分化过程中需求量较大,是花器官形态建成的主要物质基础之一[12]。花芽分化启动后,存储在鳞茎中的非可溶性蛋白经酶水解形成氨基酸,并输送到旺盛生长部位加以利用(表1),在番红花花芽分化及发育过程中,花芽中可溶性蛋白质量分数呈现出升高-降低-升高的变化趋势,且各时期间均存在极显著差异,最大值出现在花序及小花原基分化期,最小值出现在雄蕊分化期。
2.2.3 核酸与可溶性蛋白质量分数动态变化的相关性分析
通过相关性分析表明(表2),番红花花芽中RNA质量分数/DNA质量分数分别与RNA质量分数、DNA质量分数、可溶性蛋白质量分数之间存在显著负相关性;DNA质量分数与可溶性蛋白质量分数之间存在极显著正相关性。
表2 番红花花芽分化及发育过程中核酸与可溶性蛋白质量分数动态变化的相关分析
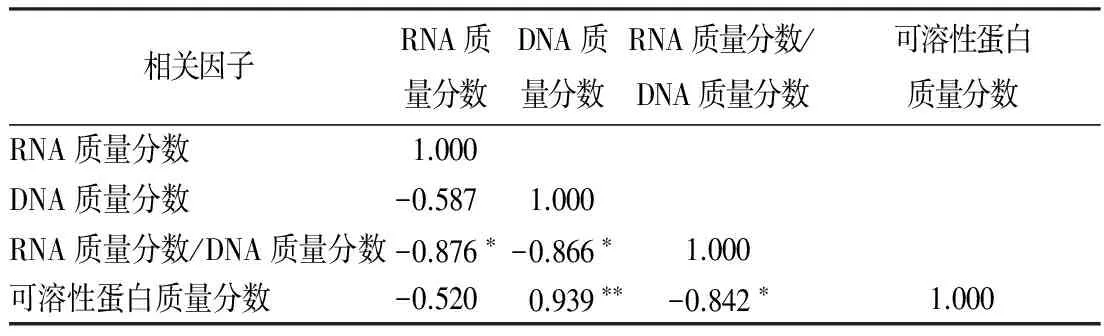
相关因子RNA质量分数DNA质量分数RNA质量分数/DNA质量分数可溶性蛋白质量分数RNA质量分数1.000DNA质量分数-0.5871.000RNA质量分数/DNA质量分数-0.876∗-0.866∗1.000可溶性蛋白质量分数-0.5200.939∗∗-0.842∗1.000
注:** 表示差异极显著(p<0.01);*表示差异显著(p<0.05)。
3 结论与讨论
花序是植物系统分类学的关键依据。鸢尾科植物花序类型多为穗状花序等无限花序,但根据对番红花花序结构和开花顺序分析,番红花应属于有限花序中的蝎尾状聚伞花序。番红花从花芽分化开始到花器官功能形成共经历65 d左右,其花器官按照萼片—外轮花被—雄蕊—内轮花被—雌蕊的顺序分化,并未按传统花芽分化模式进行分化,这种现象在德国鸢尾中也有发生[8]。另外,番红花外轮花被和雄蕊是由同一块原基分化而来,在单子叶植物中,这种花被雄蕊同原基分化、花被原基和雄蕊原基融合和花被雄蕊形成复合共同体现象普遍存在[13],这可能是番红花雄蕊原基早于内轮花被原基分化的重要原因,同时,也从一个侧面反映出番红花仍保留一些原始的分化模式,是一种进化不完全的表现。一般情况下,单子叶植物横切面平面图应为三基数五环结构[13],但番红花与其余鸢尾科植物类似,只有3枚雄蕊,丧失1个雄蕊环,但这并没有影响中心环心皮的分化和位置,仍然具有单子叶植物的3基数结构特征,并同样形成花被环、雄蕊环和心皮环,仍属于典型的ABC植物。
番红花花芽分化及发育过程中,花芽中RNA质量分数变化呈现先升高后降低变化趋势,而DNA质量分数却呈现升高-降低-升高的变化趋势,与李月华等[14]和张荻等[15]研究结果类似,这种差异表现可能是因为花芽茎端分生组织接受到成花信息诱导后,RNA质量分数开始上升,随后与花原基细胞增殖有关的DNA开始复制,DNA质量分数迅速上升,进入基因转录程序后,需要大量的mRNA、tRNA和rRNA,致使RNA质量分数继续上升,DNA质量分数下降。随着花芽分化的结束,作为转录因子的RNA质量分数下降,但与花芽发育相关的细胞增殖仍在继续,所以DNA质量分数又上升。花芽内RNA质量分数/DNA质量分数从花序及小花原基分化期开始急剧升高,说明番红花花芽在生殖生长期发生大量诱导基因的表达,而且高RNA质量分数/DNA质量分数利于营养生长向生殖生长转变,这可能与花原基形成需要大量特异性mRNA转录和蛋白质(尤其是酶)合成有关[16]。番红花花芽分化及发育过程中,大量的DNA复制和大量mRNA转录,必然诱导大量蛋白质合成,RNA质量分数/DNA质量分数及DNA质量分数与可溶性蛋白质量分数之间的显著相关性证实了这一点。另外,在雄蕊原基分化期可溶性蛋白质量分数出现一个低谷,这可能与雄蕊原基和小花原基由同一块原基发育而来有关。
核酸和蛋白质代谢是番红花花芽从营养生长过渡为生殖生长及花芽形态建成的生化基础,核酸和蛋白的组分及质量分数共同调节番红花花芽的分化及发育,进一步探索核酸和蛋白质组分及关键特异蛋白的质量分数变化对明确番红花花芽分化分子调控机制具有开创性意义。
[1] CAIOLA M G, CAPUTO P, ZANIER R. RAPD analysis inCrocussaivusL. accessions and relatedCrocusspecies[J]. Biology Plantarum,2004,48(3):375-380.
[2] 绕君凤,王根法,吕伟德.浙江省西红花“二段法”优质高产栽培技术研究[J].安徽农业科学,2012,40(9):5214-5215.
[3] 李云飞,张正伟,吕志刚.种植密度对藏红花生长的影响[J].河北农业科学,2009,13(7):12-13.
[4] 董卫明.番红花种球定量留芽增产效果研究简报[J].上海农业学报,2012,28(1):131-133.
[5] 刘芸,朱利泉,龙云,等.钾对番红花球茎膨大的促进效应[J].植物营养与肥料学报,2004,10(1):96-100.
[6] 谢礼,吕明芳,董峰丽,等.藏红花病毒病原的分子鉴定[J].中草药,2013,44(8):1033-1036.
[7] 李和平.植物显微技术[M].北京:科学出版社,2009:85-90.
[8] 常钟阳,张金政,孙国锋,等.德国鸢尾‘常春黄’花芽分化的形态观察及两种代谢产物的动态变化[J].植物研究,2008,28(6):741-745.
[9] 朱广廉,钟海文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:135-138.
[10] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,1999:195-196.
[11] 曹宗巽,吴相钰.植物生理学:下册[M].北京:人民教育出版社,1980:399-400.
[12] 涂淑萍,穆鼎,刘春.不同百合品种花芽分化期的生理生化变化[J].中国农学通报,2005,21(7):207-209.
[13] REMIZOWA M V, SOKOLOFF D D, RUDALL P J. Evolutionary history of the monocot flower[J]. Annals of the Missouri Botanical Garden,2010,97(4):617-645.
[14] 李月华,刘建斌,高润清,等.华北紫丁香花芽生长过程中蛋白质和核酸含量变化研究[J].北京农学院学报,2000,15(2):24-27.
[15] 张荻,申晓辉,卓丽环.百子莲(Agapanthuspraecoxssp.orientalis)开花生理特征的研究[J].上海交通大学学报(农业科学版),2011,29(3):6-13.
[16] TAO Y L, ZENG G W, ZHU C. The studies on the formation and timing of evocation cell group of floral primordia and its histochemistry in Cucumber[J]. Journal Zhejiang University (Agriculture & Life Sciences),2001,27(2):134-138.
Contents of Microscopic Structure, Nucleic Acid and Soluble Protein during Flower Bud Differentiation inCrocussativus//
Zhang Hengfeng, Wei Qingcui
(Jiangsu Agri-animal Husbandry Vocational College);
Zhang Huanchao
(Nanjing Forestry University)//Journal of Northeast Forestry University,2017,45(1):33-36.
Crocussativus; Flower bud differentiation; Microscopic structure; Nucleic acid; Soluble protein
张衡锋,男,1980年7月生,江苏农牧科技职业学院园林园艺系,讲师。E-mail:584189434@qq.com。
张焕朝,南京林业大学林学院,教授。E-mail:hczhang@njfu.edu.cn。
2016年9月16日。
S682.29;Q942.5
1)泰州市科技支撑计划(农业)项目(TN201321)、江苏省林业三新工程项目( LYSX[2014]13)。
责任编辑:任 俐。
