伊立替康联合替吉奥治疗晚期食管癌的疗效评价
2017-01-17李冰洁樊青霞
李冰洁,樊青霞
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
伊立替康联合替吉奥治疗晚期食管癌的疗效评价
李冰洁,樊青霞
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
目的 观察伊立替康联合替吉奥治疗晚期食管癌的疗效及不良反应。方法 经组织学证实的43例晚期食管癌患者接受化疗:伊立替康80 mg·m-2,持续静脉滴注90~120 min,d1,8;替吉奥80 mg·m-2,bid,d1~14,21 d为1周期,每2周期化疗后进行疗效评价。结果 43例患者共完成169周期化疗,在可评价疗效的41例患者中,CR 1例,PR 10例,SD 14例,PD 16例,有效率为26.8%(11/41),疾病控制率为61.0%(25/41)。中位疾病进展时间为5.6个月,中位总生存时间为9.8个月。化疗主要不良反应为胃肠道反应和血液学毒性。结论 伊立替康联合替吉奥治疗晚期食管癌疗效显著、不良反应轻、患者依从性好,可作为晚期食管癌的治疗方案。
伊立替康;替吉奥;晚期食管癌
食管癌是发病率和致死率均较高的恶性肿瘤。食管癌的病理类型主要为腺癌和鳞癌,其中鳞癌约占87%,主要发生在发展中国家,腺癌主要发生在西方国家(北美洲、欧洲),且食管腺癌的发病率逐年增高[1-2]。我国食管癌的发病率仅次于胃癌,居第2位。早期食管癌症状不典型,易被忽略,疾病确诊时,约有50%的患者出现远处转移[3],失去了手术切除的机会,预后较差。食管癌的5 a生存率仅为15%~25%[4]。化疗作为晚期食管癌的重要治疗手段,对食管癌患者生活质量的提高、疾病无进展时间的延长起着至关重要的作用。但目前进展期食管癌的治疗并没有标准的化疗方案,铂类药物和氟尿嘧啶是联合化疗的基础,在顺铂和氟尿嘧啶基础上联合紫杉醇类药物或伊立替康等新药能够提高有效率,并且能够延长患者生存时间[5]。多项研究表明替吉奥联合其他抗肿瘤药物如顺铂[6]、伊立替康[7]、多西他赛[8]等在治疗胃肠道肿瘤方面取得了不错的临床效果。本研究采用伊立替康联合替吉奥治疗43例晚期食管癌患者,并观察治疗的效果和不良反应,现报道如下。
1 资料与方法
1.1 入组标准 患者年龄≥20岁,组织活检或细胞学检查诊断为食管癌;既往化疗方案中不含有伊立替康的复发或转移患者;入组前1个月内未进行放疗和(或)化疗;有CT或MRI可测量的病灶,并可按照实体瘤的疗效评价标准进行疗效评价;ECOG评分0~2分;预计生存时间≥2个月;中性粒细胞≥1.5×109·L-1,血红蛋白≥90 g·L-1,血小板≥100×109·L-1,肌酐≤1.5×参考值上限,总胆红素≤1.5×参考值上限,丙氨酸转氨酶≤3×参考值上限。化疗前告知患者相关风险并签署化疗知情同意书。
1.2 临床资料 共纳入郑州大学第一附属医院、河南省肿瘤医院和林州市中心医院2012年6月至2014年5月收治的晚期食管鳞癌患者43例,其中男24例,女19例;年龄(55.2±6.2)岁。见表1。
表1 43例晚期食管癌患者的一般资料
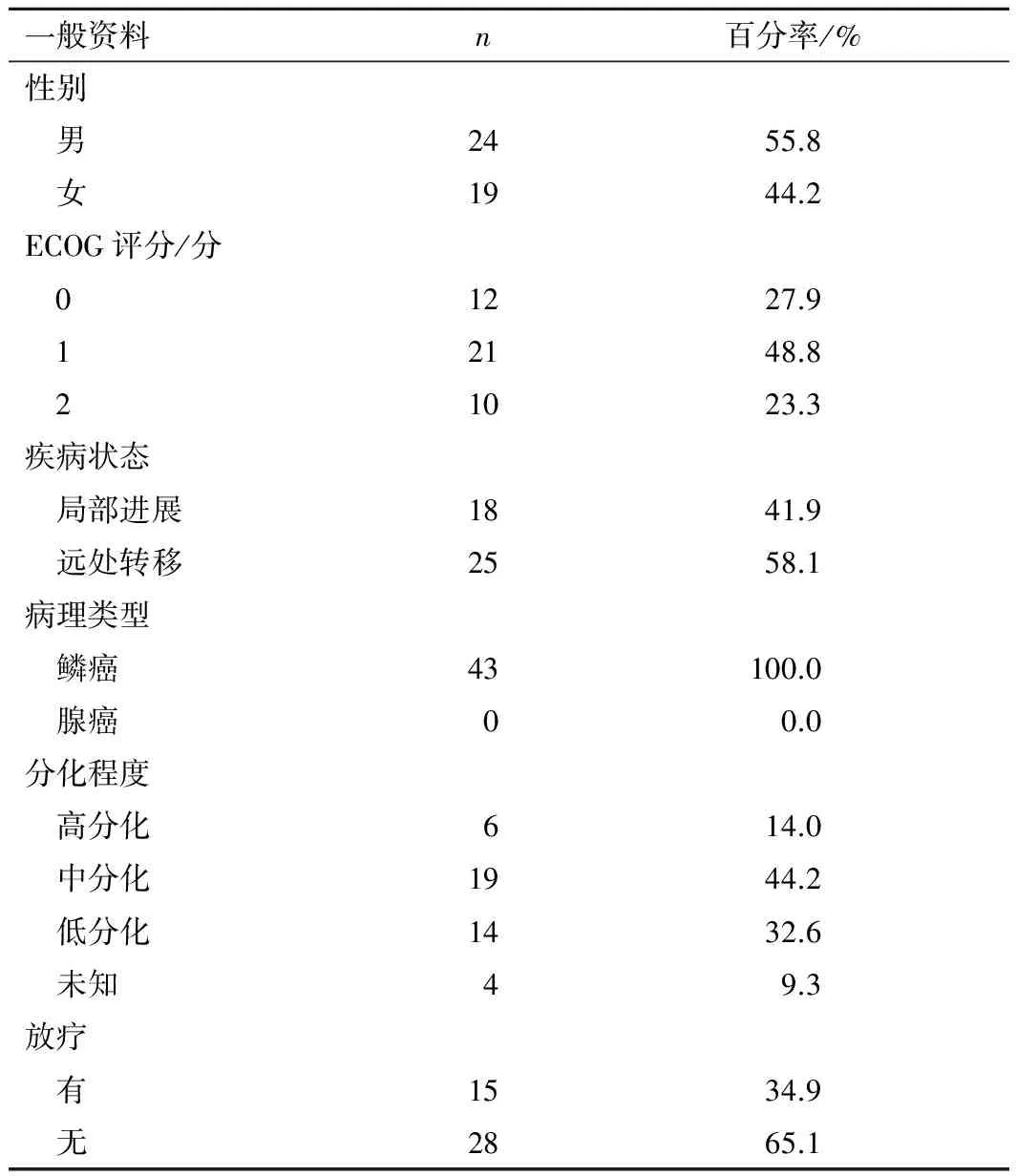
一般资料n百分率/%性别 男2455.8 女1944.2ECOG评分/分 01227.9 12148.8 21023.3疾病状态 局部进展1841.9 远处转移2558.1病理类型 鳞癌43100.0 腺癌00.0分化程度 高分化614.0 中分化1944.2 低分化1432.6 未知49.3放疗 有1534.9 无2865.1
1.3 治疗方案 伊立替康80 mg·m-2,持续静脉滴注90~120 min,第1、8天,替吉奥80 mg·m-2,bid,d1~14,21 d为1周期。化疗前30 min常规输注托烷司琼针预防恶心、呕吐等,及伊立替康前常规给予阿托品0.25 mg肌肉注射,预防类胆碱能综合征,化疗后如有延迟性腹泻给予洛哌丁胺治疗,治疗过程中,不允许预防性使用集落刺激因子,如患者白细胞≤2×109·L-1,血小板≤50×109·L-1,给予升白细胞、血小板治疗。如患者化疗期间出现Ⅳ度不良反应,下周期药物剂量减至原剂量的80%。患者疾病进展(PD)、不良反应不能耐受时终止化疗。
1.4 疗效和化疗不良反应评价 采用实体瘤的疗效评价标准进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、PD,以CR+PR计算总有效率,以CR+PR+SD计算疾病控制率。不良反应评价依据化疗不良反应分度标准NCI CTC3.0版进行。化疗期间每天记录化疗不良反应,每周期化疗前进行血常规及肝、肾功能等相关检查,每2周期化疗后进行影像学检查,评价肿瘤变化。疾病进展时间和总生存时间均从治疗第1天开始计算。
1.5 统计学处理 采用SPSS 18.0进行统计分析,用Kaplan-Meier法绘制生存曲线,检验水准α=0.05。
2 结果
2.1 近期疗效 入组的43例患者中,1例患者1周期化疗后出现重度骨髓抑制并出现肺部感染,终止化疗;1例患者出现严重腹泻不能耐受,停止治疗。43例患者共完成169周期化疗,41例可评价疗效的患者共完成167周期化疗,中位化疗周期数为4。近期疗效评价结果显示,CR 1例,PR 10例,SD 14例,PD 16例,有效率为26.8%(11/41),疾病控制率为61.0%(25/41)。
2.2 生存情况 本组41例患者的疾病进展时间为2~12个月,中位疾病进展时间为5.6个月[95%CI(3.8~6.2)];总生存时间为3~23个月,中位总生存时间为9.8个月[95%CI(7.4~10.6)]。见图1、2。
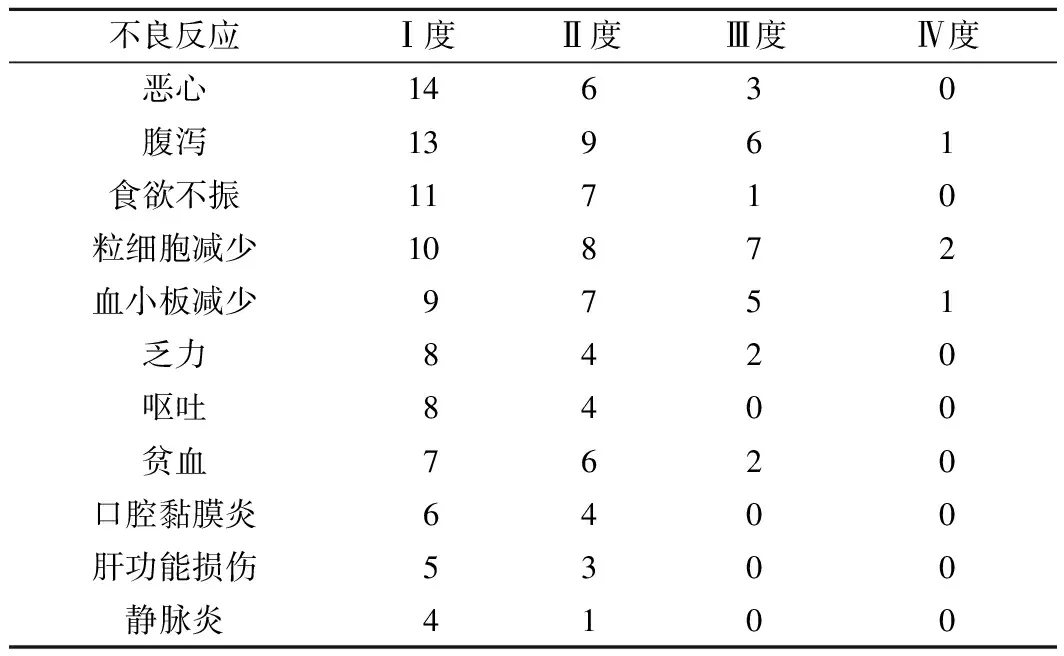
2.3 不良反应 伊立替康联合替吉奥治疗晚期食管癌期间出现较为常见的恶心、呕吐、腹泻等不良反应,其中7例患者出现Ⅲ、Ⅳ度腹泻。粒细胞和血小板减少也较为常见,其中2例患者出现Ⅳ度粒细胞减少,1例出现消化道感染,给予抗感染治疗后,症状缓解。1例患者出现Ⅳ度血小板减少,给予输注血小板一个治疗量和白介素-11治疗后血小板回升至正常。治疗期间患者出现的不良反应给予对症支持治疗后均可缓解,未见化疗不良反应致死性病例。见表2。
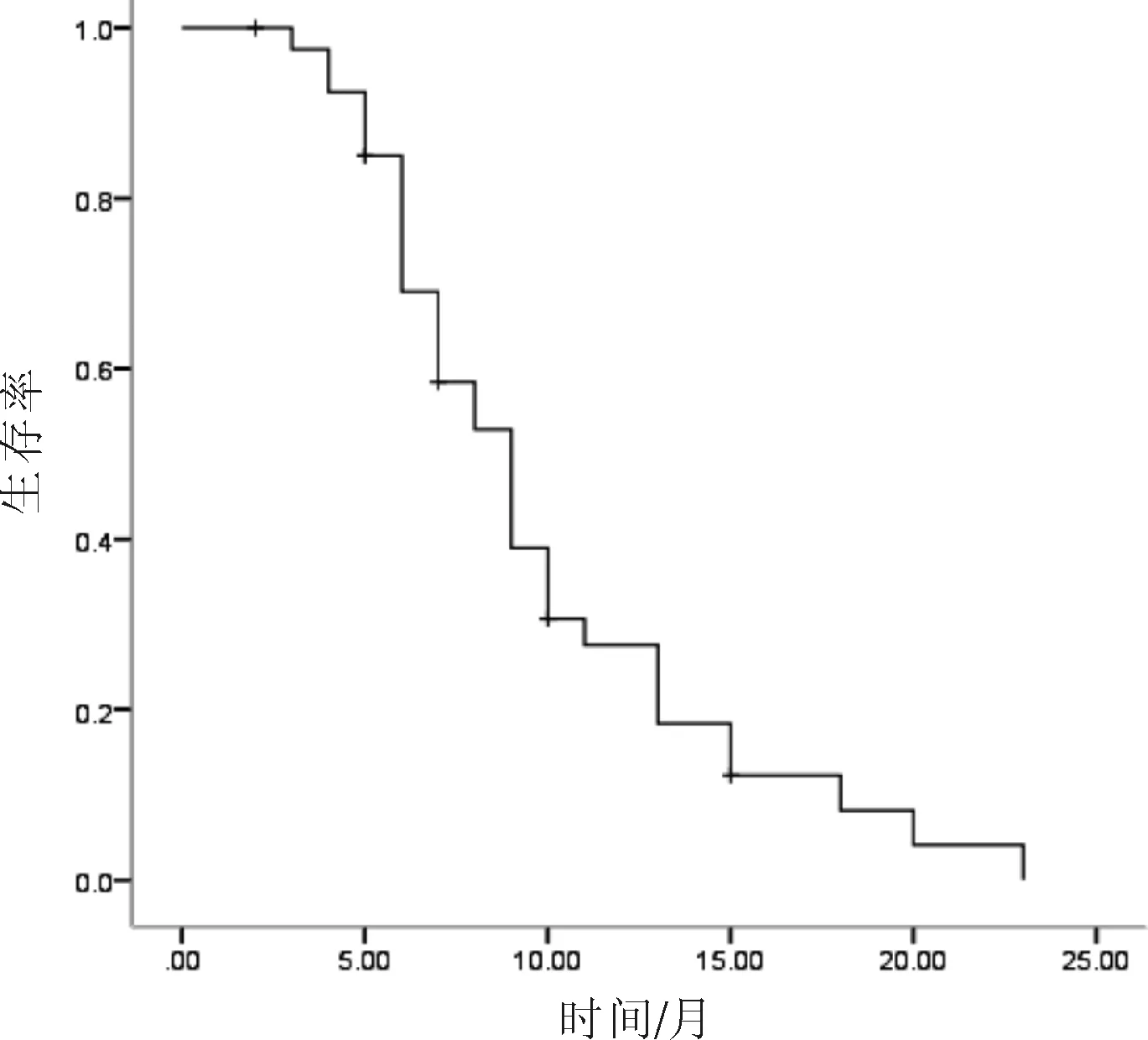
图2 41例患者的总生存时间曲线 表2 不良反应
n
3 讨论
食管癌在我国高发,且具有发病隐匿、侵袭性高、预后差等特性。顺铂联合氟尿嘧啶为基础的化疗有效率低,生存时间短[9]。对一线治疗失败的晚期患者,目前没有统一的治疗方案。有研究[10]显示多西他赛、奥沙利铂、吉西他滨等对晚期食管癌有一定的疗效。伊立替康是拓扑异构酶I的抑制剂,主要用于肺癌、宫颈癌、结直肠癌的治疗。近年来在食管癌的治疗方面备受关注,伊立替康单药对进展期或转移性食管癌的治疗有效率仅为10%~20%[11]。故伊立替康联合其他抗肿瘤药物是研究的主要方向。研究[12]显示伊立替康与顺铂、多西他赛、奈达铂等抗肿瘤药物治疗进展期食管癌,可以进一步提高治疗效果,延长患者的生存时间,并且不良反应可以耐受。
替吉奥是新型的口服抗肿瘤药物,主要由替加氟、吉美嘧啶和奥替拉西钾3种成分构成。替加氟在体内转变为氟尿嘧啶起抗肿瘤作用,吉美嘧啶起到延长药物半衰期的作用,奥替拉西钾能够减轻药物所致胃肠道反应。有研究[13]显示替吉奥单药治疗胃腺癌的有效率与氟尿嘧啶+顺铂和氟尿嘧啶+亚叶酸钙相比差别不大。替吉奥较氟尿嘧啶血药浓度高,不良反应轻,口服制剂依从性好。有研究[14]显示伊立替康能够上调肿瘤组织中的胸腺嘧啶膦酸化酶的表达,可以提高替吉奥的抗肿瘤效果。
伊立替康和替吉奥在体内的抗肿瘤作用具有协同性。本研究采用伊立替康联合替吉奥治疗43例晚期食管鳞癌患者,其中41例完成治疗,CR 1例,PR 10例,SD 14例,有效率为26.8%,疾病控制率为61.0%。较单药伊立替康治疗进展期食管癌的有效率明显增高。患者的中位疾病进展时间为5.6个月,中位总生存时间为9.8个月,与Dank等[15]采用伊立替康+氟尿嘧啶+亚叶酸钙方案治疗食管癌的结果相近;与Ajani等[16]采用多西他赛+顺铂+氟尿嘧啶方案治疗食管癌的结果也非常接近。本研究中常见的胃肠道反应为恶心、呕吐、腹泻等,常见的血液学毒性为粒细胞减少和血小板减少。不良反应Ⅰ、Ⅱ度较为常见,Ⅲ、Ⅳ度发生率较低。所有不良反应给予对症支持治疗后均能够缓解,患者耐受性可。有研究[17]发现,伊立替康联合多西他赛治疗食管癌的中位疾病进展时间为11个月,中位总生存时间为24个月,但是患者出现较为严重的不良反应,耐受性差。
Nakajima等[18]采用替吉奥联合伊立替康治疗食管腺癌患者,CR 1例,PR 4例,有效率为62.5%(5/8)。所有患者的中位疾病进展时间为8.4个月,中位总生存时间为19.1个月,但是,复发转移患者的中位疾病进展时间为5.9个月,中位总生存时间为16.3个月。上述研究的有效率和复发转移患者的中位疾病进展时间与本研究相似,但是其复发转移患者的总生存时间较本研究延长约6.5个月,提示伊立替康联合替吉奥对食管腺癌的远期生存较食管鳞癌更有优势。替吉奥联合伊立替康治疗食管腺癌较食管鳞癌疗效更好,但尚需要更进一步的研究证实。
总之,伊立替康联合替吉奥治疗晚期食管鳞癌患者疗效确切、不良反应轻、住院时间短、依从性好,可作为晚期食管鳞癌治疗新的选择。但本研究样本量有限,未设置对照组,结果存在一定的局限性,需要大样本、多中心的研究进一步证实。
[1] 崔娟娟,江晓燕,谭程. 复方红豆杉胶囊联合调强放疗治疗老年中晚期食管癌的临床疗效分析[J].肿瘤基础与临床,2015,28(4):323-325.
[2] Arnold M,Pandeya N,Byrnes G,et al. Global burden of cancer attributable to high body-mass index in 2012: a population-based study[J].Lancet Oncol,2015,16(1):36-46.
[3] Jemal A,Siegel R,Ward E,et al. Cancer statistics,2007[J].CA Cancer J Clin,2007,57(1):43-66.
[4] Pennathur A,Gibson MK,Jobe BA,et al. Oesophageal carcinoma[J].Lancet,2013,381(9864): 400-412.
[5] Kato K,Muro K,Minashi K,et al. Phase Ⅱ study of chemoradiotherapy with 5-fluorouracil and cisplatin for Stage Ⅱ-Ⅲ esophageal squamous cell carcinoma: JCOG trial (JCOG 9906)[J].Int J Radiat Oncol Biol Phys,2011,81(3):684-690.
[6] Koizumi W,Narahara H,Hara T,et al.S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase Ⅲ trial[J]. Lancet Oncol,2008,9(3):215-221.
[7] Inokuchi M,Yamashita T,Yamada H,et al. Phase Ⅰ/Ⅱ study of S-1 combined with irinotecan for metastatic advanced gastric cancer[J].Br J Cancer,2006,94(8):1130-1135.
[8] Yoshida K,Hirabayashi N,Takiyama W,et al. Phase Ⅰ study of combination therapy with S-1 and docetaxel (TXT) for advanced or recurrent gastric cancer[J].Anticancer Res,2004,24(3b):1843-1851.
[9] Shibata Y,Baba E,Ariyama H,et al. Metastatic basaloid-squamous cell carcinoma of the esophagus treated by 5-fluorouracil and cisplatin[J].World J Gastroenterol,2007,13(26):3634-3637.
[10]Zhang X,Shen L,Li J,et al. A phase Ⅱ trial of paclitaxel and cisplatin in patients with advanced squamous-cell carcinoma of the esophagus[J].Am J Clin Oncol,2008,31(1):29-33.
[11]Enzinger PC,Kulke MH,Clark JW,et al. A phase Ⅱ trial of irinotecan in patients with previously untreated advanced esophageal and gastric adenocarcinoma[J].Dig Dis Sci,2005,50(12):2218-2223.
[12]Burtness B,Gibson M,Egleston B,et al. Phase Ⅱ trial of docetaxel-irinotecan combination in advanced esophageal cancer[J].Ann Oncol,2009,20(7):1242-1248.
[13]Sakata Y,Ohtsu A,Horikoshi N,et al. Late phase Ⅱ study of novel oral fluoropyrimidine anticancer drug S-1 (1 M tegafur-0.4 M gimestat-1 M otastat potassium) in advanced gastric cancer patients[J].Eur J Cancer,1998,34(11):1715-1720.
[14]Tsunoda A,Yasuda N,Nakao K,et al. Phase Ⅱ study of S-1 combined with irinotecan (CPT-11) in patients with advanced colorectal cancer[J].Oncology,2009,77(3/4):192-196.
[15]Dank M,Zaluski J,Barone C,et al.Randomized phase Ⅲ study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction[J].Ann Oncol,2008,19(8):1450-1457.
[16]Ajani JA,Moiseyenko VM,Tjulandin S,et al. Quality of life with docetaxel plus cisplatin and fluorouracil compared with cisplatin and fluorouracil from a phase Ⅲ trial for advanced gastric or gastroesophageal adenocarcinoma: the V-325 Study Group[J]. J Clin Oncol,2007,25(22):3210-3216.
[17]Hawkes E,Okines AF,Papamichael D,et al. Docetaxel and irinotecan as second-line therapy for advanced oesophagogastric cancer[J].Eur J Cancer,2011,47(8):1146-1151.
[18]Nakajima Y,Fujiwara N,Ryotokuji T,et al. A pilot trial of S-1 plus irinotecan chemotherapy for esophageal adenocarcinoma[J].Hepatogastroenterology,2012,59(119):2182-2185.
Efficacy of Irinotecan Combined with S-1 in the Treatment of Advanced Esophageal Carcinoma
Li Bingjie,Fan Qingxia
(DepartmentofOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052,China)
Objective To investigated the clinical efficacy and toxicities of the combination chemotherapy of S-1 plus irinotecan for esophageal carcinoma.Methods A total of 43 patients with histopathologically confirmed advanced esophageal carcinoma received the combination chemotherapy of S-1 plus irinotecan. S-1 was administered orally at a dose of 80 mg·m-2from day 1 to 14,and irinotecan was given intravenously on day 1 and 8 at a dose of 80 mg·m-2. The effect was evaluated at least after 2 cycles.Results The 43 patients completed altogether 169 cycles. In the 41 patients whose effects were evaluable,1 patient experienced CR,10 patients PR,14 patients SD,and 16 patients PD. The overall response rate was 26.8%,and the disease control rate was 61.0%. The median time to disease progression was 5.6 months,the median overall survival time was 9.8 months. The main toxicities of chemotherapy were gastrointestinal reaction and hematological toxicities.Conclusion The combination chemotherapy of S-1 plus irinotecan is effective and safe for advanced esophageal carcinoma.
irinotecan; S-1; advanced esophageal carcinoma
李冰洁(1991-),男,硕士在读,主要从事食管癌的基础与临床研究。E-mail:bingjieli1991@outlook.com
樊青霞(1952-),女,教授,博士生导师,主要从事肿瘤基础与临床研究。E-mail: fqx1003@126.com
10.3969/j.issn.1673-5412.2016.06.007
R735.1;R730.53
A
1673-5412(2016)06-0479-04
2016-07-21)
