酶法合成1,2-甘油二酯的工艺研究
2017-01-17祝雨筱王盈盈金青哲王兴国王小三
祝雨筱,王盈盈,金青哲,王兴国,王小三
(江南大学食品学院,江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
油脂改性
酶法合成1,2-甘油二酯的工艺研究
祝雨筱,王盈盈,金青哲,王兴国,王小三
(江南大学食品学院,江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
以固定化脂肪酶Lipozyme 435为催化剂,在无溶剂体系下催化高油酸葵花籽油与无水乙醇发生醇解反应合成1,2-甘油二酯。通过单因素试验确定的最优反应条件为:高油酸葵花籽油与无水乙醇摩尔比1∶50,加酶量6%(占底物总质量),反应温度50℃,反应时间1 h。在最优反应条件下,1,2-甘油二酯得率可达88%。粗产物经两步结晶法提纯后,可获得纯度为100%的1,2-甘油二酯。
1,2-甘油二酯;醇解;酶法合成;Lipozyme 435
甘油二酯(DAG)是一种乳化剂和表面活性剂,在食品、医药、化妆品、化工等行业有着广泛的用途[1]。甘油二酯是一类甘油三酯(TAG)中1个脂肪酸被羟基取代所形成的结构脂质,主要存在1,3-DAG和1,2-DAG两种异构体。与1,3-DAG不同的是,1,2-DAG可以作为趋化因子刺激白细胞向感染部位迁移,促进伤口的愈合[2],也可以帮助改善患有糖尿病大鼠的心肌功能紊乱[3]。此外,纯的1,2-DAG还可用于合成大量酶受体的兴奋剂和拮抗剂,以及作为合成磷脂、糖脂、药物前体和结构甘油三酯的中间体[4]。
由于1,2-DAG的热稳定性较差,不易于保存,目前国内对其合成工艺研究较少,仅有文献[5]报道了化学法的合成工艺,即以D-甘露醇为原料,经丙叉基保护、氧化还原、苄基保护、脱丙叉保护、醇的酰化、苄基的脱保护,合成产率49.3%的1,2-DAG。该反应耗时超过60 h,且反应过程中引入了溴化苄、四丁基硫酸氢铵、氯仿等大量有毒试剂,不是一种高效绿色的合成途径,此外这种合成工艺经过多步保护和脱保护过程,十分复杂。为改进化学法合成工艺,本研究以固定化脂肪酶Lipozyme 435为催化剂,通过醇解TAG合成1,2-DAG。本研究原料来源广泛,反应迅速,不引入有毒试剂,为合成1,2-DAG提供了一种新的途径。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
高油酸葵花籽油:上海良友海狮油脂实业有限公司;固定化脂肪酶Lipozyme RM IM(标称活力275 IUN/g,数据来源于诺维信公司,下同)、Lipozyme 435(8 000 PLU/g)、Lipozyme TL IM(250 IUN/g)、Novozym 435(10 000 PLU/g):诺维信(中国)生物技术有限公司;1,2-二油酸甘油酯标准品:Sigma 公司;正己烷、异丙醇:色谱纯;甲醇、无水乙醇、正丙醇、正丁醇、叔丁醇、冰乙酸:分析纯。
1.1.2 仪器与设备
夹层酶反应器:上海化科实验器材有限公司;有机针孔过滤器(直径13 mm,孔径0.22 μm);SHZ-3循环水多用真空泵;HH-601超级恒温水浴;Re-501型旋转蒸发器;TGL-16B离心机;AR2140电子精密天平;Waters 1525高效液相色谱仪,WatersAlltech 3300蒸发光散射检测器:美国Waters公司。
1.2 试验方法
1.2.1 1,2-DAG的合成
称取一定质量的高油酸葵花籽油于酶反应器,加入一定体积的醇,放入搅拌子,在一定温度下恒温水浴中预热,打开磁力搅拌器,以500 r/min搅拌乳化15 min后,加入占一定底物总质量百分比的脂肪酶,开始反应,一段时间后停止反应,取出产物,4 000 r/min离心10 min去除脂肪酶,35℃旋转蒸发30 min去除有机溶剂,得到1,2-DAG粗产物。
1.2.2 1,2-DAG的纯化
采用两步结晶法对1,2-DAG粗产物进行纯化。将1,2-DAG粗产物与正己烷以1∶10比例混合,常温下摇匀溶解,在-40℃下放置24 h,抽滤分离固液两相,获得的固相即为第一步结晶的粗提物。将第一步结晶的粗提物与甲醇以1∶15比例混合,常温下摇匀溶解,在-20℃下放置6 h,抽滤分离固液两相,获得的固相即为纯度达100%的1,2-DAG。
1.2.3 HPLC-ELSD分析1,2-DAG粗产物
取一定质量1,2-DAG粗产物于烧杯,加入一定体积的正己烷溶解样品,配制成质量浓度为0.6 mg/mL的溶液,经有机针筒过滤器过滤后注入样品瓶中,进HPLC-ELSD分析。
配制质量浓度在0.007 5~0.200 0 mg/mL之间的1,2-DAG标准溶液,采用HPLC-ELSD分析,外标法绘制标准曲线,粗产物中1,2-DAG的含量除以理论生成量即为得率。
HPLC-ELSD分析条件:Sepax HP-Silica色谱柱(5 μm,4.6 mm×250 mm);流速1 mL/min;柱温35℃;漂移管温度 75℃;增益1;进样量5 μL;流动相 A相(正己烷与异丙醇体积比99∶1),B相(正己烷、异丙醇、冰乙酸体积比1∶1∶0.01);梯度洗脱条件为0~10 min,A由100%降至80%;10~14 min,A由80%降至70%;14~15 min,A 由70%升至100%;15~20 min,A保持100%不变。在此色谱条件下,1,2-DAG粗产物的HPLC-ELSD图见图1。
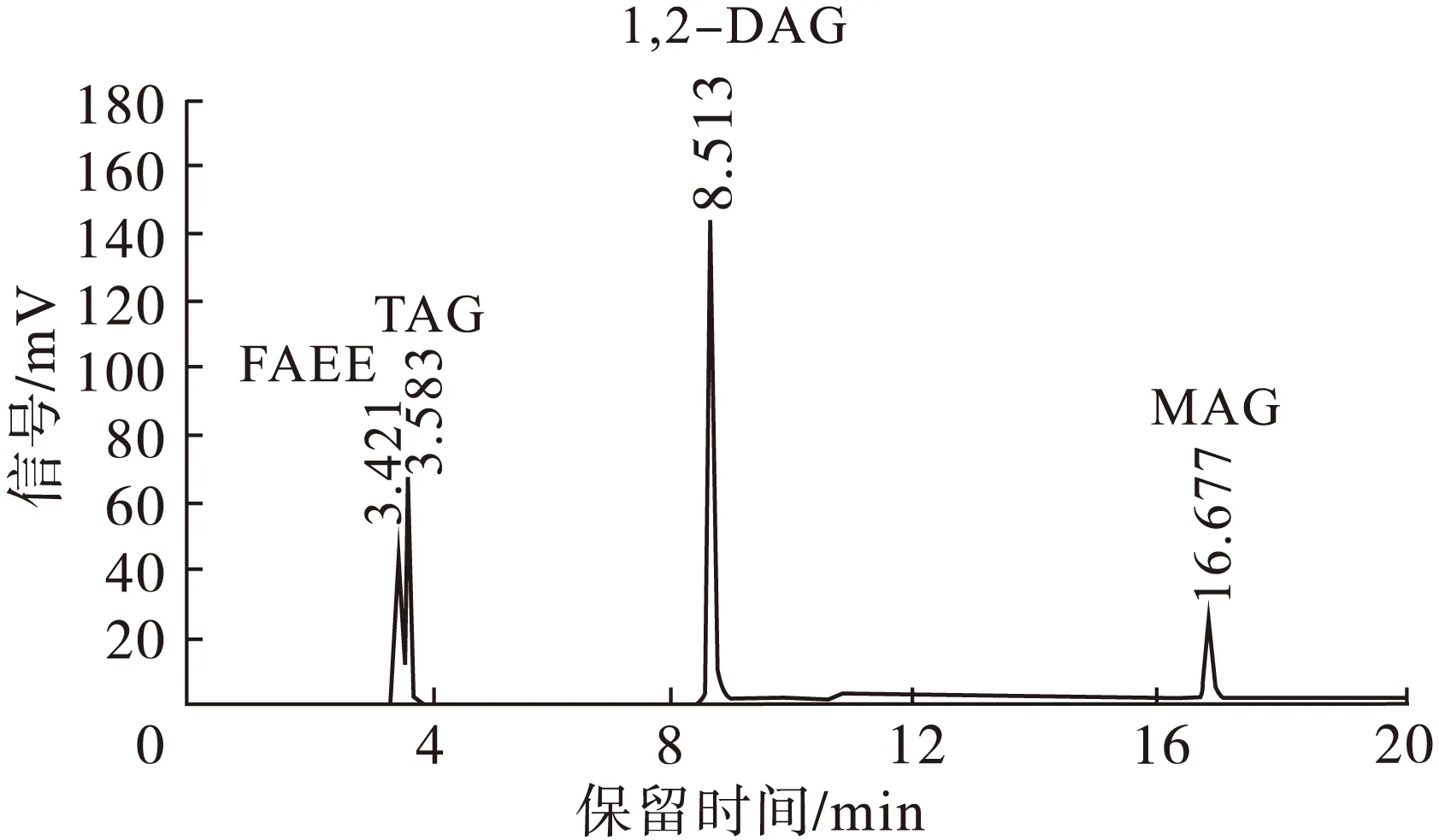
图1 1,2-DAG粗产物的HPLC-ELSD图
2 结果与讨论
2.1 脂肪酶种类对反应的影响
选取脂肪酶Lipozyme RM IM、Lipozyme 435、Lipozyme TL IM、Novozym 435进行试验,反应条件为:将高油酸葵花籽油与无水乙醇以摩尔比1∶50混合,加入占底物总质量6%的一种脂肪酶,在50℃下催化反应1 h。结果如图2所示。

图2 脂肪酶种类对得率的影响
由图2可知,Lipozyme RM IM在反应中没有表现出活性,这是因为反应物无水乙醇的极性较大,夺取了酶表面维持活性所必需的水分子[6]。采用Lipozyme TL IM催化反应虽然可以获得1,2-DAG,但Lipozyme TL IM的载体为硅胶,容易与极性反应副产物吸附,降低得率[7]。除Lipozyme RM IM之外,其余3种脂肪酶都表现出了较高的选择性,这是因为反应体系的极性较高,提高了脂肪酶的选择性[8]。采用脂肪酶Lipozyme 435和脂肪酶Novozym 435催化反应可以获得较高的得率,而与Novozym 435相比,Lipozyme 435是一种食品级脂肪酶,价格更为低廉,在极性溶剂中也具有更高的活性和稳定性[9]。因此,选取Lipozyme 435作为反应用脂肪酶。
2.2 醇种类对反应的影响
选取甲醇、无水乙醇、正丙醇、异丙醇、正丁醇、叔丁醇进行试验,反应条件为:将高油酸葵花籽油与醇以摩尔比1∶50混合,加入占底物总质量6%的脂肪酶Lipozyme 435,在50℃下催化反应1 h。结果如图3所示。

图3 醇种类对得率的影响
由图3可知,采用无水乙醇作为反应物时,可以获得较高的1,2-DAG得率。甲醇与高油酸葵花籽油反应没有生成1,2-DAG,这是因为过量的甲醇会剥除固定化酶表面的水层,降低酶活性和稳定性,而脂肪酶本身为蛋白质,过量的甲醇也可导致脂肪酶的变性[10]。试验发现采用无水乙醇与高油酸葵花籽油反应,可以获得高纯度的1,2-DAG,并且没有生成副产物1,3-DAG。这可能是因为反应体系的极性较高,提高了脂肪酶的选择性[8]。此外,反应体系倾向于生成与溶剂logp值相近的产物[11],1,2-DAG的极性比1,3-DAG大,故反应体系更倾向于生成1,2-DAG。因此,选取无水乙醇作为反应物进行后续试验。
2.3 底物摩尔比对反应的影响
将高油酸葵花籽油与无水乙醇以不同摩尔比混合,加入占底物总质量6%的脂肪酶Lipozyme 435在50℃下催化反应1 h。结果如图4所示。

图4 底物摩尔比对得率的影响
由图4可知,随着底物摩尔比增加,1,2-DAG得率呈现先增后减的趋势。试验发现,采用过量的无水乙醇与高油酸葵花籽油反应,可以提高1,2-DAG的得率。这可能是因为过量的醇有利于提高脂肪酶的sn-1,3位特异性。Zhang等[12]报道,当乙醇过量时,Novozyme 435催化醇解反应可以表现出较好的sn-1,3位特异性。Kuo等[6]的研究表明,采用过量乙醇与三辛酸甘油酯反应时,Lipozyme RM IM具有较高的sn-1,3位特异性。此外,Poppe等[11]的研究也表明采用过量的乙醇醇解棕榈油时,会促进反应平衡向正反应方向移动。然而,随着无水乙醇用量继续增加,脂肪酶与底物接触受到限制,得率反而降低。因此,最适底物摩尔比为1∶50。
2.4 加酶量对反应的影响
将高油酸葵花籽油与无水乙醇以摩尔比1∶50混合,加入占底物总质量不同比例的脂肪酶Lipozyme 435在50℃下催化反应1 h。结果如图5所示。

图5 加酶量对得率的影响
由图5可知,加酶量为6%时,1,2-DAG的得率达到最高。加酶量过低时,不足以与全部的底物反应。随着加酶量的增加,酶分子与底物的接触机会增加,1,2-DAG得率随之提高。但若继续增加加酶量,过量的酶会催化副反应发生,降低1,2-DAG的得率,同时也会增加反应成本[13]。因此,选择最适加酶量为6%。
2.5 反应温度对得率的影响
将高油酸葵花籽油与无水乙醇以摩尔比1∶50混合,加入占底物总质量6%的脂肪酶Lipozyme 435在不同温度下催化反应1 h。结果如图6所示。

图6 反应温度对得率的影响
由图6可知,随着反应温度升高,1,2-DAG得率呈现先增后减的趋势。较高的反应温度可以降低体系黏度,促进传质效应,有利于产物的生成[8]。但是1,2-DAG为非对称结构,在热力学性质上不如对称的1,3-DAG稳定,温度过高时,1,2-DAG容易发生酰基转移反应,转变为1,3-DAG,降低得率[14]。因此,选取50℃作为最适反应温度。
2.6 反应时间对得率的影响
将高油酸葵花籽油与无水乙醇以摩尔比1∶50混合,加入占底物总质量6%的脂肪酶Lipozyme 435在50℃下催化反应不同的时间。结果如图7所示。

图7 反应时间对得率的影响
由图7可知,反应时间对得率有着显著影响。在TAG的醇解反应中,1,2-DAG为中间产物,继续反应则会转变为2-MAG,进而被醇解为甘油,1,2-DAG和2-MAG又会发生酰基转移反应,分别生成1,3-DAG和1-MAG[15]。在反应低于1 h时,1,2-DAG没有完全被合成,超过1 h后,1,2-DAG又会被继续醇解为2-MAG。Xu等[15]采用菜籽油和癸酸进行酶促酯交换反应合成结构甘三酯时,发现1,2-DAG含量在反应的1 h内处于增加阶段,超过1 h之后反而降低。Zhang等[12]采用乙醇醇解单细胞油脂合成2-MAG时,也得到了同样的结论。因此,将1 h作为最适反应时间。
3 结 论
相比化学法合成1,2-DAG,采用酶法合成可以获得更高的得率,同时显著缩短了反应时间,且不引入有毒试剂,是一种高效绿色的合成途径。通过单因素试验,获得酶法合成1,2-DAG的最优反应条件为:将高油酸葵花籽油与无水乙醇以摩尔比 1∶50混合,加入占底物总质量6%的脂肪酶Lipozyme 435在50℃下催化反应1 h。在最优反应条件下,1,2-DAG的得率可达88%。1,2-DAG粗产物经两步结晶法提纯后,可获得纯度为100%的1,2-DAG。
[1] LO S K, TAN C P, LONG K, et al. Diacylglycerol oil-properties, processesand products: a review[J]. Food Bioprocess Technol, 2008, 1(3):223-233.
[2] WRIGHT T M, HOFFMAN R D, NISHIJIMA J, et al. Leukocyte chemoattraction by 1, 2-diacylglycerol[J]. Proc Natl Acad Sci, 1988, 85(6): 1869-1873.
[3] HAYASHI K, OKUMURA K, MATSUI H, et al. Involvement of 1, 2-diacylglycerol in improvement of heart function by etomoxir in diabetic rats[J]. Life Sci, 2001, 68(13): 1515-1526.
[4] PIYATHEERAWONG W, YAMANE T, NAKANO H, et al. Enzymatic preparation of enantiomerically pure sn-2, 3-diacylglycerols: a stereoselective ethanolysis approach[J]. J Am Oil Chem Soc, 2006, 83(7): 603-607.
[5] BASRI M, KASSIM M A, MOHAMAD R, et al. Optimization and kinetic study on the synthesis of palm oil ester using Lipozyme TL IM[J]. J Mol Catal B: Enzym, 2013, 85: 214-219.
[6] KUO S J, PARKIN K L. Solvent polarity influences product selectivity of lipase-mediated esterification reactions in microaqueous media[J]. J Am Oil Chem Soc, 1996, 73(11):1427-1433.
[7] WANG X S,CHEN Y,MA Y,et al.Lipozyme 435-catalyzed synthesis of eicosapentaenoyl ethanolamide in a solvent-free system [J].J Mol Catal B: Enzym,2015,122: 233-239.
[8] WANG Z T, DU W,DAI L M,et al.Study on Lipozyme TL IM-catalyzed esterification of oleic acid and glycerol for 1,3-diolein preparation [J].J Mol Catal B: Enzym,2016,127:11-17.
[9] LI W,DU W,LI Q,et al.Dependence on the properties of organic solvent: study on acyl migration kinetics of partial glycerides [J].Bioresour Technol,2010,101(15): 5737-5742.
[10] ZHANG H, ÖNAL G, WIJESUNDERA C,et al.Practical synthesis of 1,3-oleoyl-2- docosahexaenoylglycerol by lipase-catalyzed reactions: an evaluation of different reaction routes [J].Process Biochem, 2009,44(5): 534-539.
[11] POPPE J K, MATTE C R, PERALBA M C R, et al. Optimization of ethyl ester production from olive and palm oils using mixtures of immobilized lipases[J]. Appl Catal A: General, 2015, 490: 50-56.
[12] ZHANG H, ONAL G, WIJESUNDERA C, et al. Practical synthesis of 1,3-oleoyl-2-docosahexaenoylglycerol by lipase-catalyzed reactions: an evaluation of different reaction routes [J]. Process Biochem, 2009, 44: 534-539.
[14] YANG T, FRUEKILDE M B, XU X. Suppression of acyl migration in enzymatic production of structured lipids through temperature programming[J]. Food Chem, 2005, 92(1): 101-107.
[15] XU X, MU H, SKANDS A R H, et al. Parameters affecting diacylglycerol formation during the production of specific-structured lipids by lipase-catalyzed interesterification[J]. J Am Oil Chem Soc, 1999, 76(2): 175-181.
Enzymatic synthesis of 1,2-diacylglyceride
ZHU Yuxiao,WANG Yingying,JIN Qingzhe,WANG Xingguo,WANG Xiaosan
(Collaborative Innovation Center of Food Safety and Quality Control in Jiangsu Province, School ofFood Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
The immobilized lipase Lipozyme 435 was used as catalyst to catalyze the alcoholysis of high oleic sunflower seed oil(HOSO) and absolute ethanol in a non-solvent system to synthesize 1,2-diacylglyceride(DAG). The optimal reaction conditions were obtained by single factor experiment as follows: molar ratio of HOSO to absolute ethanol 1∶50, dosage of enzyme 6%(based on the total mass of substrates), reaction temperature 50℃, reaction time 1 h. Under the optimal conditions, the yield of 1,2-DAG reached 88%.The purity of 1,2-DAG reached 100% after two-step solvent crystallization of crude product.
1,2-diacylglyceride; alcoholysis; enzymatic synthesis; Lipozyme 435
2016-05-26;
2016-10-19
江苏省自然科学基金青年基金项目(BK20150137);江苏省政策引导类计划(产学研合作)-前瞻性联合研究项目(BY2016022-33)
祝雨筱(1993),女,在读硕士,研究方向为油脂合成(E-mail)1512953503@qq.com。
王小三,副教授,硕士生导师(E-mail)958273690@qq.com。
TS225.1;TS202.3
A
1003-7969(2017)01-0056-04
