非小细胞肺癌组织中ATF3表达及其临床意义*
2017-01-16杜志明江柏青
杜志明,江柏青
(赣南医学院第一附属医院心胸外科,江西 赣州 341000)
非小细胞肺癌组织中ATF3表达及其临床意义*
杜志明,江柏青
(赣南医学院第一附属医院心胸外科,江西 赣州 341000)
目的:初步探讨非小细胞肺癌中ATF3表达与临床特征及预后的关系。方法:回顾分析我院选取98例术后病理诊断为非小细胞肺癌的患者,于2007年1月~2009年5月在我院行肺癌根治术,选取同一患者距离肺癌组织≥5 cm切缘的正常肺组织作为对照组,同时分别选取正常肺组织30例及炎性肺组织30例分别进行检测。采用免疫组化法及RT-PCR检测肺组织中ATF3表达水平,并结合肺癌患者随访数据运用Kaplan-Meier方法进行生存期分析。结果: ATF3在非小细胞肺癌中呈高表达率,ATF3表达与淋巴结转移及TNM分期有显著差异性(P<0.05)。生存分析提示ATF3的阳性组的生存期较ATF3阴性组的低(P<0.001)。结论:ATF3蛋白在非小细胞肺癌表达水平与癌旁组、正常肺组织组及炎性肺组织的表达水平有显著差异性;且ATF3蛋白表达在淋巴结转移情况和TNM分期中有相关性;ATF3表达水平可作为肺癌患者术后预后判断的指标之一。
非小细胞肺癌;ATF3;免疫组化;RT-PCR
肺癌(lung cancer,LC)是临床上最常见的恶性肿瘤之一,其发病率和死亡率都位居恶性肿瘤的前列,并且有逐年增高的趋势[1]。肺癌的发病机制尚不完全清楚,目前认为是多因素、多途径、长期共同作用的结果,包括外环境致癌因素(包括以吸烟、职业接触致癌物、生活环境等)和自身内在因素(肺部慢性疾病、自身免疫情况、遗传因素等)[2-3]。激活转录因子3(activating transcription factor 3,ATF3)属含亮氨酸拉链结构的转录因子ATF/CREB亚家族成员,它是一个应激反应诱导基因。在众多的研究发现ATF3与肿瘤有关,并且很多的证据都显示ATF3在人类肿瘤组织中有过度的表达。但在非小细胞肺癌中研究较少。
1 资料与方法
1.1 临床资料 选取2007年1月~2009年5月在赣南医学院第一附属医院行肺癌根治术患者98例,选取同一患者距离肺癌组织≥5 cm切缘的正常组织作为对照组。所有非小细胞肺癌标本均有完整的病理组织学资料和完整的临床资料。所有病例均经病理学证实,病例临床病理资料如下:男性72例,女性26例;年龄28~78岁,中位年龄56.2岁;肿瘤直径≤3 cm的51例,肿瘤直径﹥3 cm的47例。同时分别选取正常肺组织30例(取自肺大疱手术及创伤性废用肺组织)及炎性肺组织30例(包括炎性假瘤及结核球等)分别进行检测。随访至2014年5月,共随访98例,另外失访8例按截尾值处理。
1.2 检测方法 标本均经10%中性福尔马林溶液固定,石蜡包埋,4 μm连续切片。采用免疫组织化学即用型二步法染色检测非小细胞肺癌ATF3表达情况,实验条件严格一致。每例均常规HE染色。同时用非小细胞肺癌患者的手术切除肺癌组织及癌旁组织,采用半定量RT-PCR,提取RNA用Trizol法(北京TIANGEN生物技术公司)来提取组织中的ATF3,选取GAPDH作为内参照,后用紫外分光光度计检测总RNA的纯度和浓度。
PCR引物序列及扩展产物如下:ATF3(314碱基对)的引物是5′-ATGATGCTTCAACACCCAGG-3′(正义链)和5′-TTTCGGCACTTTGCAGCTG-3′(反义链)。GAPDH(280碱基对)的引物5′-CATGGGTGTGAACCATGAGAAGT-3′(正义链)和5′-GTTCAGCTCAGGGATGACCTTG-3′(反义链)。RT-PCR引物由上海英骏生物技术公司合成。循环条件:预变性94 ℃ 5 min;变性95 ℃ 15 s,退火60 ℃ 45 s,扩增72 ℃ 60 s,循环32次;延伸72 ℃ 10 min,4 ℃终止。电泳鉴定并用凝胶成像系统(GelDot-It300)照像,并用图像分析软件分析光密度值,计算相对系数。相对系数=细胞因子表达强度/GAPDH表达强度。
1.3 结果判定 免疫组化结果判定:每张切片由两位病理专家采用盲法阅片,若意见不一,则再次阅片,讨论后决定最后结果。ATF3染色定位于细胞核,胞浆内也有少量着色,细胞阳性表达判断时镜下组织细胞结构清晰,以细胞核有棕黄色颗粒沉着。判定标准参考文献[14],每个高倍镜下综合染色强度和阳性细胞所占比例,采用组织学评分(∑pi)计算积分。其中P代表将细胞阳性百分率进行半定量分级:<5%为0分;5%~50%为2分;50%~75%为3分;≥75%为4分。i代表细胞染色深浅,0为不显色或显色不清;1为浅黄色;2为棕黄色;3为深褐色。两者积分之和1~3分为弱阳性“+”,3~8分为中度阳性“++”,9~12分为强阳性“+++”。“++”及以上为阳性表达,用以计算阳性率。RT-PCR结果判断:用凝胶电泳成像分析系统观察并分析结果。在UV-254紫外透射反射分析仪上观察结果,用凝胶成像系统(GelDot-It300)照像,并用图像分析软件分析光密度值,以ATF3/GAPDH光密度比值来表示ATF3 mRNA表达水平。
1.4 统计学分析 采用SPSS 14.0统计软件包进行统计学分析,ATF3表达与临床病理关系分析结果采用χ2检验,ATF3 mRNA表达水平采用t检验来分析。根据随访结果行Kaplan-Meier生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组化显示ATF3在肿瘤细胞内的分布 ATF3主要在肿瘤细胞核内着色,也有少量在胞浆染色,呈棕黄色(图1与图2)。
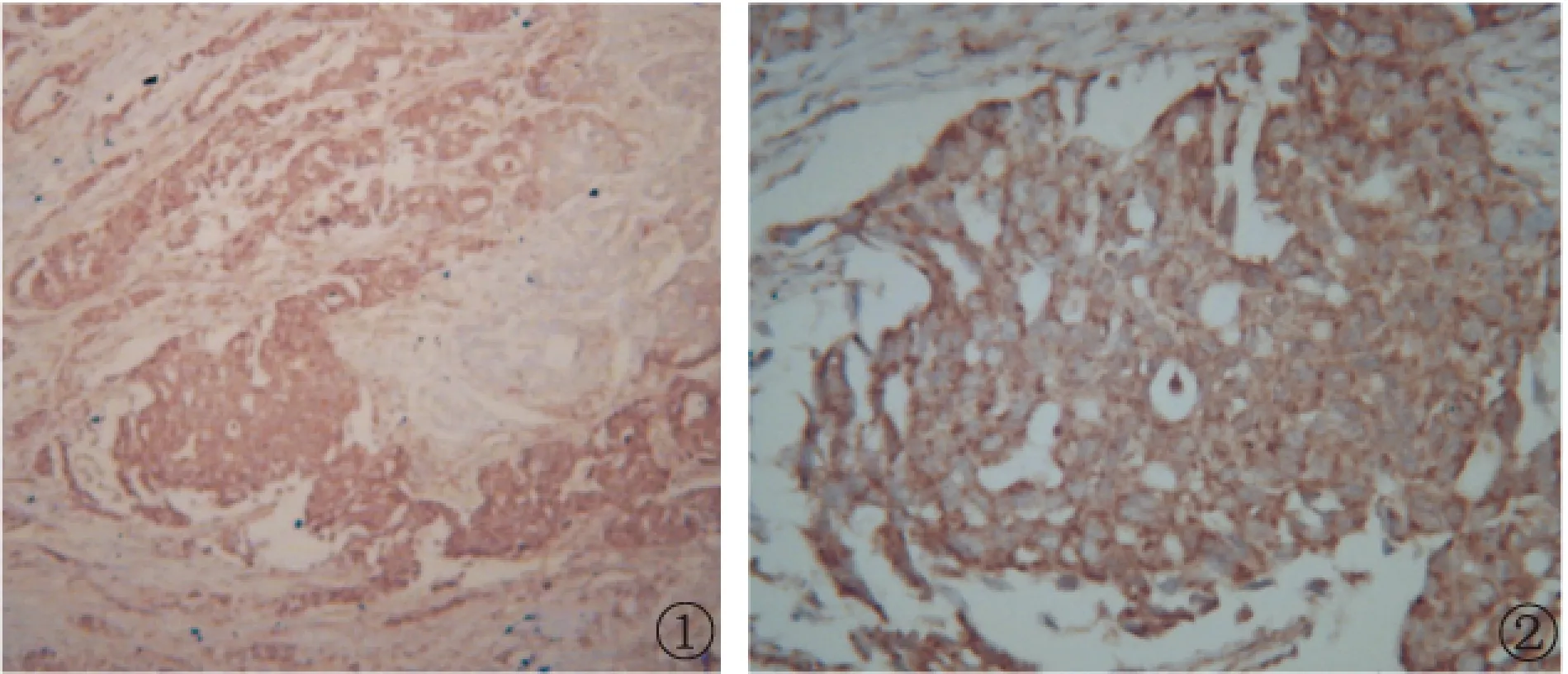
图1 非小细胞肺癌细胞核中ATF3免疫组化染色阳性IHC ×100
2.2 ATF3在非小细胞肺癌组、正常肺组织组和炎性肺组织中的表达 免疫组化结果显示:ATF3在非小细胞肺癌表达率为62.24%(61/98),而正常肺组织组的表达率为0%(0/30),炎性肺组织组的表达率10.00%(3/30),χ2=51.23,P﹤0.01,差异有统计学意义(表1)。
2.3 ATF3在非小细胞肺癌组与癌旁组中的表达 免疫组化结果显示:ATF3在非小细胞肺癌表达率为62.24%(61/98),而癌旁组的表达率为5.10%(5/98),χ2=71.638,P﹤0.01,两组比较有统计学意义(表2)。
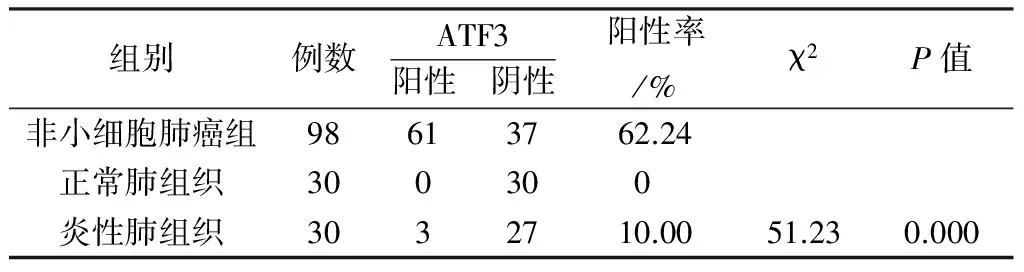
表1 非小细胞肺癌组与正常肺组织组及炎性肺组织组中ATF3的表达

表2 非小细胞肺癌组与癌旁组中ATF3的表达
2.4 ATF3表达与非小细胞肺癌临床特征的关系 免疫组化结果显示:ATF3在非小细胞肺癌表达与性别、年龄、肿瘤大小、组织学类型、分化程度无关,而与淋巴结转移情况及临床分期有关,P﹤0.05,两组比较有统计学意义(表3)。

表3 ATF3表达与非小细胞肺癌临床特征的关系
2.5 半定量RT-PCR分析ATF3 mRNA在NSCLC与癌旁正常肺组织组中表达情况
2.5.1 ATF3 mRNA在NSCLC与癌旁正常组织表达 见图3。

图3 RT-PCR:T代表肿瘤组织,N代表癌旁组织
2.5.2 半定量RT-PCR分析ATF3 mRNA在NSCLC与癌旁正常肺组织组中表达的相对值 我们用ATF3/GAPDH光密度比值来表示ATF3 mRNA表达水平。ATF3 mRNA在NSCLC和癌旁正常肺组织的相对值见表4。在98例的NSCLC组中有98例均检测出有ATF3 mRNA表达,癌旁正常肺组织组中有5例有表达。ATF3在NSCLC中的表达水平明显高于癌旁组(P<0.01)(表4)。
表4 ATF3mRNA在NSCLC与癌旁正常肺组织组中表达的相对值
2.6 ATF3阴性及阳性患者的生存曲线 在对98例ATF3表达阳性及阴性的患者进行随访,并进行Kaplan-Meier生存分析,提示ATF3阳性患者的生存期低于阴性患者,两者差异有统计学意义(P<0.001)(图4)。
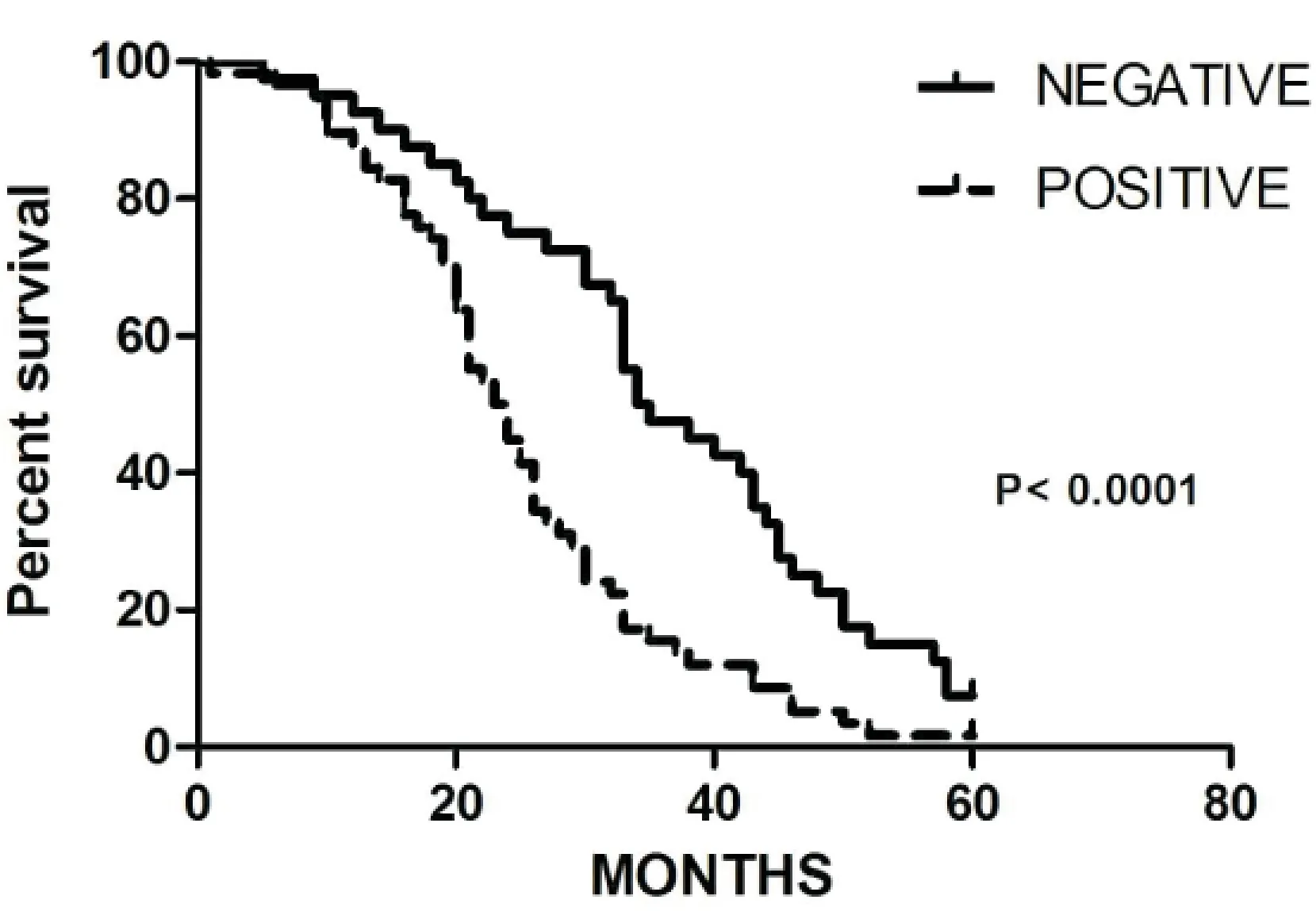
图4 Kaplan-Meier生存曲线
3 讨 论
在正常细胞向肿瘤细胞转化是多阶段、多基因参与的过程。在这些过程中涉及多个相关基因的调节和多条传导途径激活。特别是在肿瘤侵袭和转移的过程中,肿瘤细胞因为遇到许多的应激信号和损伤从而激活多条信号转导途径,通过复杂而精确的调控,产生相应的生物学反应。激活转录因子3 (ATF3)在大多数细胞中ATF3的mRNA的水平是很低的或者不能被探查出,但是它会被各种应激信号大量的诱导[4-5]。动物实验表明ATF3被诱导的信号有:缺血、缺血再灌注损伤、创伤、轴突断裂、机体受到侵袭等;在体外细胞实验中ATF3被诱导的信号包括:血清因子类、细胞因子类、遗传毒性因子、细胞凋亡诱导因子、腺病毒蛋白E1A等[4]。并且我们发现这些诱导的信号大多数都是损伤性信号,同时ATF3是在这些反应中最早的表达的转录因子之一。
本实验通过免疫组化,我们发现ATF3主要分布在非小细胞肺癌的细胞核,也有少量表达于细胞浆,染色为棕黄色颗粒。因为ATF3是一个高度保守的转运蛋白,在大多数细胞中的表达水平是很低的,但细胞在应激反应中特别是在DNA发生损害时,会发生向上的调节[6]。本组研究发现ATF3在正常及炎症肺组织基本不表达,可能是炎性刺激大部分未损伤肺组织的DNA,ATF3的传导通路未被激活,故ATF3未在正常肺组织及炎性肺组织中表达;而在炎性肺组织中的有3例有ATF3的表达,可能是炎性刺激比较强,以致炎性肺组织有癌变的倾向。
王新君等[7]研究发现在前列腺癌中ATF3表达明显高于前列腺增生组和正常前列腺组,估计ATF3表达增加为促进细胞增值和促进细胞周期及抑制凋亡的相关基因有关。本研究结果发现,ATF3在非小细胞肺癌中的表达上调,与王新君等研究结果相一致,提示ATF3在非小细胞肺癌发生和发展中起一定的作用。但同时显示ATF3在非小细胞肺癌中的表达与患者的年龄、性别、肿瘤的大小、组织学类型和分化程度关系不大(P<0.05)。
ATF3在肿瘤细胞中不仅仅表现出表达增加,而且有关研究还显示出其表达的增加可能增加肿瘤的侵袭力和能动性。Bandyopadhyay等[8]通过微阵列的研究发现Drg1能通过抑制ATF3启动子的活性来调控ATF3的表达。而ATF3的过度表达能增加在体外的前列腺癌细胞的侵袭力,更重要的是ATF3的过度表达在显著增加了前列腺细胞的肺部转移,通过下调ATF3基因的表达能抑制前列腺癌细胞的侵袭力。Janz等[9]在研究霍奇金淋巴瘤时发现ATF3在RS细胞中过度表达,而旁边的细胞未被探及染色,同时通过RNA干扰技术敲除ATF3基因,结果使霍奇金淋巴瘤细胞增殖受到了抑制,其细胞活力降低。Yin等[10]在体外研究中发现ATF3在肿瘤发展中具有两种截然相反的功能。通过增加或缺失功能的方法,发现在未转移的MCF10A乳房上皮细胞中ATF3能促进其凋亡,而在具有侵袭性的MCF10CA1a癌细胞中ATF3能保护该细胞,并能增加该细胞的能动性。ATF3在恶性肿瘤中表达对于恶性肿瘤是有利的,因为它能提高肿瘤细胞的能动性和侵袭力。本次实验结果表明,ATF3的表达与肿瘤细胞的转移情况和TNM分期有相关性。特别是在肿瘤细胞的转移情况中,ATF3的表达有显著的差异性,ATF3的阳性率随着淋巴结转移的严重程度而逐渐升高,转移情况越严重,其阳性表达率越高,并且卡方检验提示P<0.01,有显著的差异性,故可以认为ATF3的表达与肿瘤侵袭力和能动性密切相关,结果与以上研究相一致。ATF3可能参与了非小细胞肺癌的肿瘤转移,表达增加使肿瘤的侵袭力和能动性增加。
在Kaplan-Meier生存分析中,ATF3的阳性组的生存期较ATF3阴性组的低(P<0.001)。单因素分析显示,ATF3的阳性与总体的生存率有关。多因素分析显示ANXA2的表达与一些传统的因素(肿瘤分化程度、淋巴结转移情况及临床分期)密切相关。这些结果都表明,ANXA2在非小细胞肺癌患者中的高表达提示该患者预后差。
综上所述,本研究结果显示ATF3在非小细胞肺癌中表达升高,ATF3的表达与肿瘤的转移相关,与肿瘤的分级相关。ATF3的表达在肿瘤转移组中升高,并且转移的越严重表达率就越高,说明该因子在非小细胞肺癌中的发生、发展、侵袭和转移中起到重要的作用。ATF3可以作为预测非小细胞肺癌的恶性程度和预后的重要指标。ATF3在恶性肿瘤中的具体作用可能与肿瘤本身的恶性程度和所处的内环境有相关性,并且可能和机体自身的免疫功能有关。因为该基因能调控细胞周期和肿瘤的转移,若进一步研究ATF3的作用信号传导通路及分子机制,可能能揭示出非小细胞肺癌的发生、发展及转移的机制。
[1] 刘国华.河南省人群肺癌死亡特征流行病学研究[J].中国慢性病预防与控制,2001,9(4):188.
[2] 吴拥军,吴逸明,胡东生.河南省肺癌流行病学研究概述[J].中国肿瘤,2004,13(6):385-361.
[3] 陈秉颜,陈萍萍.癌危险因素的环境流行病学研究[J].环境与健康,1993,10(3):130-131.
[4] Hai T, Wolfgang C D, Marsee D K, et al. ATF3 and stress responses[J].Gene Expression,1999, 7(6):321-335.
[5] Yin T, Sandhu G, Wolfgang C D, et al. Tissue-specific pattern of stress kinase activation in ischemic/reperfused heart and kidney[J].Journal of Biological Chemistry, 1997,272(32):19943-19950.
[6] Wang A, Arantes S, Conti C, et al. Epidermal hyperplasia and oral carcinoma in mice overexpressing the transcription factor ATF3 in basal epithelial cells[J].Molecular Carcinogenesis,2007,46(6):476-487.
[7] 王新君,白培明,李远伟,等.ATF3在前列腺癌中的表达及意义[J].临床泌尿外科杂志,2008,23(11):834-836.
[8] Bandyopadhyay S, Wang Y, Zhan R, et al. The tumor metastasis suppressor gene Drg-1 down-regulates the expression of activating transcription factor 3 in prostate cancer[J].Cancer Research,2006,66(24):11983-11990.
[9] Janz M, Hummel M, Truss M, et al. Classical Hodgkin lymphoma is characterized by high constitutive expression of activating transcription factor 3 (ATF3), which promotes viability of Hodgkin/Reed-Sternberg cells[J].Blood,2006,107(6):2536-2539.
[10] Yin X,Dewille J W,Hai T.A potential dichotomous role of ATF3, an adaptive-response gene, in cancer development[J].Oncogene,2008,27(15):2118-2127.
Expression of ATF3 in the Tissue of Non-small-cell Lung Cancer and its Clinical Significance
DUZhi-ming,JIANGBai-qing
(Dept.ofCardiothoracicSurgery,theFirstAffiliatedHospitalofGannanMedicalUniversity,Ganzhou,JingXi341000)
Objectives:To observe the expression of ATF3 in non-small cell lung cancer tissues,and to investigate the relationship between ATF3 expression and clinical pathological character and prognosis in non small cell lung cancer. Methods: Retrospective analysis of 98 patients with non-small cell lung cancer diagnosed by postoperative pathology was performed,who were undergone lung cancer surgery in our hospital from January, 2007 to May,2009. Normal lung tissue of the same patient more than 5 cm away from lung cancer tissue was taken as control group.30 normal lung tissue and 30 inflammatory lung tissue were detected. RT-PCR and immunohistochemistry were used to detect the expression of ATF3 in normal lung tissues and non-small cell lung cancer, which was combined with the analysis of patient survival time. Results:ATF3 showed high expression rate in non small cell lung cancer. There was a significant difference between ATF3 expression and lymph node metastasis and TNM stage (P<0.05). Survival analysis suggested that the survival time of ATF3 positive group was lower than that of ATF3 negative group (P<0.001). Conlusion: The expression level of ATF3 protein and those of the adjacent group in non-small cell lung cancer, normal lung tissue and inflammatory lung tissue have significant difference; the protein expression of ATF3 is correlated with the lymph node metastasis and TNM staging; ATF3 expression can be used as one of the indicators of prognosis of patients with lung cancer.
non-small-cell lung cancer;ATF3;RT-PCR;immunohistochemistry
江西省教育厅科研基金资助项目(编号:GJJ10576)
江柏青,男,教授、主任医师。E-mail:jwt12345@163.com
R734.2
A
1001-5779(2016)06-0891-05
10.3969/j.issn.1001-5779.2016.06.015
2016-07-18)(责任编辑:敖慧斌)
