3'-大豆苷元磺酸钠对大鼠脑缺血损伤后IL-10表达的影响*
2017-01-16刘宗亮李良东王振文黄志华刘瑞珍
刘宗亮,黎 晓,李良东,杨 琴,王振文,黄志华,刘瑞珍,肖 海
(赣南医学院 江西省脑血管疾病重点实验室,江西 赣州 341000)
3'-大豆苷元磺酸钠对大鼠脑缺血损伤后IL-10表达的影响*
刘宗亮,黎 晓,李良东,杨 琴,王振文,黄志华,刘瑞珍,肖 海
(赣南医学院 江西省脑血管疾病重点实验室,江西 赣州 341000)
目的:探讨3'-大豆苷元磺酸钠(DSS)对缺血再灌注损伤大鼠调节性T淋巴细胞因子IL-10表达的影响。方法:制作大鼠大脑中动脉栓塞脑缺血再灌注损伤模型,缺血后10 min,于舌下静脉给予1.0 mg·kg-1和2.0 mg·kg-1的DSS。缺血2 h,再灌注24 h后,TTC染色法测定脑梗死体积,干湿重法检测脑组织含水率,酶联免疫学方法测定血清及缺血侧脑组织血清白介素-10(IL-10)的含量,免疫组织化学及Western blot方法检测缺血半损伤区皮层组织IL-10蛋白的表达。结果:模型组大鼠出现明显的脑梗死灶,脑组织含水率升高,血清及脑组织IL-10含量降低;DSS治疗后,血清及脑组织IL-10含量升高。结论:DSS可通过提高调节性T淋巴细胞因子IL-10的表达,抑制脑缺血再灌注损伤后炎症反应。
3'-大豆苷元磺酸钠;脑缺血再灌注损伤;白介素-10;炎症反应
脑卒中疾病发展过程中的病理损伤机制非常复杂。炎症反应、氧化应激、能量代谢障碍及谷氨酸等兴奋性氨基酸的毒性反应、钙超载、线粒体功能紊乱等多种机制参与了其病理过程[1-3]。其中,炎症反应在脑缺血再灌注损伤中起着至关重要的作用。因此,采取有效的干预措施调节炎症应答过程,减轻神经细胞的损伤,是防治脑缺血再灌注损伤的一个重要策略。3'-大豆苷元磺酸钠(3'-daidzein sulfonate sodium,DSS)系中药葛根的主要有效成分——大豆苷元的结构修饰体。课题组前期研究发现,DSS可通过抑制氧化应激及促炎细胞因子IL-6水平,对脑缺血再灌注损伤起保护作用[4-5]。研究表明,调节性T淋巴细胞通过抑炎细胞因子IL-10抑制缺血后炎症反应,对脑缺血起保护作用[6]。DSS对脑缺血再灌注损伤大鼠的神经保护作用是否也可通过上调IL-10的水平,从而抑制脑缺血再灌注后炎症反应?
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠,SPF级,体重250~280 g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2011-0003。
1.1.2 主要试剂 3'-大豆苷元磺酸钠(C15H9O7SNa)为白色结晶粉末,由沈阳药科大学天然药物化学教研室提供(纯度>99%),实验前用双蒸水稀释至所需浓度。2,3,5-氯化三苯基四氮唑(2,3,5-tripheyltetrazolium, TTC)(Sigma公司)、IL-10 ELISA试剂盒及SABC免疫组化试剂盒(武汉博士德生物工程有限公司)。
1.2 实验方法
1.2.1 实验分组与大鼠脑缺血再灌注损伤模型的制备 实验大鼠按数字随机法分成4组:假手术组(sham组)、脑缺血再灌注损伤模型组(model组)、DSS(1.0, 2.0 mg·kg-1)治疗组。大鼠用10%水合氯醛溶液(350 mg·kg-1,ip)麻醉,参照Longa等[7]的方法制备大脑中动脉栓塞模型。假手术组大鼠只暴露和分离颈总动脉、颈外动脉和颈内动脉,不闭塞大脑中动脉。术中控制室温在23 ℃~25 ℃。药物治疗组于缺血后10 min分别经由舌下静脉注射1.0 mg·kg-1和2.0 mg·kg-1的DSS,sham组和model组给予等体积的生理盐水。
1.2.2 脑片制作和TTC染色 脑缺血再灌注24 h后,用上述方法麻醉大鼠,断头取脑,去除嗅球、小脑和低位脑干。置于大鼠脑模具中,以视交叉处为中心,沿冠状面2 mm厚切片,连续5片,将脑片迅速置于1%的TTC染色液中,避光下,37 ℃孵育箱孵育30 min。染色结果为脑梗死区呈白色,非梗死区呈玫瑰红色。将染色后脑片置于4%多聚甲醛(paraformaldehyde)中固定,滤纸吸干脑片表面水分后按顺序摆放,数码相机拍照。
1.2.3 脑组织含水率测定 另取大鼠按上述相同方法制备模型及给药后,断头取脑,去除嗅球、小脑和低位脑干。生理盐水洗净后,滤纸吸干表面水分,电子天秤称量脑湿重,将脑组织在105 ℃,24 h条件下烘干、称脑干重。计算脑组织含水率(%)=(脑湿重-脑干重)/脑湿重×100%。
1.2.4 酶联免疫吸附试验 脑缺血再灌注24 h后,麻醉后腹腔静脉取血,4 ℃,3 000转离心10 min,取血清,-80 ℃保存。取缺血侧脑组织,于冰浴中制备10%的脑组织匀浆,4 ℃,3 500转离心10 min,取上清,-80 ℃保存。严格按上述试剂盒说明操作,酶免法测定血清和脑匀浆组织上清液中IL-10的含量。
1.2.5 免疫组织化学方法 脑缺血再灌注24 h后,大鼠麻醉后,行组织内固定后取前脑,4%多聚甲醛固定24 h后,梯度酒精脱水、二甲苯透明、石蜡包埋、5 μm厚切片。切片脱蜡至水,免疫组化SABC法检测缺血半损伤区脑组织中IL-10的表达,严格按免疫组化试剂盒说明书操作。DAB显色,苏木素复染,中性树胶封片,光镜下观察。细胞质染色为棕黄色颗粒判定为阳性细胞。
2 结 果
2.1 DSS对脑缺血再灌注损伤大鼠脑梗死范围的影响 TTC染色后,左侧大脑梗死灶区呈白色,分布在额顶部皮质和尾壳核。依图显示,1.0 mg·kg-1DSS和2.0 mg·kg-1DSS治疗后均能缩小脑梗死范围,以高剂量组(2.0 mg·kg-1)效果最佳(见图1)。
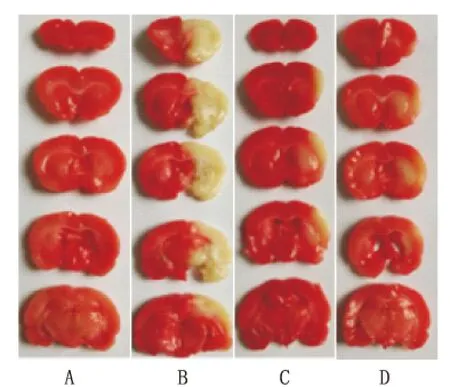
A为sham组,B为model组,C为1 mg·kg-1DSS组,D为2 mg·kg-1DSS组。
图1 DSS对脑缺血再灌注损伤大鼠脑梗死范围的影响
2.2 DSS对脑缺血再灌注损伤大鼠脑组织含水率的影响 与假手术组比较,模型组大鼠脑组织含水率明显升高(P<0.001),DSS治疗后脑组织含水率降低,其中1.0 mg·kg-1DSS及2.0 mg·kg-1DSS组与模型组比较有统计学差异(P<0.05)(图2)。
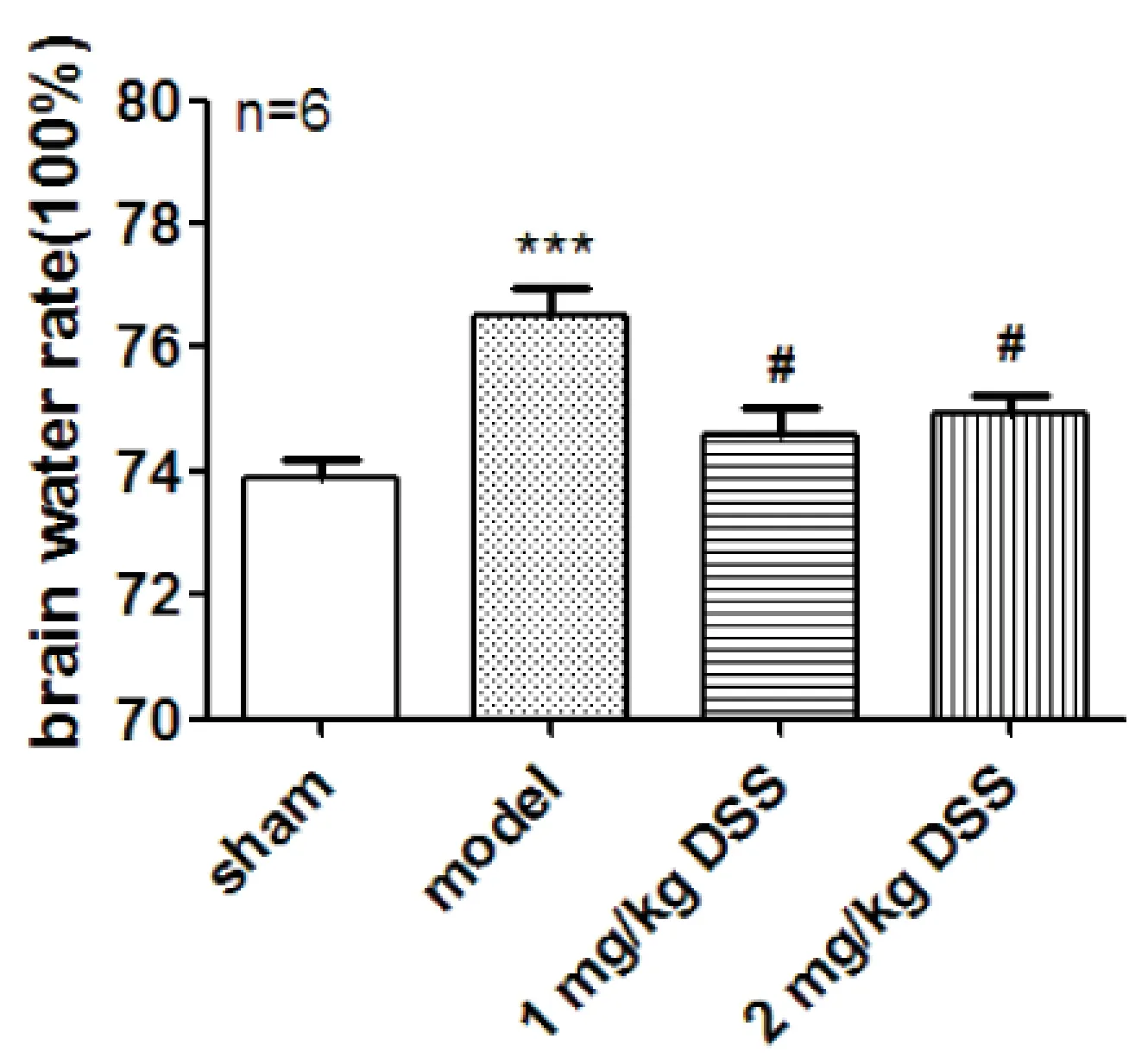
注:***P<0.001与假手术组比较,#P<0.05与模型组比较。
2.3 DSS对脑缺血再灌注损伤大鼠IL-10的影响 模型组大鼠血清(P<0.001)及脑组织(P<0.05)IL-10含量降低,DSS治疗后,血清及脑组织IL-10含量升高(P<0.05)(图3,4)。免疫组化染色后,显微镜下观察细胞胞浆呈棕黄色为阳性细胞,定位于神经细胞及胶质细胞,假手术组可见大量强阳性细胞,而模型组仅见少量弱阳性细胞,DSS治疗组则较模型组阳性细胞数增加明显(图5)。
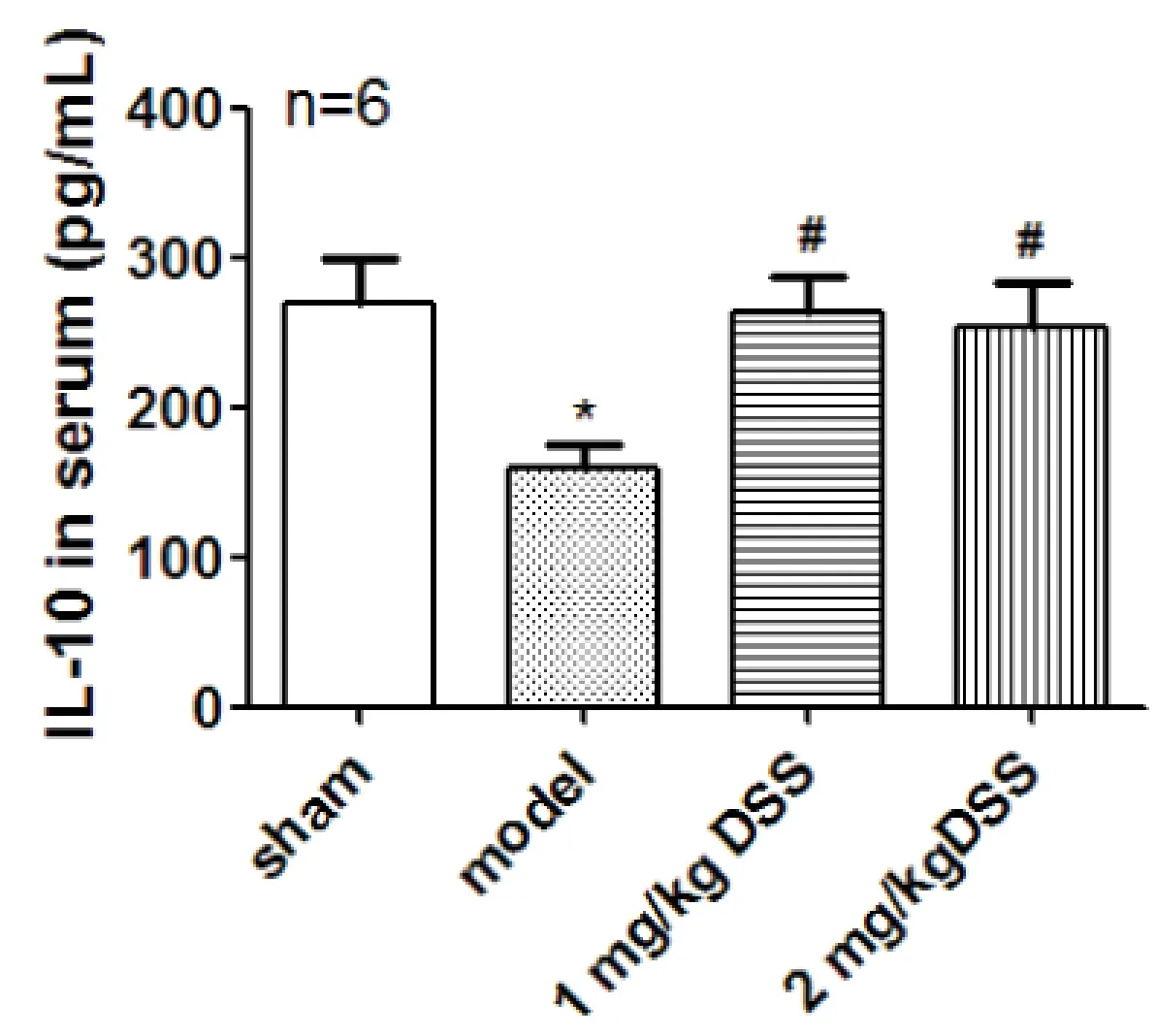
注:*P<0.05与假手术组比较,#P<0.05与模型组比较。
图3 DSS对脑缺血再灌注损伤大鼠血清IL-10含量的影响
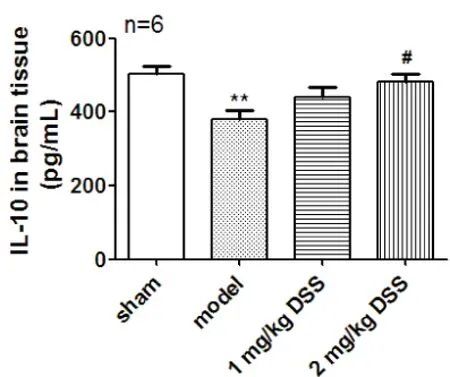
注:**P<0.01与假手术组比较,#P<0.05与模型组比较。
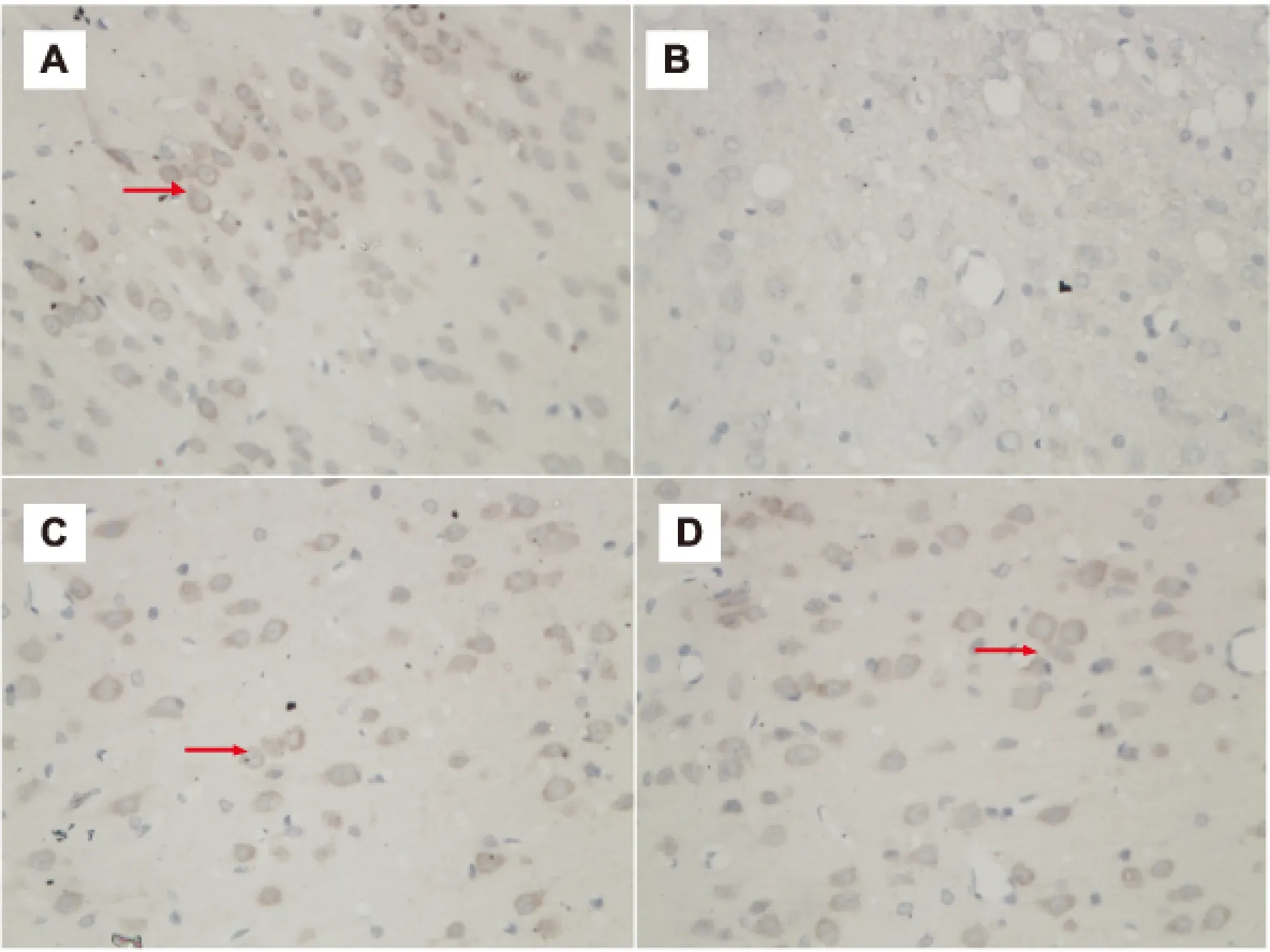
图5 DSS对脑缺血再灌注损伤大鼠脑组织细胞IL-10表达的影响(免疫组化染色,×40)
3 讨 论
自Setehell和Adlerereutz首次证实异黄酮和木醋体与哺乳动物雌激素结构的相似性,并阐述它们可能具有防癌作用以来,植物雌激素就受到人们的广泛关注[8]。近年来的研究发现,植物雌激素表现出很好的抗脑中风作用[9]。本实验结果表明,植物雌激素大豆苷元的结构改造物DSS处理后,降低大鼠脑梗死范围,提示其对脑缺血再灌注损伤有保护作用。
在脑缺血再灌注损伤发展过程中,炎症反应起重要作用。炎性细胞浸润、脑水肿形成、各种细胞因子和黏附因子的产生,以及基质金属蛋白酶等均与脑梗死的过程密切相关[10]。在脑缺血再灌注损伤情况下,中枢损伤局部及外周血中炎性反应相关信号均呈活化状态,炎性细胞因子参与了脑缺血再灌注损伤过程中中枢神经系统的损伤及损伤修复过程,在中枢神经系统疾病发生发展过程中发挥着关键作用[11]。另外,调节性T淋巴细胞通过抑炎细胞因子IL-10抑制缺血后炎症反应,促进神经干细胞增生,对脑缺血起保护作用[6,12-13];脑室内注射IL-10后,下调脑缺血再灌注损伤活化的炎症信号通路[14]。可见调节性T淋巴细胞及其细胞因子是脑缺血再灌注损伤后炎症反应重要的负调控因子。
本实验结果显示,DSS可明显降低脑组织含水率,提示其可通过抑制炎症反应对大鼠脑缺血再灌注损伤起保护作用。DSS可降低缺血侧脑组织促炎细胞因子IL-6水平[5],升高血清及脑组织中抑炎细胞因子IL-10的含量或表达,证明DSS能通过抑制炎症反应对脑缺血再灌注损伤大鼠起保护作用。
综上所述,DSS能有效对抗脑缺血再灌注时引起的炎症反应,其作用机制可能与提高调节性T细胞分泌抗炎细胞因子IL-10有关。然而,DSS对调节性T细胞及IL-10的调控机制鲜有报道,还有待于进一步研究。
[1] Vaibhav K,Shrivastava P,Javed H,et al.Piperine suppresses cerebral ischemia-reperfusion induced inflammation through the repression of COX-2,NOS-2 and NF-κB in middle cerebral artery occlusion rat model[J].Mol Cell Bionchem,2012,367(1-2):73.
[2] McAdams RM,Juol SE.The role of cytokines and inflammatory cells in perinatal brain injury[J].Neurol Res Int,2012,56:84.
[3] Vakili A,Sharifat S,Akhavan MM,et al.Effect of lavender oil (Lavandula angustifolia) on cerebral edema and its possible mechanisms in an experimental model of stroke[J].Brain Res,2014,1548:56.
[4] 李良东,黄志华,曾靖,等.DSS对脑缺血再灌注损伤的保护与抗氧化作用的关系[J].中风与神经疾病杂志,2009,26(4):407.
[5] 钟声,曾靖,李良东,等.3′-大豆苷元磺酸钠对大鼠脑缺血/再灌注损伤时IL-6的影响[J].时珍国医国药,2011,22(2):292.
[6] Liesz A,Suri-Payer E,Veltkamp C,et al.Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke[J].Nat Med,2009,15(2):192.
[7] Longa E Z,Weinstein P R,Carlsons,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1): 84.
[8] Rose VL.AAP issues recommendations for the use of soy protein-based formulas in infant feeding[J].Am Fam Physician,1998,57(11):2876.
[9] Aras AB,Guven M,Akman T,et al.Neuroprotective effects of daidzein on focal cerebral ischemia injury in rats[J].Neural Regen Res,2015,10(1):146.
[10] Liao SL,Chen WY,Raung SL,et al.Association of immune responses and ischemic brain infarction in rat[J].Neuroreport,2001,12(9):1943.
[11] Bai S,Hu Z,Yang Y,et al.Anti-inflammatory and neuroprotective effects of triptolide via the NF-κB signaling pathway in a rat MCAO model[J].Anat Rec,2016,299(2): 256.
[12] Wang J,Xie L,Yang C,et al.Activated regulatory T cell regulates neural stem cell proliferation in the subventricular zone of normal and ischemic mouse brain through interleukin 10[J].Front Cell Neurosci,2015,9:361.
[13] Liesz A,Zhou W,Na SY,et al.Boosting regulatory T cells limits neuroinflammation in permanent cortical stroke[J].J Neurosci,2013,33(44):17350.
[14] Liesz A,Bauer A,Hoheisel JD,et al.Intracerebral interleukin-10 injection modulates post-ischemic neuroinflammation: an experimental microarray study[J].Neurosci Lett,2014,579:18.
Effects of 3'-daidzein sulfonate on IL-10 Expression After Focal Cerebral Ischemia in Rats
LIUZong-liang,LIXiao,LILiang-dong,YANGQing,WANGZhen-wen,HUANGZhi-hua,LIURui-zhen,XIAOHai
(GannanMedicalUniversity,KeyLaboratoryofCerebrovascularDiseasesofJiangxiProvince,Ganzhou,Jiangxi341000)
Objective: To investigate the effect of 3'-Daidzein Sulfonate Sodium (DSS) on IL-10, an anti-inflammatory cytokine secreted by regulatory T cells, in cerebral ischemia/reperfusion injury. Method: A rat middle cerebral artery occlusion (MCAO) model was established. 10 minutes after ischemia, 1.0 mg·kg-1and 2.0 mg·kg-1DSS were given via the sublingual vein. After 2 h of ischemia and 24 h of reperfusion, brain water rate was calculated by the wet and dry weight method. Serum and brain tissue interleukin-10 (IL-10) content were examined by enzyme linked immunosorbent assay. The IL-10 protein expression in the ischemic penumbra region of cortical tissue was detected by immunohistochemistry and western blot assay. Result: DSS decreased cerebral infarct size and water content in rats with cerebral ischemia/reperfusion injury. It also significantly increased serum and brain tissue IL-10 content in the ischemic penumbra region. Conclusion: DSS can inhibit the inflammatory response after cerebral ischemia reperfusion injury through the increase of regulatory T cells factor, the expression of IL-10.
3'-Daidzein Sulfonate Sodium; cerebral ischemia/reperfusion; IL-10; inflammatory response
国家自然科学基金项目(NO:81560583);江西省自然科学基金项目(NO:20142BAB205021);江西省教育厅科技项目(No.GJJ13679);江西省卫生厅项目(No.20155659)
肖海,副教授,硕士研究生导师,从事心脑血管疾病研究。E-mail:xh669168@sina.com
R285.5
A
1001-5779(2016)06-0846-04
10.3969/j.issn.1001-5779.2016.06.003
2016-12-08)(责任编辑:敖慧斌)
