牛乳铁蛋白肽及其衍生肽生物活性与研究进展
2017-01-14郭爱珍吕自力钟浩胡曼王亮
郭爱珍,吕自力,钟浩,胡曼,王亮
(1.江苏大学食品与生物工程学院,江苏镇江212013,2.成都中医药大学第二附属医院成都610041)
牛乳铁蛋白肽及其衍生肽生物活性与研究进展
郭爱珍1,吕自力2,钟浩1,胡曼1,王亮1
(1.江苏大学食品与生物工程学院,江苏镇江212013,2.成都中医药大学第二附属医院成都610041)
牛乳铁蛋白肽(LfcinB)是牛乳铁蛋白N-端在正常的消化环境下水解产生的25个氨基酸残基的短肽,具有广谱高效的抗细菌性,抗病毒,抗肿瘤等多种生物活性。作为一种新型抗菌肽,LfcinB及其衍生肽具有很大的研究价值和潜在的应用价值。对其结构及生物学活性进行介绍,并对近年来采用基因工程技术表达LfcinB及其衍生肽的方法技术进行了综述。
牛乳铁蛋白肽;衍生肽;生物活性;基因工程
0 引 言
乳铁蛋白是广泛存在于哺乳动物乳腺的天然转铁糖蛋白,与血浆中铁离子的传递密切相关。牛乳铁蛋白(bovine lactoferrin,LfB)是铁传递蛋白家族成员之一,由689个氨基酸残基组成,分子量约为80 ku,具有高效抗菌,消炎,抑制肿瘤细胞生长及调节机体免疫等生物功能。牛乳铁蛋白肽(bovine Lactoferricin,LfcinB)最初是由日本学者Bellamy W[1,2]等人从牛乳铁蛋白N端17-41处获得的阳离子抗菌肽,分子量3126.4 u,疏水残基比例48%,电荷数+8,显示其抗菌活性是天然LfB的400多倍。LfcinB是一种新型的两亲性阳离子抗菌肽,疏水性与正电荷数是决定其抗菌效果的主要因素[3]。通过调整LfcinB正电荷数以及疏水性比例获得的牛乳铁蛋白肽衍生肽LfcinBD越来越多的运用于基因工程技术中使其高效大量表达。由于LfcinB及其衍生肽的广谱抗菌性,抗病毒,抗肿瘤,良好的耐热性,无抗原性,对肠道有益菌无害等众多生物学活性,作为食品保存剂、抗氧化剂、营养强化剂、免疫强化剂、免疫调节剂等在食品领域得到广泛的应用[4]。
1 牛乳铁蛋白肽及其结构
安美忱等人利用高效液相色谱-基质辅助激光解吸电离串联飞行时间质谱分离得到高活性的LfcinB,相对分子质量为3124.89,蛋白质量浓度为18.20μg/mL[5]。LfcinB含25个氨基酸残基:FKCRRWQWRMKKLGAPSITCVRRAF,具有广谱抗菌、抗病毒、免疫调节等作用。包括2个色氨酸,5个精氨酸和3个赖氨酸等正电荷氨基酸,p I约为11.84。其中在两个半胱氨酸残基处通过二硫键连接成环状,如图1所示。LfcinB在牛乳铁蛋白分子中呈α螺旋结构,当解离下来后α螺旋结构消失转变成以β折叠为主的两亲性结构,利用RCSB Protein Data Bank-RCSB PDB数据库分析LfcinB结构(图2)也表明,LfcinB是两亲性分子结构,疏水性和亲水性氨基酸分别排列于β折叠片层的两侧,而这种结构对于LfcinB发挥其强大的抗菌功能是至关重要的[6]。

图1 LfcinB一级结构:红色代表带正电荷氨基酸

图2 LfcinB二级结构
2 牛乳铁蛋白肽及其衍生肽的生物学活性
作为一种有生物活性的短抗菌肽,LfcinB具有普通抗生素所不具有的一些优点,例如广谱抗菌性能和不易产生耐药性问题等特点。而且,它在抑制病毒、真菌和肿瘤细胞的方面也有一定的生物活性,同时,对真核细胞几乎是无毒性的。
2.1 广谱抗菌性
LfcinB除不能参与铁代谢外,具备完整乳铁蛋白的所有生物学活性。有研究表明,虽然其抗病毒能力不如完整乳铁蛋白,但其抗菌性却比完整乳铁蛋白强400多倍[1,7]。LfcinB抗菌活性主要表现为广谱的抑菌和杀菌作用。正电荷氨基酸是抗菌肽与负电荷的细菌细胞壁及细胞质膜直接作用发挥抗菌效果所必需的,而与脂双层亲脂区域相互作用需要疏水氨基酸残基的参与,以产生孔洞或其它的去稳结构导致膜的去极化或局部瓦解甚至细菌死亡。
Bellamy等[8]研究了LfcinB的抗菌谱和抗菌效果,所选择包括G+和G-、杆菌和球菌、专性需氧菌,兼性厌氧菌和专性厌氧菌,如大肠杆菌(Escherichiacoli)、肠炎沙门氏菌(Salmonella enteritidis)、奇异变形杆菌(Proteus mirabilis)、肠炎沙门氏菌(Salmonella enteritidis)、肺炎克雷伯氏菌(Klebsiella pneumoniae)铜绿假单胞菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、突变链球菌(Streptococcus mutans)、白喉棒状杆菌(Corynebacterium diphtheriae)、双歧杆菌(Bifidobacterium)等28种菌株。结果如表1所示。
由表1可以看出,除对荧光假单胞菌和粪肠道球菌没有抑菌作用外,对其他生长的检测菌株均有不同程度的抑制作用,而且抑菌效果与培养基和菌株有关,其有效抑菌质量浓度范围在0.6~45μg/mL之间,且G+对LfcinB比G—更为敏感。
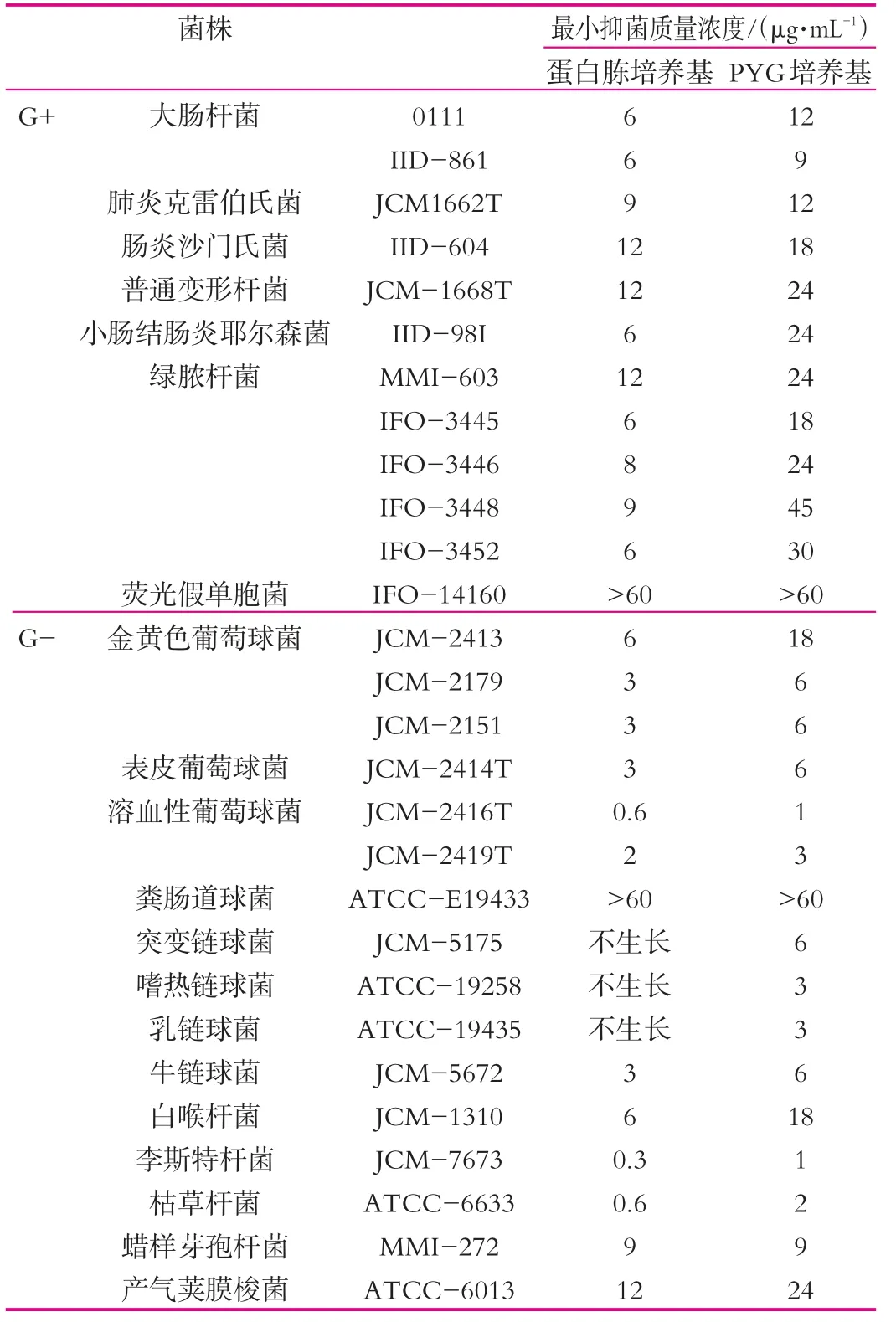
表1 牛乳铁蛋白肽主要抗菌谱
LfcinB除了对大多数细菌有抑杀作用外,还对某些真菌有抑制作用[9,10],如白色念珠菌等,对白色念珠菌JCM-2900、白色念珠菌JCM-1542T的最小抑菌浓度(MIC)均为18μg/mL。
2.2 抗病毒生物活性
较完整的乳铁蛋白来说,LfcinB的抗细菌性和抗真菌性高得多,但LfcinB在体外的抗病毒活性却较乳铁蛋白低,大概是完整乳铁蛋白的1/7。由于分子环状结构对Lfcin抗病毒活性十分重要,而线性化的LfcinB和LfcinH则抗病毒活性丧失[11]。具体的LfcinB抗病毒作用机制还不是很清楚,可能是LfcinB与细胞表面的病毒受体或共受体相互作用,从而降低病毒的感染率。但病毒感染包括吸附、侵入、脱壳、生物合成、组装和释放多个阶段,而最有效的抗病毒药剂是能够影响吸附以及核酸复制阶段从而发挥作用。Andersen等[12]研究发现,LfcinB与阿昔洛韦联合使用,能够增强阿昔洛韦的抗病毒作用。张晓宇等[13]用pljm 1-LfcinB载体、△8.91载体、pvsvg载体三质粒共转染包装细胞293T细胞,包装产生重组慢病毒载体,得到悬液滴度为2×108TU/mL的浓缩病毒,Western blot检测到目的肽的成功表达,为进一步研究LfcinB在抗癌细胞作用机制和基因治疗奠定了基础。多个研究均表明,LfcinB具有一定的抗病毒功能,具体的作用机制还有待进一步的探讨。
2.3 抗肿瘤生物活性
关于LfcinB抗肿瘤作用的研究主要都集中于探讨其诱导肿瘤细胞凋亡作用机制[14],作为一种阳离子抗菌肽,其可通过与肿瘤细胞暴露出的带净负电荷的磷脂酰丝氨酸PS结合,以及肿瘤细胞质膜磷脂头部成分的丢失导致的不对称性,击穿肿瘤细胞膜,启动细胞凋亡途径最终使其凋亡[15]。
王静等人分析了LfcinB对Jurkat细胞增殖周期、细胞表面分化抗原表达水平的作用[16]。用LfcinB处理过的Jurkat细胞随着LfcinB浓度增加,处于G 1/G 0期的Iurkat细胞百分率明显上升,S期的细胞百分率明显下降,细胞表面分化抗原CD llb表达水平显著升高。研究结果表明,LfcinB能够通过细胞周期阻滞Jurkat细胞增殖,进而诱导其分化。该研究为LfcinB抗白血病的研究提供了理论基础。石皖荣等[17]人研究了牛乳铁蛋白抗菌肽(LfcinB)抗人肺癌细胞功能及其作用机制,他们采用MTT法检测LfcinB对人肺腺癌A 549细胞增殖的影响作用,通过流式细胞仪测定细胞周期和凋亡率。结果表明,LfcinB能显著抑制人肺腺癌A549细胞增殖,使细胞阻滞于S期,并诱导细胞凋亡。其中,当LfcinB质量浓度为10-2g/L时抑制率最高。Shusheng Wang[18]等人的研究发现LfcinB能够在转录和翻译水平抑制肺癌H 460细胞VEGF(血管内皮细胞生长因子)及凋亡抑制基因的表达,并在小鼠体内成功抑制H460肿瘤细胞生长;利用双变量流式细胞仪通过Annexin V/PI双染色法得到的散点图表明LfcinB能够有效的诱导细胞凋亡,当LfcinB质量浓度为80μg/mL时,H460细胞凋亡率约达71.7%。结果表明LfcinB有可能是治疗肺癌的潜在药物。类似地,minjia Sheng[19]等研究了LfcinB9(WQWRMKKLG)诱导人卵巢癌SK-OV-3细胞凋亡的机制,研究发现LfcinB9成功的抑制了小鼠体内SK-OV-3细胞的增殖,并得出LfcinB9通过上调活性氧成分以及在转录和翻译水平上激活半胱氨酸蛋白酶-3,半胱氨酸蛋白酶-9的表达来诱导细胞凋亡。
综上所述,一方面,牛乳铁蛋白肽LfcinB的高效广谱抗菌性,抗肿瘤以及免疫调节等功能使得其在食品添加剂领域以及婴幼儿配方奶粉的功能性因子方面有很大的应用价值;另一方面,近年来全球关于抗生素耐药性的威胁已经亟需控制,找到新的抗菌性药物已经迫在眉睫[20],LfcinB则是极具潜力的无耐药性威胁的新型抗生素。因此,LfcinB及其衍生肽在食品,药品,化妆品,动物饲料等诸多领域有着广阔的应用前景[21]。
3 牛乳铁蛋白肽及其衍生肽基因工程表达研究进展
由于天然分离LfcinB产量低,工艺复杂,费用较高,人工合成LfcinB及其衍生物成本更高,无法大规模生产,成为LfcinB广泛应用的制约因素。因此,利用转基因技术将LfcinB及其衍生肽转入其他生物表达,是解决生产生活中LfcinB来源不足最具潜力的途径。目前表达LfcinB或LfcinB衍生肽应用最多的表达系统包括两大类,分别是大肠杆菌表达系统和毕赤酵母表达系统。对两大系统以及国内外学者利用两大系统表达LfcinB及衍生肽进行介绍。
3.1 大肠杆菌表达系统
大肠杆菌作为表达外源基因受体菌,有着许多优点:大肠杆菌培养简单,繁殖迅速,遗传稳定,可利用大量的商业化表达载体,操作方便。而且对其在遗传学,生物化学和生理学方面都有了较为充分的认识,全基因组测序,共有4405个开放型阅读框架,被美国FDA批准为安全的基因工程受体生物。因此已广泛用于外源蛋白的生产,且蛋白表达量较高。
而利用大肠杆菌构建重组牛乳铁蛋白或LfcinB的表达系统已有研究,Isui和Jose等[22]人对比了人乳铁蛋白和牛乳蛋白的三维结构的差别,并成功克隆了牛乳铁蛋白的cDNA基因,与硫氧还蛋白组成融合蛋白,构建pET 32-bLf重组表达载体,转入E.coliBL21 (DE3)进行表达,经过镍柱分离纯化后,获得的重组牛乳铁蛋白的产量为15.3 mg/L,纯度为90.3%。由于LfcinB抗菌效果大大强于牛乳铁蛋白,因此更不乏大肠杆菌表达LfcinB的研究。例如,为了能够获得成本低的LfcinB,姚海燕等[23]利用大肠杆菌表达系统克隆表达牛乳铁蛋白十肽及其突变体,为基因工程抗真菌肽的制备奠定了基础。Z i-gang Tian[24]等人设计合成LfcinB15-W 4,10衍生肽多聚体序列,插入表达载体pET32a,IPTG诱导表达,其中LfcinB15-W 4,10蛋白表达量最高,高于10 mg/L,回收纯度在99%以上。Xingjun Feng[25]等利用大肠杆菌表达融合了谷胱甘肽转移酶GST标签的LfcinB-W 10,表达量为20 mg/L,纯度为90%。分离纯化后的LfcinB-W 10产量达300μg/L,且对金黄色葡萄球菌有明显的抑菌活性。他们还合成杂合的牛乳铁蛋白肽-天蚕素A,即(LF15-CA 8)n(n=1-6)的多聚体,构建pGEX-4T-LCn(n=1–6)载体,转入大肠杆菌BL21 (DE3)表达。IPTG诱导表达后,获得含有? GST-LF15-CA8和GST-(LF15-CA8)2的包涵体,纯化后获得10.0 mg/L,纯度高于97%。LF15-CA 8对革兰氏阳性菌(金葡菌)的抗性高于LfcinB以及CA-8,并且在有效抗菌浓度范围内对人红细胞没有显示出明显的溶血活性[26]。
虽然大肠杆菌表达系统是目前掌握最为成熟的表达系统,能够在较短时间内获得基因表达产物,且所需成本相对较低。但是大肠杆菌缺乏对真核生物蛋白质的复性及修饰加工系统,例如,在原核表达系统中抗菌肽的二硫键无法正确形成,影响了蛋白的正确折叠使得大肠杆菌表达系统常常无法获得有活性的目的产物;抗菌肽无法得到酰胺化修饰,从而降低产物活性[27]。另外,内源性的蛋白酶降解空间构象异常的外源蛋白,加上细胞周质内含有种类繁多的内毒素,均会对目的蛋白的表达产生不利影响。
4.2 巴斯德毕赤酵母表达系统
巴斯德毕赤酵母表达系统是20世纪80年代初期发展起来的一种新型的外源蛋白表达系统,能高效表达重组蛋白。作为真核生物,毕赤酵母具有高等真核表达系统的许多优点,如蛋白加工、折叠及翻译后修饰等特点[27]。它比杆状病毒或哺乳动物组织培养等其他真核表达系统更快捷、简单、廉价,且表达水平更高,已越来越广泛的应用于DNA重组技术中。
毕赤酵母是甲醇营养型酵母,可以利用甲醇作为唯一碳源。图1显示了甲醇代谢途径[28],最初的甲醇代谢在专门微体膜,过氧化物酶体内进行,随后的代谢步骤是在细胞质中进行的。中间产物甲醛是在毕赤酵母甲醇和甲胺通路共有的。甲醛在AOX 1通路中是由酒精氧化酶(AOX)与过氧化氢(H2O2)作用产生的。在甲胺通路中是由胺氧化酶(AmOX)与H2O2和NH3的作用产生的。
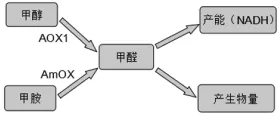
图3 甲醇代谢途径
毕赤酵母表达系统具有一系列优点:首先,醇氧化酶(A1coholoxidase,AOXⅠ)基因的强启动子特别适合于外源基因的调控表达;其次,所应用的表达载体为整合型穿梭质粒,外源基因可以在大肠杆菌中进行扩增,之后通过质粒整合到毕赤酵母基因组,不易丢失,能够稳定表达;最后,毕赤酵母自身分泌到培养基中的蛋白较少,简化了后期蛋白质的分离纯化操作[29]。下表列举了用巴斯德毕赤酵母表达系统生产的外源蛋白产品[28]。
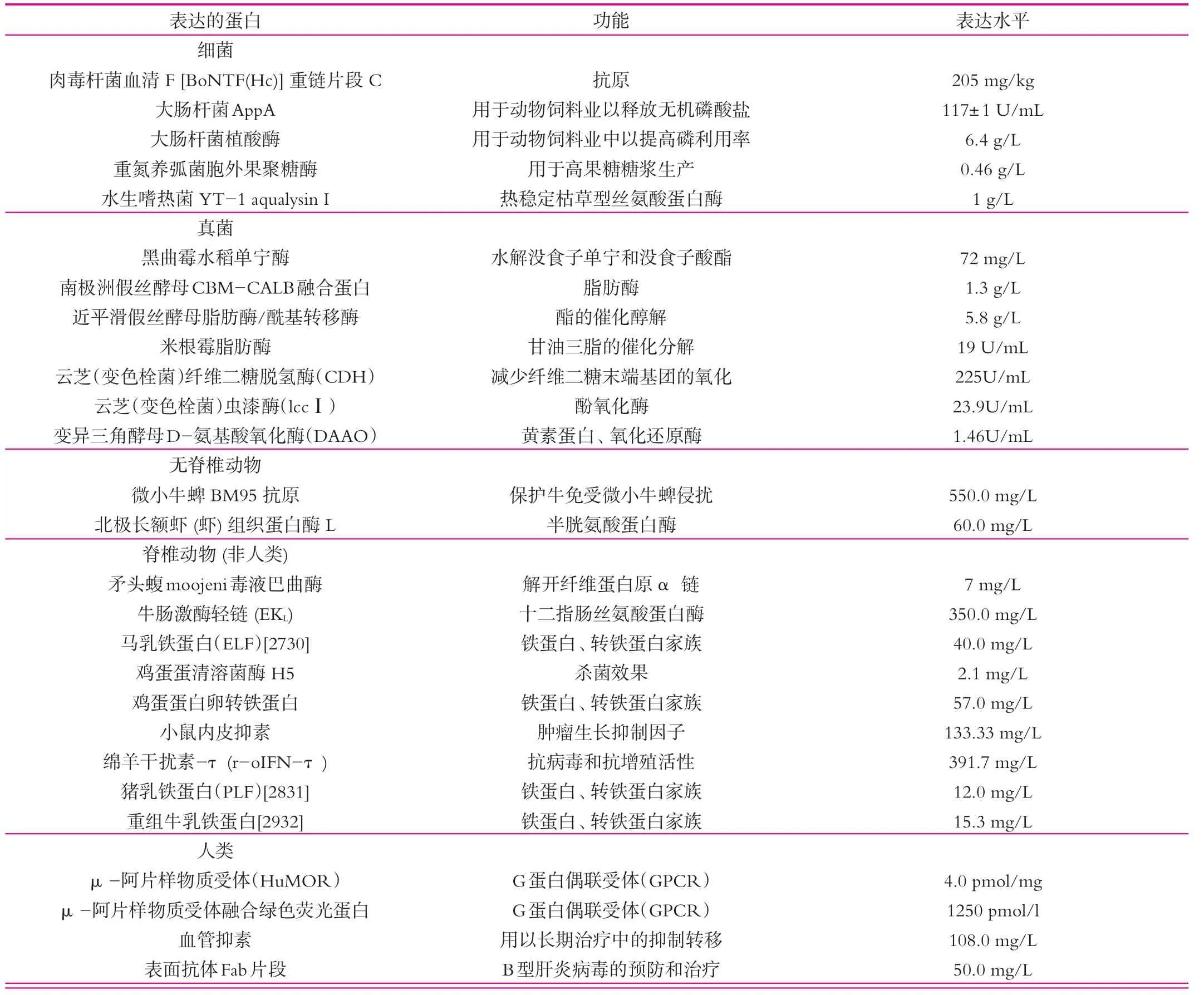
表2 巴斯德毕赤酵母表达系统生产的外源蛋白产品

(续表2)
众多研究表明,在以毕赤酵母为宿主菌的抗菌肽外源表达中,多数研究都实现了目的蛋白的生产且产物对工程菌没有明显的抑制作用,且可以得到有生物活性的目标蛋白。然而由于毕赤酵母自身蛋白酶的降解作用以及所表达目标蛋白的不稳定性等因素,制约着毕赤酵母表达系统的应用。为了提高表达水平,研究学者采用了各种不同的表达策略,如融合表达、改造后表达等,都有一定的预期结果。已有利用巴斯德毕赤酵母表达系统表达LF或LFcin的研究。Choi等[33]用毕赤酵母表达人乳铁蛋白来评估N末端多聚糖结构对免疫反应的影响。Sue-Hong Wang[34]等人利用毕赤酵母表达重组猪乳铁蛋白,获得约12 mg/L的表达量。Chen[35]等构建四种重组山羊乳铁蛋白肽,GLFcin,GLFcin-(H is)6-Tag,GLFcin II和GLFcin II-(H is)6-Tag,克隆到毕赤酵母表达载体pPICZαC上,转化毕赤酵母SM D 1168H,这四种肽均获得表达。用CM-Sepharose(不含H is-tg),H isT rap(含H is-tg)以及Sephadex G-25 chrom atographies分离纯化后可获得0.15 mg/mL的重组蛋白,对大肠杆菌BCRC 11549、铜绿假单胞菌BCRC 12450、蜡状芽孢杆菌BCRC 10603、金黄色葡萄球菌BCRC 25923、痤疮丙酸杆菌BCRC 10723以及产单核细胞李斯特菌? BCRC 14845均有较高的抑菌活性,最小抑菌浓度从4.07到16.00 mg/mL不等。林松涛[36]等成功克隆了牛乳铁蛋白基因的N-lobe的碱基序列,并成功构建了酵母表达载体,为下一步转化进行酵母表达奠定了基础。易俊波等人[37]将LfcinB基因片段克隆到分泌型表达载体pPIC 9K中,得到重组质粒,线性化电转毕赤酵母SM D 1168。通过遗传霉素G 418筛选获得多拷贝阳性转化子,经甲醇诱导后,LfcinB在酵母中获得了表达,表达产物具有较强的杀菌作用。ChahardooliM[38]等构建pH IL-LFcinC表达载体,利用毕赤酵母表达系统生产重组亚洲骆驼乳铁蛋白肽,结果显示对大肠杆菌,金黄色葡萄球菌,枯草芽孢杆菌,绿脓杆菌,白色念珠菌均有显著的抑菌活性。
5 展 望
而LfcinB作为一种新型的抗菌肽,于食品行业,LfcinB是天然的抑菌和抗氧化成分,可作为婴幼儿奶粉添加剂,亦可作为调节免疫功能因子,添加到食品保健品中;于医药行业,LfcinB可治疗疾病的辅助药物,发挥其抗病毒抗肿瘤活性;此外,在生化研究方面,动物饲料行业,化妆品领域等也有着广阔的应用价值。利用基因工程技术手段表达LfcinB及其衍生肽业已成为趋势,而如何使LfcinB及其衍生肽高效表达成为研究重点。本研究拟通过分析LfcinB空间结构与生物活性的关系,优化设计LfcinB基因获得LfcinB衍生肽,利用真核表达系统进行表达活性分析,,并对培养温度,甲醇浓度,培养时间等发酵条件进行优化使其能够高效表达,为提高LfcinB衍生肽的外源表达量作出有益的探索。
[1]BELLAMY W,TAKASE M,YAMAUCH I K,et al.Identification of the bactericidal domain of lactoferrin[J].Biochim Biophys Acta, 1992,1-2(1121):130-136.
[2]WAKABAYASHI H,TAKASE M,TOM ITA M.Lactoferricin derived from milk protein lactoferrin[J].Current Phamaceutical Design, 2003,9(16):1277-1287.
[3]PANTELEEV P V,BOLOSOV IA,BALANDIN SV,et al.Structure and Biological Functions ofβ-Hairpin Antimicrobial Peptides [J].Acta Naturae,2015,7(1):37-47.
[4]韩兆莲,许晓曦.新型食品添加剂LfcinB对肿瘤细胞生长的抑制作用[J].食品研究与开发,2014,35(23):17-20.
[5]安美忱,刘宁.高效液相色谱-基质辅助激光解吸电离串联飞行时间质谱分离鉴定牛乳铁蛋白素[J].色谱,2010,28(2):180-184.
[6]FARNAUD S,EVANSR W.Lactoferrin-amultifuncitional protein w ith antim icrobial properties[J].M olecular Immunology,2003,40(7): 395-405.
[7]GIFFORD JL,HUNTER H N,VOGEL H J.Lactoferricin:a Lactoferrin-derived peptidew ith antimicrobial,antiviral,antitumor and immunological properties[J].Cellular and M olecular Life Science,2005, 62(22):2588-2598.
[8]BELLAMYW,TAKASEM,WAKABASHIK.Antibacteria spectrum of lactoferricin B,a potent bactericldal peptide derived from the N-terminal region of bovine lactoferrin[J].Applied Bacteriology, 1992,73:472-479.
[9]YAMAUCHIK,TOM ITA M.,GIEHL T J,et al.Antibacterial activity of lactoferrin and a pepsin-derived lactoferrin peptide fragment[J]. Infect.Immun,1993,61:719-728.
[10]BELLAMY W,YAMAUCHIK,WAKABAYASHIH,et al.Antifungal propertiesof lact-oferricinB,apeptide derived from the N-terminal region of bovine lactoferrin[J].Lett.Appl.M icrobiol,1994,18: 230-233.
[11]贾洪锋,贺雅非,刘丽娜,等.乳铁蛋白及其生理功能.粮食与油脂, 2006,2:44-47.
[12]ANDERSEN J,GUTTEBERG T J.Lactoferrin and lactoferricin inhibitherpessimplex 1 and 2 infection and exhibit synergy when combined w ith acyclovir[J].AntiviralRes,2003,58(3):209-215.
[13]张晓宇,秦宜德,张文晓,等.牛乳铁蛋白肽基因LfcinB的慢病毒载体的构建及鉴定[J].安徽医科大学学报,2011,46(7):709-712.
[14]张铁男,杨巍,刘宁.牛乳铁蛋白素对Jurkat细胞和HFL-I细胞生物学特性的影响[J].营养学报,2009,31(53):465-469.
[15]FADOK V,CATHELINEAU A,DALEKE D,et al.Loss of phospholipid asymmetry and surface exposure of phosphatidylserine is required for phagocytosis of apoptotic cells by macrophages and fibroblasts[J].BiolChem,2001,276(2):1071-1077.
[16]王静,赵宁,李萌,等.流式细胞术分析牛乳铁蛋白素对Jurkat细胞增殖、分化的影响[J]中国乳品工业,2014,42(5):9-12.
[17]石皖荣,邓松华,秦宜德,等.牛乳铁蛋白抗菌肽抗肺癌细胞增殖及其作用机制研究[J].安徽医科大学学报,2013,48(8):877-881.
[18]WANG S,TU J,ZHOU C,et al.The effect of Lfcin-B on non-small cell lung cancer H 460 cells is mediated by inhibiting VEGF expression and inducing apoptosis[J].Archives of pharmacal research,2014,38(2):261-271.
[19]SHENG M,ZHAO Y,ZHANG A,et al.The effect of LfcinB9 on human ovarian cancer cell SK-OV-3 ismediated by inducing apoptosis[J].Journal of Peptide Science,2014,20(10):803-810.
[20]ROCA I,AKOVA M,BAQUERO F.The global threat of antimicrobial resistance:science for intervention[J].New Microbes New
[21]JENSSEN H.Anti herpes simplex virus activity of lactoferrin/lactoferricin-an example of antiviral activity of antimicrobial protein/peptide [J].Cell Mol Life Sci,2005,62(24):3002-3013.
[22]GARAIA M I,SALAZAR M J,AREVALO G S,et al.Expression and characterization of recombinant bovine lactoferrin in E.coli[J]. Biometals,2013,26(1):113-122.
[23]姚海燕,韩跃武,张雪燕,等.牛乳铁蛋白十肽的基因改造、克隆及表达[J].中国生物制品学杂志,2008,21(7):568-571.
[24]TIAN Z,TENG D,YANG Y,et al.Multimerization and fusion expression of bovine lactoferricin derivative LfcinB15-W4,10 in Escherichiacoli[J].Applied microbiology and biotechnology,2007,75(1): 117-124.
[25]FENG X,LIU C,GUO J,et al.Expression and purification of an antimicrobial peptide,bovine lactoferricin derivative LfcinB-W10 in Escherichia coli[J].Current microbiology,2010,60(3):179-184. [26]FENG X J,XING LW,LIU D,et al.Design and high-level-expression of a hybrid antimicrobial peptide LF15-CA8 in Escherichia coli[J].Journal of industrial microbiology&biotechnology,2014,41 (3):527-534.
[27]TOWNESC L,MICHAILIDISG,NILEC J,et al,Induction of cationic chicken liver-expressed antimicrobial peptide 2 in response to Salmonella enterica infection[J].Infect Immum,2004,72(12): 6987-6993.
[28]MACAULEY P S,FAZENDA ML,MCNEILl B,et al.Heterologous protein production using the Pichia pastoris expression system [J].Yeast,2005,22(4):249-270.
[29]PANG S Z,OBERHAUS S M,RASMUSSEN J L,et al.Expression of a gene encoding a Scorpion insectotoxin peptide in yeast,bacteria and plants[J].Gene,1992,116(2):165-172.
[30]PARAMSIVAM M,SARAVANAN K,UMA K,et al.Expression, purification and characterization of equine lactoferrin inPichia pastoris[J].Prot Exp Purif,2002,26(1):28–34.
[31]WANG SH,YANG T S,LIN SM,et al.Expression,characterisation and purification of recombinant porcine lactoferrin in Pichia pastoris[J].Prot Exp Purif,25(1):41–49.
[32]GARCIA M I,SALAZAR M J,AREVALO G S,et al.Expression and characterization of recombinant bovine lactoferrin in E.coli[J]. Biometals,2013,26(1):113-122.
[33]CHOI B K,ACTOR J K,RIOSS,et al.Recombinant human lactoferrin expressed in glycoengineered Pichia pastoris:effect of terminal N-acetylneuraminic acid on in vitro secondary humoral immune response[J].Glycoconjugate journal,2008,25(6):581-593.
[34]WANG SH,YANG T S,LIN SM,et al.Expression,Characterization,and Purification of recombinant Porcine Lactoferrin in Pichia pastoris[J].Protein Expr Purif.2002,25(1):41-49.
[35]CHEN G H,CHEN W M,HUANG G T,et al.Expression of recombinant antibacterial lactoferricin-related peptides from Pichia pastoris expression system[J].Journal of agricultural and food chemistry, 2009,57(20):9509-9515.
[36]林松涛,张居农,王亮,等.牛乳铁蛋白基因N-lobe的cDNA克隆及毕赤酵母表达载体的构建[J].家畜生态学报,2008,29(5):13-18.
[37]易俊波,黄德新,李凌云,等.抗菌肽牛乳铁多肽素(LfcinB)在毕赤酵母中的表达及活性鉴定[J].微生物学报,2007,34(2):265-269.
[38]CHAHARDOOLI M,NIAZI A,ARAM F,et al.Expression of recombinant Arabian camel lactoferricin-related peptide in Pichia pastoris and its antimicrobial identification[J].Journal of the Science of Food and Agriculture,2015.
Biological activity and research progress of Bovine Lactoferricin and derived pep tide
GUO Ai-zhen1,LV Zi-li2,ZHONG Hao1,HU Man1,WANG Liang1
(1.School of Food and Biological Engineering,Jiangsu University,Zhen jiang 212013,China)
(2.The Second Affiliated Hospital of Chengdu University of Traditional Chinese Medicine,Chengdu 610041,china)
Abstrcat:Bovine Lactoferricin(LfcinB)is a short peptide containing 25 amino acid residues and under normal digestive environment it can be released from the N-terminal of Bovine Lactoferrin(LfB).It has many probiotic features,such as broad-spectrum antibacterial,antiviral, antitumor and other biological activities.As a new antibacterial peptide,has a great deal of research value and potential application value.The structure and biological activity of LfcinB and its derived peptides are Introduced,and the expression methods of Lfcin B and its derived peptides using genetic engineering technology in recent years are reviewed.
Bovine Lactoferricin;derived peptides;biological activities;genetic engineering
TS252.1
B
1001-2230(2016)05-0022-06
2015-09-11
四川省科研院所科技成果转化项目(15010116),江苏大学高级专业人才科研启动资金(12JDG069)。
郭爱珍(1990-),女,硕士,主要从事牛乳铁蛋白肽的研究。
王亮
