微柱离心法测定克拉霉素离子对脂质体注射液的包封率
2017-01-14耿思聪龚昊宇刘小林程志博
耿思聪,龚昊宇,许 航,刘小林,程志博,袁 悦
微柱离心法测定克拉霉素离子对脂质体注射液的包封率
耿思聪1,2,龚昊宇1,许 航1,刘小林1,程志博1,袁 悦1*
(1. 沈阳药科大学药学院,辽宁沈阳 110016 2. 上海恒瑞医药有限公司制剂研究所,上海 200245)
目的 考察微柱离心法测定克拉霉素离子对脂质体包封率的可行性。方法选用葡聚糖凝胶G-50 (Sephadex G-50)微柱离心法将克拉霉素脂质体和外水相中游离克拉霉素分离,测定脂质体中克拉霉素的含量,计算克拉霉素离子对脂质体的包封率。结果克拉霉素含量测定的线性范围为50~600 mg∙LP-1P,空白脂质体在葡聚糖凝胶G-50中无吸附作用,游离克拉霉素能够实现与克拉霉素脂质体的分离, 3批样品的平均包封率为94.2%。结论微柱离心法可作为克拉霉素离子对脂质体注射液包封率测定的有效测定方法。
药剂学;脂质体;微柱离心法;克拉霉素;包封率
克拉霉素(clarithromycin,CLA, 化学结构式见图1)为大环内酯类抗生素。CLA属于广谱抗生素,临床可用于敏感菌引起的扁桃体炎、急性咽炎、社区获得性肺炎、中耳炎、口腔感染、鼻窦炎、百日咳、白喉、军团菌肺炎和非典型病原体肺炎等P[1]P。为提高克拉霉素的溶解度,降低它的静脉刺激性及相关不良反应,通常将克拉霉素制备成脂质体或脂肪乳剂P[2-4]P。包封率是衡量克拉霉素脂质体质量和制备工艺的重要指标之一,由于克拉霉素属于油水均难溶性药物P[5]P,故采用超滤离心法无法准确测定克拉霉素脂质体的包封率。同时,超高速离心法具有设备上的限制,不能广泛使用。因此,作者首先制备了克拉霉素离子对脂质体,并利用微柱离心法测定了克拉霉素离子对脂质体的包封率。

Fig. 1 The chemical structure of clarithromycin
图1克拉霉素化学结构式
1 仪器与材料
HITACHI紫外分光光度计、HITACHI 高效液相色谱仪(包括chromaster-5110泵、chromaster-5210自动进样器、chromaster-5310柱温箱和chromaster-5410紫外检测器)(日本日立公司),PF-101T 集热式恒温磁力搅拌器、SHZ-D(Ⅲ)循环水式真空泵(河南巩义予华仪器有限公司),电热恒温水浴锅(北京长风仪器仪表公司),FA1104N电子分析天平(上海民桥精密科学仪器有限公司),80-2 离心机(上海手术器械厂),N-1001EYELAP®P旋转蒸发仪(上海爱郎仪器有限公司),ATS高压均质机、ATS脂质体膜挤出器(上海ATS工业系统有限公司),NicompTM 380 动态光散射粒度测定仪(Santa Barbara,USA PSS),Diamond CB18B色谱柱(250 mm×4.6 mm,5 μm)(迪马公司),JEM-2100透射电子显微镜(日本电子,JEOL)。
克拉霉素(浙江华宜制药厂),注射用蛋黄卵磷脂PC-98T(上海艾韦特医药科技有限公司),胆固醇琥珀酸单酯(北京百灵威科技有限公司),葡聚糖凝胶 G-50(Sigma-Aldrich中国公司),磷酸二氢钾、三乙胺、乙腈(康科德试剂公司),其余试剂(分析纯,市售)。
2 方法与结果
2.1 克拉霉素离子对脂质体的制备
采用薄膜分散-高压均质法制备克拉霉素脂质体。称取处方量的卵磷脂PC-98T、克拉霉素和胆固醇琥珀酸单酯,用适量无水乙醇充分溶解,转移至圆底烧瓶中。使用旋转蒸发仪除去无水乙醇后,可见脂质薄膜均匀分布于圆底烧瓶底部。用事先预热好的pH值7.4 的磷酸盐缓冲液为水化介质。在60 ℃条件下水化30 min,得脂质体粗分散体系。将脂质体粗分散体系转移至高压均质机中进行均质,以冰水浴控制均质温度在40 ℃以下,5 800 psi均质8次。将所得脂质体转移至脂质体膜挤出器进行过膜除菌,装瓶,氮气灌封,即得克拉霉素离子对脂质体注射液,规格为1 mL,其中含药5 mg。
2.2 克拉霉素离子对脂质体的初步表征
取克拉霉素离子对脂质体样品适量,用重蒸馏水稀释5 000倍后,用NICOMP 380 粒度测定仪对其进行粒度和电位的测定。结果平均粒径为(70.1 ± 2.3) nm (=3),电位为-42.05 mV。
用pH计对所得制剂进行测量,得pH值为7.95 ± 0.02 (=3)。
取克拉霉素离子对脂质体样品适量置于铜网中,利用磷钨酸对样品进行负染色,将干燥后的铜网置于透射电镜观察。克拉霉素离子对脂质体的透射电镜图见图2。
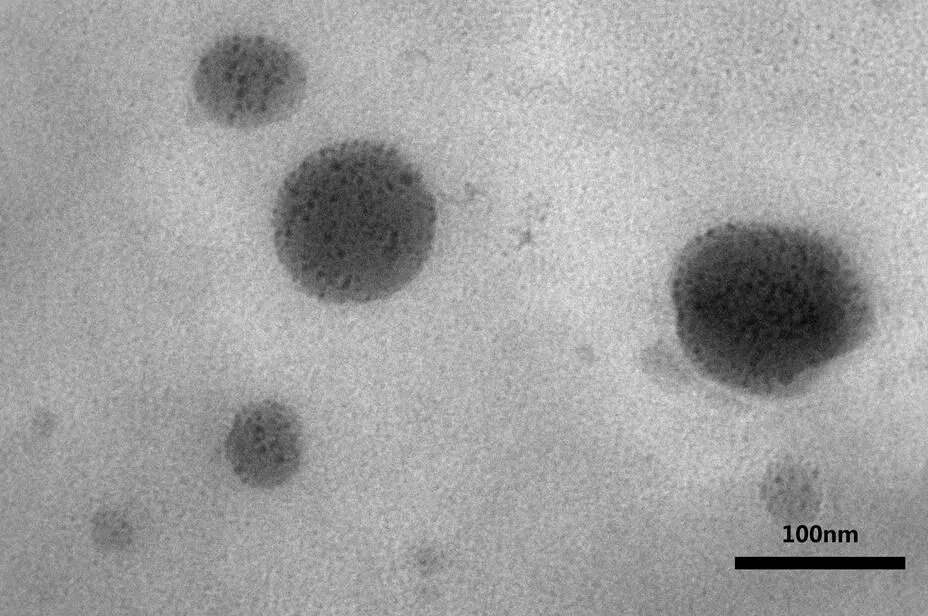
Fig. 2 TEM photograph of CIP-Lip(accelerating voltage 200 kV,×80 000)
图2克拉霉素离子对脂质体透射电镜图(加速电压200 kV,×80 000)
2.3 分析方法的建立
2.3.1 色谱条件
色谱柱:Diamond CB18B柱(250 mm×4.6 mm,5 μm);流动相:磷酸盐缓冲液(取磷酸二氢钾4.55 g,加水溶解并稀释至500 mL,加三乙胺1 mL,用磷酸调节pH值至5.5)-乙睛(体积比3∶2),0.45 µm微孔滤膜过滤;流速:1.0 mL·minP-1P;检测波长:210 nm;柱温:45 ℃;进样量:20 μL。理论塔板数以克拉霉素计不低于3 000P[6]P。
2.3.2 专属性试验
取空白脂质体(blank liposome,BL)溶液、克拉霉素溶液。用乙醇破坏脂质体结构,适当稀释后进样分析。图3表明,在“2.3.1”条色谱条件下,克拉霉素与脂质体辅料能达到基线分离,保留时间为11.2 min。
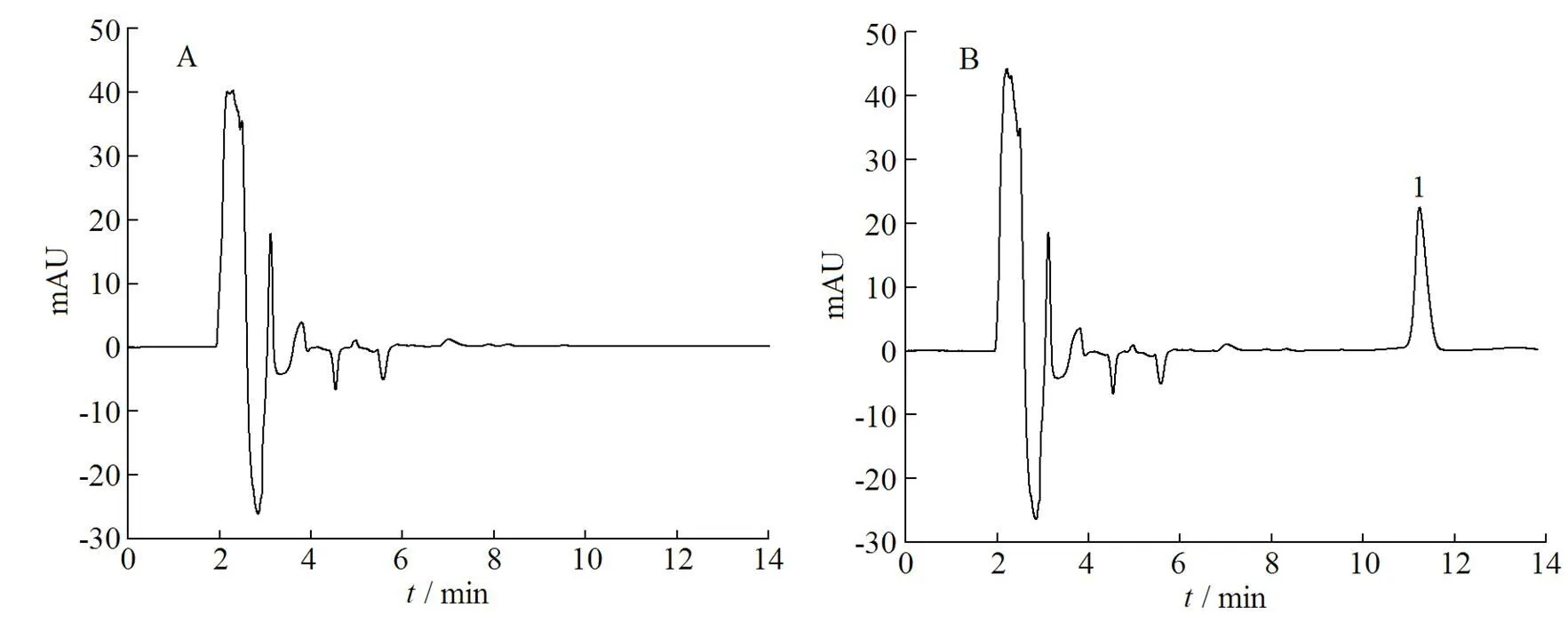
1—Clarithromycin
2.3.3 线性关系考察
精密称取克拉霉素对照品100 mg,置于50 mL量瓶中,加无水甲醇溶解,并稀释至刻度,分别移取0.25、0.5、1.0、1.5、2.0、2.5和3.0 mL置于10 mL量瓶中,加无水甲醇稀释至刻度,摇匀。取20 μL进样测定,记录峰面积。以峰面积()为纵坐标,以质量浓度(,mg∙LP-1P)为横坐标进行线性回归,通过计算得回归方程= 1. 202 9×10P3P-7×10P-10P,= 0.995 5。
结果表明,在本色谱条件下,克拉霉素质量浓度在50~600 mg∙LP-1P内与峰面积线性关系良好,=0.995 5。
2.3.4 精密度试验
分别配制质量浓度为100、300和500 mg∙LP-1P的高中低3种质量浓度的标准溶液各6份,按“2.3.1”条色谱条件连续进样分析6次,RSD分别为1.2%、0.85%和0.92%,均小于2%,表明日内精密度良好。
2.3.5 回收率试验
在1 mL空白脂质体溶液中分别加入克拉霉素对照储备液适量,配制成相当于克拉霉素脂质体质量浓度5 g∙LP-1P的80%、100%和120%的低中高3种质量浓度的物理混合制剂。用无水甲醇稀释成质量浓度为160、200和240 mg∙LP-1P的溶液各3份,取20 µL进样分析。结果回收率分别为100.19%、100.05%和100.54%,RSD分别为0.53%、0.46%和0.65%。
2.4 微柱离心法方法学研究
2.4.1 葡聚糖凝胶柱的制备
微柱离心组件(mini-column centrifugation system,MCCS),包括:1 mL注射器、脱脂棉、葡聚糖凝胶和塑料试管。
Sephadex G-50在蒸馏水中浸泡过夜,充分溶胀,载入1.0 mL注射器中(注射器底部填充脱脂棉以防葡聚糖凝胶泄漏)。将装有Sephadex G-50的注射器装入塑料试管中,组成微柱离心组件。将MCCS转移至离心机中,于2 000 r∙minP-1P离心4 min,使凝胶柱失水紧缩,备用。
2.4.2 微型离心柱对空白脂质体的吸附作用
取空白脂质体溶液100 µL置于10 mL量瓶中,用重蒸水稀释并定容至刻度。将略带乳光的样品置于分光光度计中,于波长500 nm处测定吸光度(B前B);另取空白脂质体溶液100 µL,加至微型凝胶柱的顶端,于2 000 r∙minP-1P离心4 min,并继续在凝胶柱顶端加入重蒸水200 µL,于2 000 r∙minP-1P离心4 min,连续操作3次。将塑料试管中的洗脱液转移至10 mL量瓶中,用重蒸水稀释并定容至刻度。将略带乳光的样品置于分光光度计中,于波长500 nm处测定吸光度(B后B)。重复操作3次,结果见表1。

Table 1 The absorption of blank liposome on Sephadex G-50 column
Sephadex G-50对空白脂质体的回收率经3次离心洗脱后可达到98%以上,且RSD小于2%,重现性良好。因此将包封率测定方法中的洗脱次数定为3次。
2.4.3 微型离心柱对水溶液中克拉霉素的吸附作用
克拉霉素溶液的配制:将克拉霉素溶解在磷酸溶液中,然后用1 mol·LP-1P氢氧化钠溶液调节pH值到6.5、质量浓度约5 g∙LP-1P,得克拉霉素水溶液。取上述溶液100 µL置于凝胶柱顶端,按“2.4.2”条离心处理,洗脱。所得洗脱液按“2.3.1”条色谱条件进样分析,计算洗脱液中药物浓度。重复操作6次。结果显示,只有质量分数不足1%的克拉霉素被洗脱下来,RSD小于2%。因此可以利用Sephadex G-50微型柱完成脂质体与游离克拉霉素的分离。
2.4.4 微型离心柱对空白脂质体和克拉霉素水溶液的分离
考虑到空白脂质体对游离药物可能会有物理吸附,进而影响包封率的测定。故作者考察了微型离心柱对空白脂质体与克拉霉素溶液的物理混合物的吸附情况。
物理混合物的制备:将空白脂质体用磷酸调节pH值至2.0,将克拉霉素溶解于其中,然后用1 mol·LP-1P氢氧化钠溶液调节pH值到6.5、质量浓度约5 g∙LP-1P,得物理混合物。取物理混合物100 µL置于凝胶柱顶端,按“2.4.2”条离心处理,洗脱。将过柱前后的物理混合物分别用无水乙醇适当稀释,破坏脂质体的结构,得到均一的溶液。将此溶液按“2.3.1”条色谱条件进样分析,计算洗脱液中药物质量浓度。重复操作6次,结果见表2P[7]P。
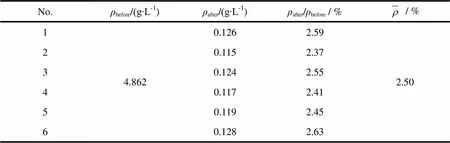
Table 2 Separation of the mixture of blank liposome and clarithromycin using minicolumn of Sephadex G-50
Notes:BbeforeB—The concentration of clarithromycin before the column elution;BafterB—The concentration of clarithromycin after the column elution
2.5 包封率的测定
2.5.1 微柱离心法
取克拉霉素离子对脂质体注射液100 µL,用乙醇破坏脂质体结构,定容于10 mL量瓶中,进样分析,计算过柱前的药物质量浓度(B前B)。另取克拉霉素离子对脂质体注射液100 µL,加至葡聚糖凝胶柱顶端,于2 000 r∙minP-1P离心4 min,连续洗脱3次;将洗脱液合并至10 mL量瓶中,用乙醇破坏脂质体结构并定容,进样分析,计算过柱后的药物质量浓度(B后B)。包封率(EE)=B后B/B前B×100%。3批样品中克拉霉素离子对脂质体的平均包封率为94.2%,RSD为1.64%(=3)P[8]P。
2.5.2 超滤法
取克拉霉素离子对脂质体注射液1 mL,用乙醇破坏脂质体结构,定容于10 mL量瓶中,进样分析,计算超滤前的药物质量浓度(B总B)。另取克拉霉素离子对脂质体注射液约500 µL,加至超滤管中的超滤膜上,3 000 r∙minP-1P离心20 min。将离心得到的水相进样分析,计算得到B水B。包封率(EE)=(1-B水B/B总B)×100%。3批样品中克拉霉素离子对脂质体的平均包封率为98.5%,RSD为5.15%(=3)。
2.5.3 超高速离心法
取克拉霉素离子对脂质体注射液1 mL,用乙醇破坏脂质体结构,定容于10 mL量瓶中,进样分析,计算超滤前的药物质量浓度(B总B)。另取一定量克拉霉素离子对脂质体注射液置于超速离心管中,使用天平配平。将超速离心管置于超高速离心机中,于5×10P4Pr∙minP-1P离心2 h。将离心得到的水相进样分析,计算得到B水B。包封率(EE)=(1-B水B/B总B) ×100%。3批样品中克拉霉素离子对脂质体的平均包封率为99.3%,RSD为2.3%(=3)。
3 讨论
3.1 克拉霉素离子对脂质体的初步表征
为保证供试品的质量,将克拉霉素离子对脂质体进行了初步的表征。通过测定粒径、电位可知,克拉霉素离子对脂质体具有显著的纳米制剂特性。通过透射电镜观察发现,具有明显的脂质体结构,且粒径分布均一。结果表明供试品的质量没有问题,可以对其进行包封率测定和方法学研究。
3.2 专属性试验
为保证克拉霉素离子对脂质体注射液含量测定的准确性,采用无水乙醇对脂质体结构进行破坏。无水乙醇可以溶解脂质体中的脂质类辅料,使溶液澄清,且不干扰克拉霉素的含量测定。因此,包封率测定方法中采用无水乙醇作为破坏脂质体结构的有机溶剂。
3.3 空白脂质体对克拉霉素的吸附作用
将克拉霉素溶液上样于葡聚糖凝胶柱,并按“2.4.2”条方法进行洗脱后,克拉霉素溶液的回收率小于1%。而空白脂质体和克拉霉素的物理混合物的回收率结果显示,约有2.5%的克拉霉素被洗脱下来,这虽然对克拉霉素包封率的测定结果影响不大,但物理混合物与纯溶液在回收率上的差异值得研究。
克拉霉素的KBaB值为8.8P[9]P,结构上的二甲氨基容易获得质子而带正电。而空白脂质体的电位为-42.05 mV。这样一来,由于正负电荷之间存在库伦引力的作用,空白脂质体将会吸附一部分带正电的克拉霉素,与葡聚糖凝胶微型柱之间存在竞争关系。在空白脂质体的洗脱过程中,会将一部分带正电的克拉霉素带出凝胶柱。载药克拉霉素离子对脂质体的电位为-41.25 mV,同样地,载药脂质体也会吸附一部分外水相中带正电的克拉霉素,使包封率的最终结果偏大。
3.4 包封率测定方法的选择
包封率的测定方法有很多,可以查阅到的就包括超滤法P[10]P、微渗析法P[2-3]P、超高速离心法及葡聚糖凝胶微柱离心法。在前期的试验中考察了超滤法、微渗析法和超高速离心法。克拉霉素的水溶性差,在水中的溶解度不足50 mg∙LP-1P(实测值)。超滤管上的超滤膜会对难溶性药物产生吸附,造成测量结果不够准确。且吸附值是一个变化值,并不稳定地吸附一定量的难溶性药物,这给克拉霉素脂质体注射液的质量控制带来了一定的麻烦。在“2.5.2”条中,作者发现通过超滤法得到的脂质体包封率要大于微柱离心法,这证明了克拉霉素会在超滤膜上产生吸附作用,使包封率测量结果偏大,而RSD>2%也证明了这一方法结果的不稳定性。微渗析法的设备需要自行组装,重现性极差,不能做到在大多数实验室推广使用。而超高速离心机的设备昂贵,也不能做到推广使用。在“2.5.3”条中,作者发现超高速离心法得到的包封率大于微柱离心法和超滤法,这可能是因为在脂质体制备之后,会有一少部分未包封的药物在水中以微晶的形式存在,在超高速离心的过程中,这些微晶被离心到离心管的下层。而作者采用的方法是测定水相中药物的浓度。因此,这一方法得到的包封率结果往往偏大,不够准确。
因此,作者采用葡聚糖凝胶微柱离心法,对该方法进行方法学研究,考察方法的可行性。在误差分析过程中,作者发现微柱离心法会使包封率的最终测定结果偏大,误差在3%左右。但这一误差值并不会显著影响克拉霉素离子对脂质体注射液的质量控制,故最终选择了微柱离心法测定克拉霉素离子对脂质体的包封率。
4 结论
葡聚糖凝胶柱对空白脂质体溶液无吸附作用,离心条件为2 000 r∙minP-1P离心4 min。含量测定的线性范围是50~600 mg∙LP-1P,精密度和回收率均满足含量测定要求。3批克拉霉素离子对脂质体的平均包封率为94.2%。微柱离心法的方法学科学可靠,可作为克拉霉素离子对脂质体包封率测定的有效方法。
[1] 武玲, 丁立英, 刘红英. 克拉霉素的药物学特点与临床评价[J]. 中华实用医药杂志, 2008, 8(1): 36-36.
[2] LIU Xiaona, SUN Wei, ZHANG Bo, et al. Clarithromycin-loaded liposomes offering high drug loading and less irritation[J]. International Journal of Pharmaceutics, 2013, 443(1): 318-327.
[3] LI Jie, NIE Shufang, YANG Xxinggang, et al. Optimization of tocol emulsions for the intravenous delivery of clarithromycin[J]. International Journal of Pharmaceutics, 2008, 356(1): 282-290.
[4] LU Yan, WANG Yanjiao, TANG Xing. Formulation and thermal sterile stability of a less painful intravenous clarithromycin emulsion containing vitamin E[J]. International Journal of Pharmaceutics, 2008, 346(1): 47-56.
[5] LOVELL M, JOHNSON H, HUI HW, et al. Less-painful emulsion formulations for intravenous administration of clarithromycin[J]. International Journal of Pharmaceutics, 1994, 109(1): 45-57.
[6] 刘晓娜. 注射用克拉霉素脂质体的研究[D]. 长春: 吉林大学, 2012: 9.
[7] 金鑫, 王绛玉, 张娜, 等. 微柱离心-高效液相色谱法测定莪术醇脂质体的包封率[J]. 中国药剂学杂志(网络版), 2010, 8(1): 27-32.
[8] ZHANG J A, ANYARAMBHATLA G, MA L, et al. Development and characterization of a novel CremophorP®PEL free liposome-based paclitaxel (LEP-ETU) formulation[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2005, 59(1): 177-187.
[9] NAKAGAWA Y, ITAI S, YOSHIDA T, et al. Physicochemical properties and stability in the acidic solution of a new macrolide antibiotic, clarithromycin, in comparison with erythromycin[J]. Chemical & Pharmaceutical Bulletin, 1992, 40(3): 725-728.
[10] LU Y, ZHANG Y, YANG Z, et al. Formulation of an intravenous emulsion loaded with a clarithromycin–phospholipid complex and its pharmacokinetics in rats[J]. International journal of pharmaceutics, 2009, 366(1): 160-169.
(本篇责任编辑:赵桂芝)
Determination of entrapment efficiency of clarithromycin ion-pair liposome by a mini-column centrifugation method
GENG Sicong1,2, GONG Haoyu1, XU Hang1, LIU Xiaolin1, CHENG Zhibo1, YUAN Yue1*
(,,110016,; 2.,.,.,200245,)
Objective To build a mini-column centrifugation method for measuring of entrapment efficiency of clarithromycin ion-pair liposomes. Methods The entrapment efficiency of clarithromycin ion-pair liposome was measured by a mini-column centrifugation method using a Sephadex G-50 column. The content of clarithromycin ion-pair liposome was assessed by HPLC and the entrapment efficiency was determined by comparing the CLA concentration of the eluted sample with that of the sample prior to column separation. Results The blank liposomes were not absorbed by the Sephadex G-50 minicolumn. The condition of centrifugation was 2 000 r∙minP-1Pfor 4 min. The calibration curve was linear in the range of 50-600 mg∙LP-1Pfor clarithromycin. The average entrapment efficiencyof3 batches clarithromycin liposome was 94.2%. Conclusion The method can be used in the determination of entrapment efficiency of clarithromycin liposomal formulation.
pharmaceutics; liposome; mini-column centrifugation method; clarithromycin; entrapment efficiency
(2016)01–0018–08
10.14146/j.cnki.cjp.2016.01.003
R 94
A
2015-04-01
国家自然科学基金资助项目(81202481)
耿思聪(1989-), 男(汉族), 辽宁沈阳人, 硕士研究生, E-mail gsc1989@163.com;
袁悦(1972-), 女(汉族), 辽宁沈阳人, 副教授, 博士, 主要从事胶体纳米给药系统和功能性药物载体等研究, Tel. 024-23986293, E-mail lnsyyy@sohu.com。
