环孢素A脂质体的制备及稳定性考察
2017-01-14徐小超赵慧雯王永军
徐小超,罗 肖,赵慧雯,王永军
环孢素A脂质体的制备及稳定性考察
徐小超,罗 肖,赵慧雯,王永军*
(沈阳药科大学药学院,辽宁沈阳,110016)
目的以薄膜分散法制备环孢素A脂质体,并对其稳定性进行考察。方法以微柱离心法测定环孢素A脂质体的包封率,以包封率为主要考察指标,采用单因素考察与正交设计优化处方工艺。通过对影响因素的研究及进行的常温、低温实验,考察液态脂质体与脂质体冻干粉的稳定性。结果环孢素A脂质体冻干前平均粒径为80.1 nm,冻干后平均粒径为82.2 nm,冻干前后的包封率分别为90.2%与88.9%,液态脂质体对高温、强光稳定性较差,脂质体冻干粉对高温、强光稳定性较好。结论经冻干后的环孢素A脂质体包封率较高,稳定性提高。
药剂学;脂质体;冻干;环孢素A;包封率;稳定性
环孢素A(cyclosporine A,CyA)是一种强效免疫抑制剂,近年来其在眼科多种疾病的治疗如干眼症[1]、春季卡他性结膜炎、葡萄膜炎和抑制角膜移植排斥反应等方面已有广泛应用并取得较好疗效。
环孢素A具有强亲脂性,临床上常用来治疗干眼症的环孢素A眼用制剂主要有两种:一种为花生油、蓖麻油等植物油制剂[2],该制剂眼部刺激大,患者通常不能耐受,并且由于血-眼房水屏障,吸收进入眼部组织的药物浓度低,生物利用度较低;另一种为由美国Allergan公司生产的眼用乳剂,商品名为RESTASIS®的环孢素A[3],已上市,该乳剂对眼睛刺激性很小,病人有较好的耐受性。但是,RESTASIS®的眼部灼烧感、结膜充血、分泌物增加等不良反应较为常见,且价格昂贵,购买不便。脂质体作为一种优良的给药系统,目前正成为环孢素A眼用制剂的研究热点。
脂质体由磷脂和胆固醇组成,结构与生物膜的双分子层类似,具有良好的生物相容性与亲和性[4],能够较快透过血-眼屏障,提高角膜穿透能力[5],从而能够提高环孢素A的生物利用度。脂质材料本身无毒、无刺激性、无免疫原性、可生物降解,且与眼部组织的相容性好[6],适合作为眼用制剂的载体材料。但部分液态脂质体制剂易发生磷脂氧化分解、聚集沉降及药物渗漏等问题,导致脂质体不稳定,冷冻干燥法所得脂质体为固体制剂,能够提高脂质体的稳定性。本文作者应用薄膜分散法制备环孢素A脂质体,应用冷冻干燥技术制备环孢素A冻干脂质体,提高了脂质体的稳定性。
1 仪器与材料
RE-52A旋转蒸发仪(上海亚荣生化仪器厂),79HW-1恒温磁力搅拌器(浙江乐清乐成电器厂),JY92-2D超声波细胞粉碎机(宁波新芝科器研究所),UV-1801紫外-可见分光光度计(北京瑞利分析仪器公司),ZetaSizer Nano ZEN1600粒径测定仪 (英国Malvern仪器有限公司),HITACHI 高效液相色谱仪(日本Hitachi公司),DZ5-2低速自动平衡离心机(北京医用离心机厂),FDU-1100冷冻干燥机(东京理化器械株式会社)。
环孢素A(福建科瑞药业有限公司,批号130202N),大豆磷脂(上海太伟药业有限公司),胆固醇、麦芽糖(天津博迪化工有限公司),维生素E(德国BASF公司),葡聚糖凝胶G-50(北京瑞达恒辉科技发展有限公司),甲醇和乙腈(色谱纯,天津康科德科技有限公司),其余试剂(分析纯,市售)。
2 方法与结果
2.1 环孢素A脂质体的含量测定
2.1.1 色谱条件
色谱柱:ACCHROM CBB18BB柱(250 mm×4.6 mm,5 μm);流动相:乙腈-甲醇-水(体积比60∶20∶20);流速:1.0 mL·min-1;检测波长:210 nm;柱温:60 ℃。
2.1.2 含量测定方法
量取环孢素A脂质体适量,精密称定。置于5 mL量瓶中,加甲醇破乳,用甲醇定容至刻度,取20 μL注入高效液相色谱仪中,通过外标法计算其含量。
2.1.3 标准曲线的制备
取环孢素A适量,精密称定。以甲醇溶解并稀释至质量浓度分别约为2.5、5、10、20、30、40和50 mg·L-1的溶液,各进样20 μL,记录峰面积。以溶液质量浓度()对峰面积()进行线性回归,得标准曲线方程为= 3.774 5Î104-1.130 6Î104,= 0.999 9。环孢素A质量浓度在2.5~50 mg·L-1内与峰面积呈良好的线性相关性。
2.1.4 回收率与精密度试验
分别取环孢素A约10、12.5和15 mg各3份,精密称定。置于25 mL量瓶中,分别加入处方量的空白脂质体,用甲醇溶解并稀释至刻度,配制成低、中、高3种质量浓度的溶液;另取环孢素A适量,加甲醇溶解并稀释制成每1 mL中约含环孢素A 20 µg的溶液,作为对照溶液。按“2.1.1”条色谱条件测定,得环孢素A的平均回收率分别为(100.8士1.0)%、(100.4士0.3)%和(100.7士0.9)%。低、中、高3种质量浓度的日内RSD分别为1.5%、0.6%和0.9%,日间RSD分别为1.6%、0.6%和0.6%,各项指标均符合测定要求。
2.2 环孢素A脂质体包封率的测定
2.2.1 葡聚糖凝胶柱的制备
取葡聚糖凝胶颗粒(Sephadex G-50)适量,浸泡在蒸馏水中使其充分溶胀,加热煮沸除尽气泡,装入底部垫有滤纸片的2 mL注射器中。待水分自然流下,将其置于离心机中,2 000 r·min-1离心2 min,使凝胶柱失水皱缩,凝胶部分高约2.0 cm,待用。
2.2.2 微型凝胶柱对空白脂质体的吸附作用考察
精密量取0.2 mL空白脂质体置于葡聚糖凝胶柱顶端,将其放于离心机中,1 800 r·min-1离心1 min,收集接受液,移取水化介质0.2 mL,置于葡聚糖凝胶柱顶端,2 000 r·min-1离心3 min,连续操作3次,收集4次的接受液。上述操作平行操作2份并合并2次的接受液,置于2 mL量瓶中,用水化介质定容至刻度,于波长500 nm处测定吸光度(BBtBB);另取空白脂质体0.4 mL置于2 mL量瓶中,用水化介质定容至刻度,于波长500 nm处测定吸光度(BB0BB);以上平行操作6份。根据公式(%)=(BBtBB/BB0BB)×100%,计算空白脂质体的回收率,结果见表1。由表1可知,空白脂质体的平均回收率为95.8%,表明微型凝胶柱对空白脂质体几乎无吸附。

Table 1 Recovery of blank liposome through mini-column (n=6)
2.2.3 微型凝胶柱对游离药物吸附作用的考察
称取环孢素A约5 mg加至10 mL空白脂质体中,混合均匀,移取0.2 mL置于葡聚糖凝胶柱顶端,将其放入离心机中,1 800 r·min-1离心1 min,收集接受液;取水化介质0.2 mL置于葡聚糖凝胶柱顶端,2 000 r·min-1离心3 min,连续操作3次,收集4次的接受液。按“2.1.2”条的方法测定被洗脱药物的量)(BBtBB);另取上述空白脂质体与环孢素A混合物0.2 mL,置于5 mL量瓶中,用甲醇定容至刻度,按“2.1.2”条方法检测药物的总量(BB0BB)。以上平行操作6份,根据公式:(%)=(BB0BB-BBtBB)/BB0BB×100%,计算被吸附药物含量的质量分数,结果见表2。结果表明,凝胶柱对游离药物的吸附≥95%,平均值为95.8%,说明微型凝胶柱基本能将游离药物与脂质体分离。

Table 2 The adsorption of free drug on mini-column (n=6)
2.2.4 包封率的测定
移取环孢素A脂质体0.2 mL置于葡聚糖凝胶柱顶端,将其放入离心机中,1 800 r·min-1离心1 min,收集接受液,移取水化介质0.2 mL置于葡聚糖凝胶柱顶端,2 000 r·min-1离心3 min,连续操作3次,收集4次的接受液,置于5 mL量瓶中,用甲醇定容至刻度,按“2.1.2”条方法测定被包封药物的量(BBinBB);另取环孢素A脂质体0.2 mL,置于5 mL量瓶中,用甲醇定容至刻度,按“2.1.2”条方法测定药物的总量(BB0BB)。根据公式BBEEBB(%)=BBinBB/BB0BB×100%,计算环孢素A脂质体的包封率。
2.3 环孢素A脂质体处方与工艺的优化
2.3.1 单因素考察
2.3.1.1 药脂质量比对包封率的影响
固定其他因素不变,改变药脂质量比为1∶3、1∶5、1∶10、1∶20、1∶30和1∶40,考察不同药脂质量比对环孢素A脂质体包封率的影响,结果见图1。结果表明,随着药脂质量比的减小,脂质体包封率升高,当药脂质量比达1∶30以上时,脂质体包封率不再升高,所以作者选择药脂质量比1∶30作为药脂比例。
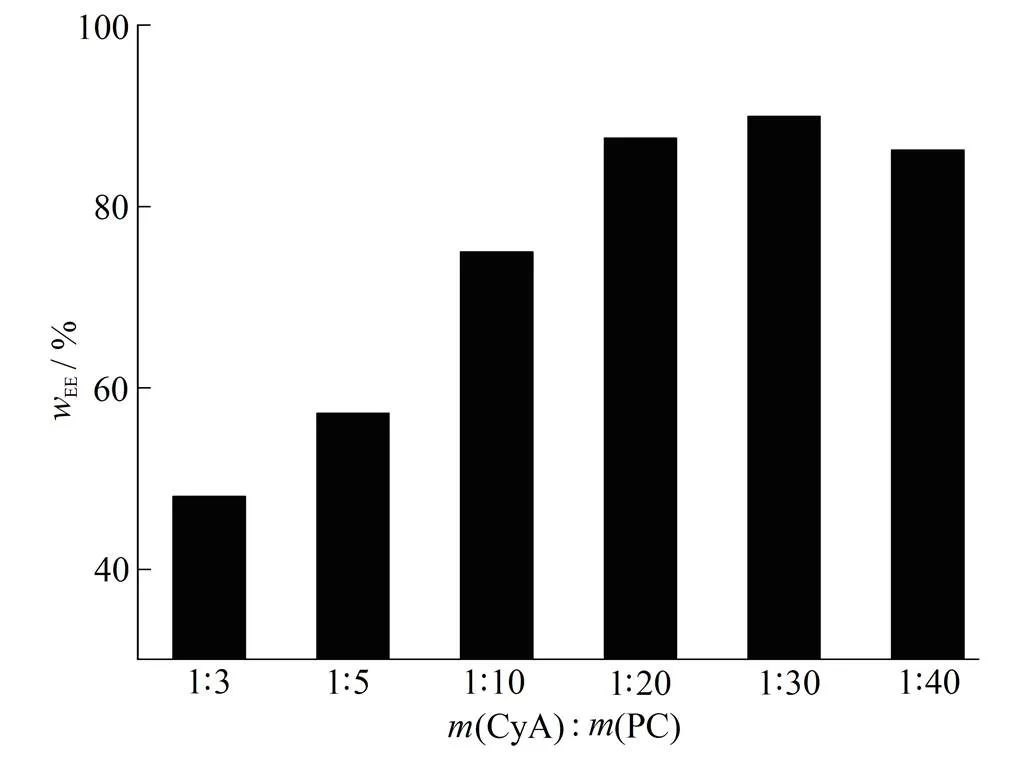
Fig. 1 The influence of the ratio of CyA to C on entrapment efficiency of CyA-liposome
2.3.1.2 磷脂与胆固醇的质量比对包封率的影响
胆固醇是脂质体的“流动性缓冲剂”,可以调节磷脂的流动性。固定其他因素不变,改变磷脂与胆固醇的质量比,使其分别为3∶1、6∶1、8∶1、12∶1和20∶1,考察其对环孢素A脂质体包封率的影响,结果见图2。
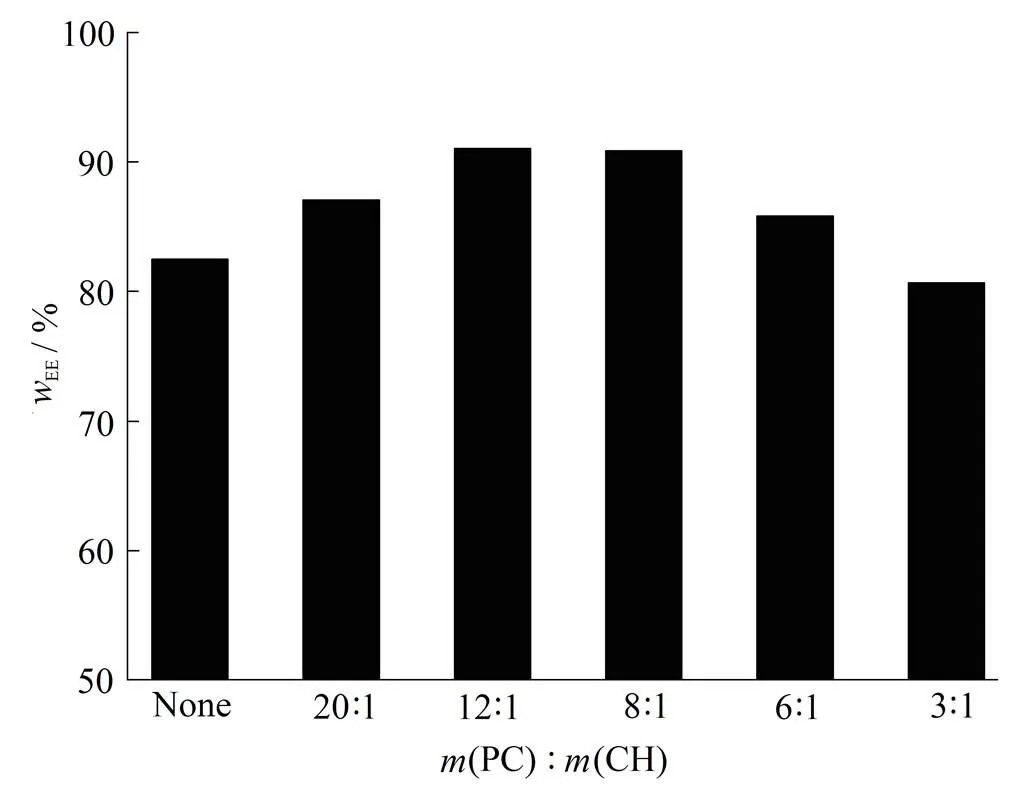
m(C)∶m(CH)
由图2可以得出,随着磷脂-胆固醇质量比的升高,包封率先上升后下降。当磷脂与胆固醇的质量比为8∶1时,包封率较高,胆固醇比例继续增加时,包封率没有明显升高,所以作者选择磷脂与胆固醇的质量比为8∶1。
2.3.1.3 水化温度对包封率的影响
作者考察水化温度为40、45、50和55 ℃时脂质体包封率的变化,结果见图3。由图3可知,随着水化温度的升高,包封率呈上升趋势。但是温度过高时,磷脂易降解,所以选择50 ℃为水化温度。
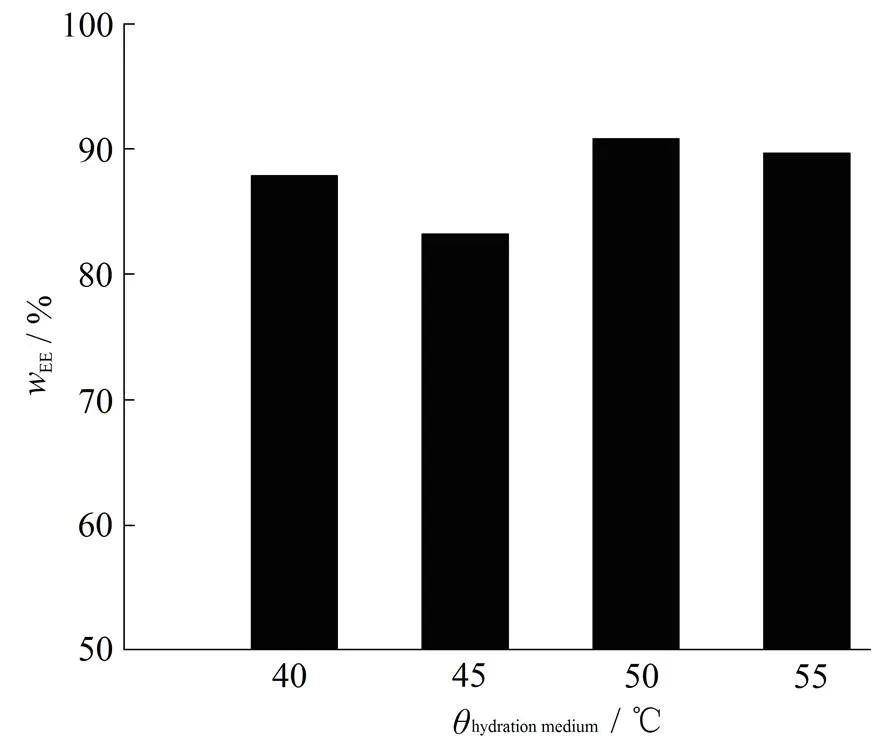
Fig. 3 The influence of hydration temperature on entrapment efficiency of CyA-liposome
2.3.1.4 水化介质浓度对包封率的影响
水化介质中离子强度会显著影响脂质体的形成,实验中考察磷酸盐浓度为0.1、0.5、1.0、10和50 mmol·L-1时脂质体的外观、粒径与包封率,结果见图4。
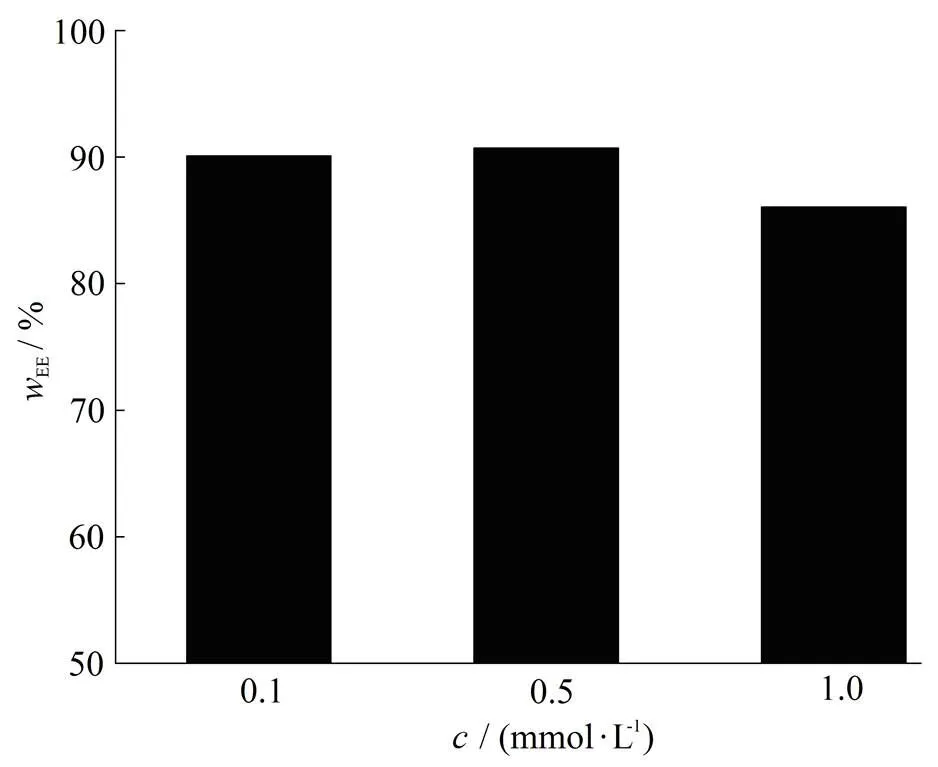
Fig. 4 The influence of hydration medium concentration on entrapment efficiency of CyA-liposome
其中10与50 mmol·L-1BS作为水化介质所得脂质体均为浑浊状不均匀体系,在制备几小时后即沉降分层。由图4可以看出,随着磷酸盐浓度的增大,脂质体包封率降低,当磷酸盐浓度过大时,脂质体放置几小时后沉降,不稳定,而磷酸盐浓度过小时缓冲能力较弱,不易维持脂质体系统pH值稳定。综合考虑包封率与稳定性,选择0.5 mmol·L-1作为水化介质浓度。
2.3.1.5 水化时间对包封率的影响
实验中考察了水化时间为15、20、30、45和60 min时,脂质体包封率的变化情况,结果见图 5。
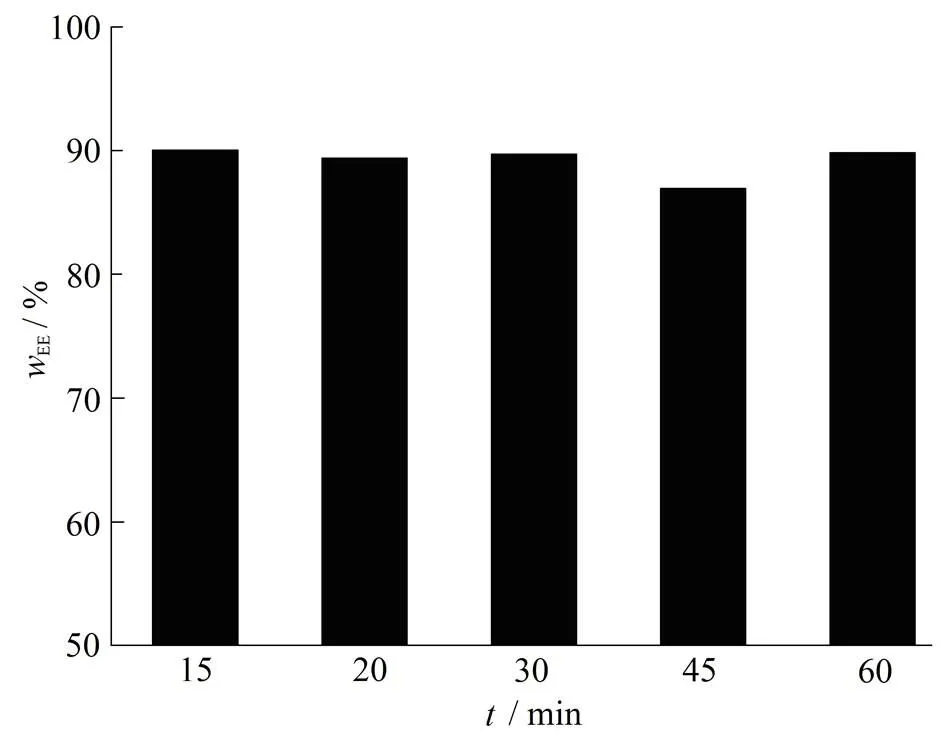
Fig. 5 The influence of hydration time on entrapment efficiency of CyA-liposome
从图5可以看出,水化时间对脂质体包封率影响不大,故选择最短的水化时间15 min。
2.3.2 正交设计试验
以包封率为主要考察指标,通过正交设计法对环孢素A眼用脂质体进行处方工艺优化。根椐单因素考察结果,采用四因素三水平LBB9BB(34)正交试验,对脂质体包封率影响较大的药脂质量比()、磷脂与胆固醇质量比()、水化温度()和水化介质浓度()4个因素进行考察。各因素及其水平与正交试验结果见表3。
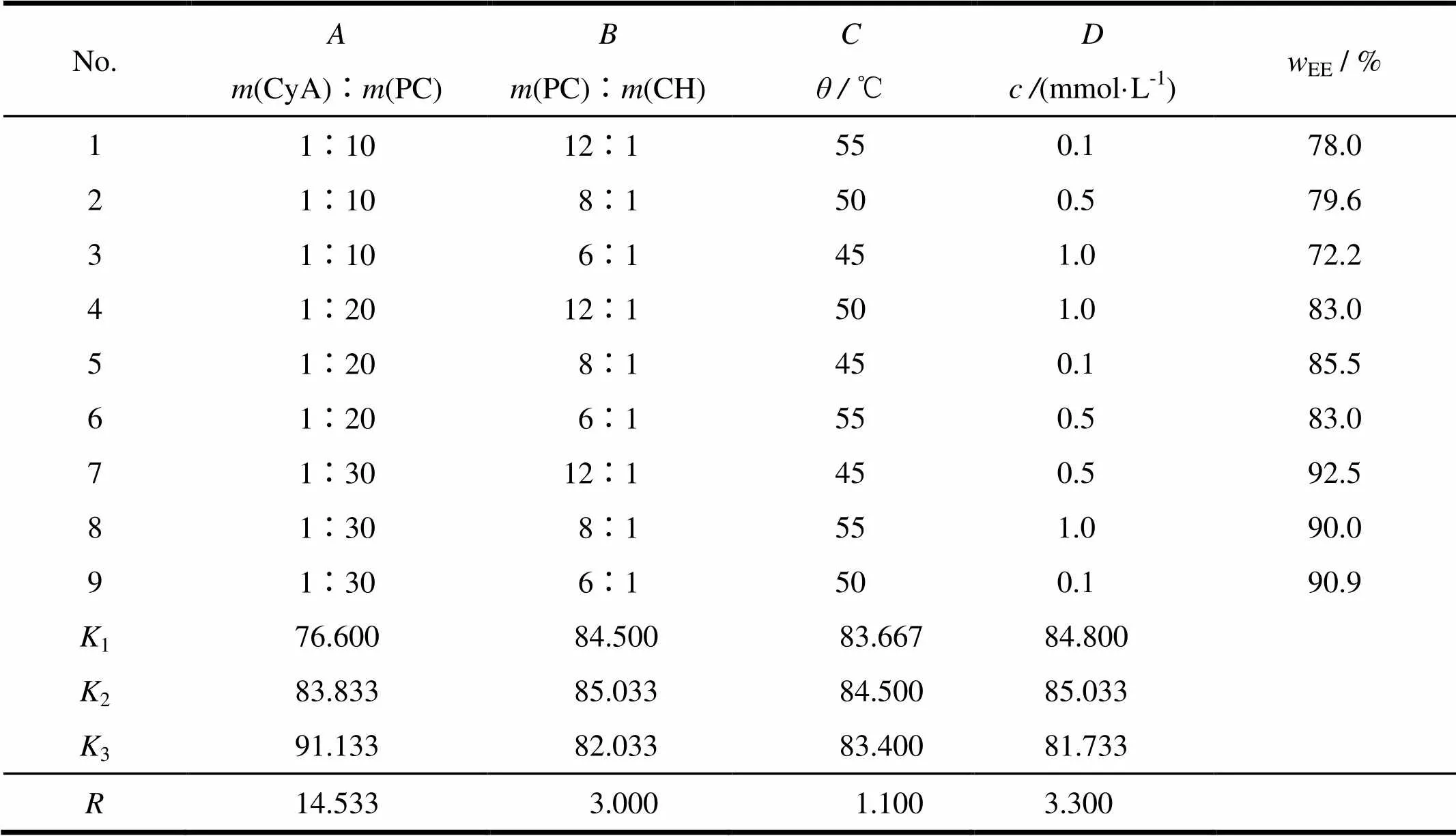
Table 3 The results of the orthogonal design of CyA-liposome preparations
由表3可知,正交设计与单因素考察的结果基本一致,处方工艺各因素对脂质体包封率影响大小顺序为>>>,最佳工艺为BB3BBBB2BBBB2BBBB2BB,即药脂质量比为1∶30、磷脂与胆固醇质量比为8∶1、水化温度为50 ℃、水化介质为0.5 mmol·L-1BS。
2.3.3 环孢素A眼用脂质体具体处方与工艺
环孢素A眼用脂质体的具体处方为:环孢素A 5 mg,大豆磷脂150 mg,胆固醇 18.75 mg,维生素E 1.5 mg,水化介质为0.5 mmol·L-1pH值7.4 BS。
采用薄膜分散法制备环孢素A眼用脂质体。将环孢素A、大豆磷脂、胆固醇、维生素E等溶于适量二氯甲烷并置于圆底烧瓶中,于30 ℃减压旋转蒸发除去溶剂,使其在瓶壁上形成均匀的脂质薄膜,于温度为50 ℃加入pH值7.4的磷酸盐缓冲液适量,水化15 min,所得混悬液用探针式细胞粉碎机超声至蓝色半透明,再用已灭菌的0.22 μm的微孔滤膜过滤,即得。
2.4 环孢素A眼用脂质体冻干制剂的制备
以50 g·L-1麦芽糖作为冻干保护剂,将“2.3.3”条下制备的环孢素A脂质体于NBB2BB保护下分装于安瓿瓶中,置于冷冻干燥机中干燥。冻干程序为-80 ℃预冻12 h,升温至-40 ℃维持3 h,再升温至-20 ℃维持15 h,最后升温至30 ℃维持3 h。
2.5 环孢素A脂质体性质考察
2.5.1 外观评价
环孢素A脂质体溶液为半澄明的淡蓝色胶体溶液,冻干制剂为白色粉末。
2.5.2 粒径的测定
用Malvern粒径测定仪对环孢素A脂质体冻干前后粒径进行测定,环孢素A脂质体冻干前平均粒径为80.1 nm,冻干后平均粒径为82.2 nm,冻干前后多分散系数DI分别为0.267与0.226,粒径分布均较为均匀。
2.5.3 包封率的测定
按“2.2.4”条方法测定环孢素A脂质体冻干前后的包封率分别为90.2%与88.9%。
2.6 环孢素A脂质体溶液与冻干粉的稳定性研究
将环孢素A脂质体溶液与冻干粉进行高温、强光、常温和低温实验,进行稳定性考察,结果见表4、5。

Table 4 Stability of CyA-liposome in stress tests
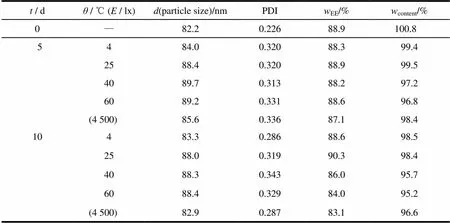
Table 5 Stability of CyA-liposome freeze-dried powder in stress tests
由表4可知,液态环孢素A脂质体稳定性较差,对高温、光照等均不稳定,放置10 d后,粒径增大,粒度分布变大,药物含量与包封率均明显降低,但在常温、低温环境中较为稳定。
由表5可知,环孢素A脂质体冻干粉对高温、强光照较液态脂质体稳定,各项性质变化不大,将环孢素A脂质体冻干有利于提高脂质体的稳定性。
3 讨论
3.1 微柱离心法测包封率
目前常用的脂质体包封率测定方法包括微柱离心法、透析法[7]、超速离心法[8]、阳离子交换树脂法[9]和超滤膜过滤法[10]等。超速离心法重现性较差;阳离子交换树脂法的机制是基于离子交换,对药物有电荷要求;透析法则容易造成药物的泄漏;超滤膜过滤法耗时较长。作者采用微柱离心法测定环孢素A脂质体的包封率,可将环孢素A与脂质体很好的分离,且所需样品少,耗时短,重现性好,准确度高。
3.2 薄膜分散法制备脂质体
环孢素A为脂溶性药物,采用被动载药法将环孢素A包封于脂质双分子层之间,所得制剂包封率高,且操作方便[11]。
3.3 冻干制剂提高稳定性
由于部分液态脂质体在贮藏过程中容易出现聚集、药物从脂质膜中泄漏、磷脂氧化和水解等问题[12],所以作者采用冷冻干燥法提高脂质体的长期贮藏稳定性。在冻干过程中,低温、冻结、脱水等过程均可导致脂质体脂质双分子层的折叠、融合、破裂及药物渗漏,而在冻干过程中加入适宜的冻干保护剂,则可大大减轻甚至消除冻干对脂质体质量的影响。故作者选择麦芽糖作为冻干保护剂,脂质体冻干前后性质变化不大,稳定性提高。
[1] TANG-LIU D S, ACHEAMONG A. Ocular pharmacokinetics and safety of ciclosporin, a novel topical treatment for dry eye[J]. HHClinical harmacokineticsHH, 2005, 44(3): 247-261.
[2] 崔福德. 药剂学[M]. 6版. 北京: 人民卫生出版社, 2008: 420-422.
[3] WAN H N, CHEN L J, YOUNG A L. Efficacy and safety of topical 0.05% cyclosporine eye drops in the treatment of dry eye syndrome: a systematic review and meta-analysis[J]. Ocular Surface, 2015, 13(3): 213-225.
[4] LALLEMAND F, FELT-BAEYENS O, BESSEGHIR K, et al. Cyclosporine A delivery to the eye: a pharmaceutical challenge[J]. European Journal of harmaceutics and Biopharmaceutics, 2003, 56(3): 307–318.
[5] SAMAD A, SULTANA Y, AQIL M. Liposomal drug delivery systems, an update review[J]. Current Drug Delivery, 2007, 10(4): 297-305.
[6] 陈建海. 药用高分子材料与现代药剂[M]. 北京: 科学出版社, 2003: 281-291.
[7] MURA , MAESTRELLI F, GONZALEZ-RODRIGUEZ M, et a1. Development, characterization andevaluation of benzocaine-loaded liposomes[J]. European Journal of harmaceutics and Biopharmaceutics, 2007, 67 (1): 86-95.
[8] ROUZI B. Retorolac tromethamine liposome: encapsulation and release studies[J]. Journal of Liposome Research, 2005, 15(3/4): 175-185.
[9] AMSELEM S, GABIZON A, BARENHOLZ Y. Optimization and upscaling of doxorubicin-containing liposomes for clinical use[J]. Journal of harmaceutical Sciences, 1990, 79(12): 1045-1052.
[10] DU Song, DENG Yingjie, ZHANG Wei. reparation of harmine hydrochloride liposomes by active loading method[J]. Chinese Traditional and Herbal Drugs, 2005, 36(5): 673-676.
[11] GAO Yuanyuan, ZHANG Weinong. rogress of preparation and detection on liposomes[J]. Journal of Wuhan olytechnic University, 2010, 29(3): 45-52.
[12] WANG Jian, LI Mingxuan. rofiles in improvements of liposomes stability by freeze-drying[J]. Chinese Journal of harmaceuticals, 2005, 36(9): 576-580.
(本篇责任编辑:赵桂芝)
Preparation of cyclosporine A liposome and the study on its stability
XU Xiaochao, LUO Xiao, ZHAO Huiwen, WANG Yongjun*
(,,110016,)
ObjectiveTo prepare CyA-loaded liposome by thin-film dispersion method and to study the stability of CyA liposome. Method Minicolumn-centrifuge method was employed to determine the encapsulation efficiency of the liposome. Single factor test was performed with entrapment efficiency as the main index and orthogonal design was adopted to optimize the formulation. The influence factors, as room temperature and low temperature, were investigated with regard to the stability of liposome in the form of liquid and freeze-dried powder. Result The particle size of CyA liposome before and after freeze drying were 80.1 nm and 82.2 nm, respectively. The entrapment efficiency was 90.2% and 88.9% , respectively. CyA liposome of liquid state was not stable to heat and light, but CyA-liposome freeze-dried powder only had a little sensitive to heat and light in influence factors test. ConclusionThe entrapment efficiency of CyA-loaded liposome is high after freeze-drying and the stability is improved.
pharmaceutics; liposome; freeze-drying; cyclosporine A; entrapment efficiency; stability
(2016)01–0001–10
10.14146/j.cnki.cjp.2016.01.001
R94
A
2015-04-13
徐小超(1990–), 女(汉族), 湖南长沙人, 硕士研究生, E-mail xuxiaochao8321@163.com;
王永军(1977–), 男(汉族), 山东荣成人, 副教授, 博士, 硕士生导师, 主要从事新型抗癌药物纳米给药系统及药物制剂新剂型新技术等研究, Tel. 024-23986325,E–mail i_maple@163.com。
