高产酸及耐酸性干酪乳杆菌的诱变筛选
2017-01-13何慧玲马成杰胡中泽
何慧玲,马成杰,王 琨,胡中泽,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.光明乳业股份有限公司乳业研究院,上海 200436)
高产酸及耐酸性干酪乳杆菌的诱变筛选
何慧玲1,马成杰2,王 琨2,胡中泽1,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.光明乳业股份有限公司乳业研究院,上海 200436)
为筛选高产酸及耐酸的干酪乳杆菌菌株,以干酪乳杆菌LC2W为出发菌株,分别对其进行紫外(Ultraviolet,UV)、亚硝基胍(Nitrosoguanidine,NTG)和硫酸二乙酯(Diethyl sulfate,DES)诱变以及人工胃液处理。结果显示,通过0.3 g/L的亚硝基胍处理30 min和紫外线照射30 s后得到的诱变菌株LC2W-NTG-12,LC2W-UV-11表现出高产酸及耐酸性能。相同条件下,出发菌株LC2W和突变菌株LC2W-NTG-12,LC2W-UV-11经24 h发酵后的滴定酸度分别为76.6 °T和112.7 °T,98.2 °T,突变菌株产酸能力分别提高了47.13%、28.20%。当用pH为1.5的酸液处理2 h后,出发菌株和诱变菌株LC2W-NTG-12,LC2W-UV-11的致死率分别为76.44%、52.06%、56.36%,诱变菌株耐酸能力分别提高了24.38%、20.08%。而用0.16% DES处理30 min得到的诱变菌株LC2W-DES-33发酵后的酸度仅比出发菌株提高了14.10%,诱变效果并不明显。说明亚硝基胍诱变可有效提高干酪乳杆菌的产酸及耐酸性能。
干酪乳杆菌,产酸,耐酸,诱变,筛选
干酪乳杆菌(Lactobacilluscasei)是我国卫生部公布的可用于保健食品与普通食品的益生菌菌种之一,它能够较好耐受人体的消化系统,包括口腔中的酶、低pH的胃液以及小肠的胆汁酸等,进入人体后,干酪乳杆菌可以在肠道内大量存活,发挥调节肠内菌群平衡、促进人体消化吸收等作用[1]。同时,干酪乳杆菌还具有降胆固醇、调节血脂、血压,促进细胞分裂,增强人体免疫及预防癌症和抑制肿瘤生长等益生保健功能[2]。当前,干酪乳杆菌已广泛应用于酸奶、奶酪等发酵乳制品生产中。然而,随着干酪乳杆菌发酵的进行,产生、积累的游离乳酸会使发酵乳制品pH逐渐降低,菌株耐受能力达到极限进而衰亡,导致发酵乳制品营养价值和益生功能大大降低。因此筛选能在低pH下生长代谢的乳酸菌,提高其耐酸性是改良乳酸生产菌种的一个重要发展方向[3-6]。
优化改良菌种特性常用的选育方法有诱变育种、原生质体融合、基因工程育种等,其中应用最为广泛的为诱变育种[7-8],诱变育种是利用物理或化学诱变剂处理均匀分散的微生物细胞群,促使其突变率大幅度提高,然后采用简便、快速和高效的筛选方法,从中挑选少数符合育种目的的突变株。
Khattab等人[9]通过UV对米曲霉菌株Fs-3诱变筛选得到一株高产葡萄糖氧化酶的突变株,该突变株比出发菌株产葡萄糖氧化酶提高了332.1%。Leslie等人[10]通过NTG诱变得到生产瑞士干酪的低温敏感型突变株的丙酸杆菌,该突变菌株在32 ℃下生长与出发菌株一样,但是在14 ℃下生长明显缓慢。赵士豪等人[11]用紫外线和亚硝基胍对乳酸菌进行两轮复合诱变,最终得到一株产酸能力较出发菌株提高了30.64%的诱变株。王玉华等人[12]采用对干酪乳杆菌进行紫外和亚硝基胍诱变之后再对其进行基因组改组筛选到4株可以在pH3.8平板上旺盛生长且产酸量较高的改组菌株。
国内外均有利用诱变技术提高乳酸菌产酸能力以及用基因组改组技术提高干酪乳杆菌耐酸性能的报道,但未见用诱变技术结合模拟人工胃液处理筛选高产酸及耐酸性干酪乳杆菌的研究。本研究采用实验室保存的干酪乳杆菌为出发菌株,经紫外、亚硝基胍和硫酸二乙酯诱变之后再经人工胃液处理,筛选高产酸及耐酸性菌株。
1 材料和方法
1.1 材料与仪器
干酪乳杆菌LC2W(CGMCC No.0828) 由光明乳业研究院实验室保存;亚硝基胍(Nitrosoguanidine,NTG) 日本TCL公司;硫酸二乙酯(Diethyl sulfate,DES) 美国Sigma公司;中性蛋白酶(编号4861492261,酶活≥1600 AZO/g) 丹麦丹尼斯克公司;氯化钠、碳酸钙、浓盐酸、氢氧化钠、酚酞指示剂、无水乙醇 均为国产分析纯,购自上海国药集团。
Logic-A2生物安全柜 美国Labconco公司;MIR-253培养箱 日本Sanyo公司;Bugbox厌氧培养箱 英国Ruskinn公司;SA-300VF高压蒸汽灭菌锅 荷兰Sturdy Industrial公司;GFL1002水浴锅 德国GFL公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;UV-1800紫外-可见分光光度计 日本Shimadzu公司;868型pH计 美国Thermo Orion公司;Cinac乳品发酵监控仪 法国AMS集团。
1.2 培养基配制
MRS培养基:蛋白胨10 g,牛肉粉10 g,酵母提取物5 g,葡萄糖20 g,乙酸钠5 g,柠檬酸氢二胺2 g,磷酸氢二钾2 g,硫酸镁 0.2 g,硫酸锰 0.04 g,吐温80 1 g,蒸馏水定容至1L,调节pH为6.2~6.4;MRS-CaCO3固体培养基:于MRS基础培养基里添加3‰固体CaCO3及2%的固体琼脂;脱脂乳培养基:配制12%(w/w)的脱脂乳于115 ℃高温灭菌5 min后备用。
1.3 实验方法
1.3.1 菌种活化 将干酪乳杆菌LC2W接种于MRS液体培养基中37 ℃培养12 h,7000 r/min离心5 min收集菌体,用0.85%(w/w)灭菌生理盐水洗涤2次,将适量菌体悬浮于质量分数为0.85%的生理盐水中制成细胞悬浮液。
1.3.2 紫外诱变 分别取适量上述菌悬液置于7个培养皿中,菌液厚度约为2 mm。于功率为20 W紫外灯下,距离45 cm,在搅拌状态下分别照射10、20、30、40、50、60 s(开启培养皿盖开始计时,达到要求时间后立即盖上平皿盖)。取经紫外线照射的菌株和未经照射的菌株,梯度稀释至合适梯度,取适量涂布于MRS平板上,迅速用牛皮纸包好,置于37 ℃厌氧培养箱(CO2:10%,N2:90%)中培养48 h后进行菌落计数,计算紫外致死率。
1.3.3 亚硝基胍诱变
1.3.3.1 诱变时间 将10 mg NTG溶于1 mL丙酮[13]配制10 mg/mL的亚硝基胍母液,将母液分别加入到5支10 mL上述菌悬液中使得亚硝基胍终浓度为0.3 g/L[14],于37 ℃恒温水浴锅内温育20、30、40、50 min,7000 r/min,离心5min收集菌体,无菌生理盐水重悬洗涤菌体两次,梯度稀释后涂布置MRS平板于37 ℃厌氧培养箱中培养48 h后进行菌落计数,计算NTG致死率。
1.3.3.2 诱变浓度 在确定了NTG处理时间后,再取10 mL菌悬液于6支15 mL离心管中,加入适量NTG溶液使其终浓度分别为0.1、0.2、0.3、0.4、0.5 g/L,并于37 ℃恒温水浴锅内温育一定时间后,同样方法离心洗涤,计数方法同上,计算NTG致死率。
1.3.4 硫酸二乙酯诱变
1.3.4.1 诱变体积分数 按1 mL DES:9 mL乙醇配制硫酸二乙酯溶液,分别取10 mL菌悬液于6支15 mL离心管中,根据诸葛健[15]推荐的DES诱变条件20~30 min,本实验选择30 min为初始时间研究浓度影响。加入DES体积分数分别为0.1%、0.12%、0.14%、0.16%、0.18%,按照2.5倍DES溶液体积加入质量分数为25%硫代硫酸钠溶液终止反应[16],计算DES致死率。
1.3.4.2 诱变时间 在确定了DES诱变体积分数后,再取10 mL菌悬液于6支15 mL离心管中,加入一定体积分数的DES溶液,于37 ℃恒温水浴锅内分别温育20、25、30、35 min,同样方法离心洗涤,计数,计算DES致死率。
1.3.5 人工胃液耐受性实验
1.3.5.1 人工胃液的配制 先将浓度为36.46%的浓盐酸稀释成1 mol/L的稀盐酸,加水稀释调节pH分别为1.5、2.0、2.5、3.0,每100 mL液体中加入1 g中性蛋白酶,混匀,用0.22 μm的细菌过滤器过滤待用[17]。
1.3.5.2 接种人工胃液 将诱变后的菌体于MRS液体培养基培养12 h后,离心洗涤用生理盐水稀释后分别接入上述不同pH的人工胃液中,于37 ℃恒温水浴锅中温育30 min。
1.3.6 筛选方法
1.3.6.1 初筛 将人工胃液处理的菌液离心洗涤两次后分别稀释至合适梯度后涂布于MRS-CaCO3平板中,每个梯度涂两个平板,并设对照组,于37 ℃厌氧培养箱中培养48 h后,挑选出其中溶钙圈较大的菌落,于MRS液体培养基中培养过夜。
1.3.6.2 复筛 将MRS液体培养基中的菌体离心洗涤2次,悬于10 mL生理盐水中,应用紫外分光光度法在OD600 nm条件下测其OD值调整菌体浓度一致,以2%(w/w)的接种量分别接种于100 mL 12%的脱脂乳中,24 h后测定其pH和滴定酸度值,筛选出高产酸菌株。
1.3.6.3 耐酸性实验 将筛选出的高产酸菌株在pH分别为1.5、2.0、2.5、3.0以及时间分别为0、0.5、1.0、1.5、2.0 h条件下利用平板活菌计数法计算菌株的存活率,并作对照实验。
1.3.7 指标测定
1.3.7.1 致死率测定 采用平板活菌计数法测定菌数,按下式计算致死率[18]:
致死率(%)=(未经诱变菌落数-经诱变菌落数)/未经诱变菌落数×100
根据致死率结果制作致死率曲线。利用SPSS进行单因素方差分析,将分析结果用小写字母进行显著性标记。
1.3.7.2 酸度测定 酸度测定采用吉尔涅尔度表示[19],利用SPSS进行差异性分析,同样用小写字母进行显著性标记。
1.3.7.3 高产菌株的遗传稳定性测定 将筛选到的高产菌株分别传代1、3、5、7次后精确测定其酸度值和pH1.5处理2 h后的存活率,观察其产酸和耐酸的稳定性。用SPSS进行稳定性差异分析,并用小写字母标记。
2 结果与分析
2.1 诱变条件

图1 紫外诱变时间对致死率的影响Fig.1 Effect of UV mutation time on lethality注:小写字母不同表示差异显著(p<0.05);图2~图5同。
2.1.1 紫外诱变时间的确定 干酪乳杆菌LC2W在紫外照射不同时间的致死率曲线如图1所示,由图1可以看出,紫外照射对菌株致死率影响较大,照射10 s致死率为51.9%,照射30 s致死率为85.4%,照射50 s致死率达到98.1%。有文献报道,一般诱变致死率在80%~90%,易于筛选到变异幅度大的突变菌株[20-22],因此选择紫外照射时间30 s为干酪乳杆菌LC2W的最佳诱变时间。
2.1.2 NTG诱变时间和剂量的确定 用浓度为0.3 g/L的NTG溶液处理菌株20~50 min,其致死率如图2所示,随诱变时间的延长,致死率逐渐升高,在处理时间达30 min时,致死率达已到90.2%,因此以30 min为NTG的最佳诱变时间。
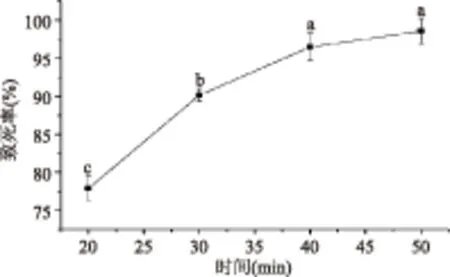
图2 亚硝基胍处理时间对致死率的影响Fig.2 Effect of NTG treatment time on lethality
干酪乳杆菌LC2W在NTG不同浓度条件下,诱变处理30 min的致死率如图3所示,由图3可看出,随NTG浓度的增大,致死率不断增加,呈正相关。在诱变剂浓度为0.3 g/L时,致死率达88.1%,此浓度为NTG最佳诱变浓度。古丽娜孜[23]等人诱变筛选高产低温淀粉酶的淀粉芽孢杆菌、马春丽[14]等人通过复合诱变处理得到高产酸保加利亚乳杆菌突变株,均在0.3 g/L的NTG浓度下得到最佳结果,与本实验结果一致。
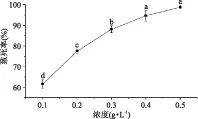
图3 亚硝基胍浓度对致死率的影响Fig.3 Effect of NTG concentration on lethality
2.1.3 DES诱变剂量和时间的确定 DES的体积分数及诱变时间直接影响诱变效果,而其中DES体积分数更是占主导作用[24]。干酪乳杆菌LC2W在DES不同浓度条件下,诱变处理后的致死率如图4所示,由图4可看出,随DES浓度的增大,致死率不断增加,在处理体积分数为0.16%时,致死率达89.7%,因此以此条件下的处理浓度为DES最佳诱变浓度。

图4 硫酸二乙酯体积分数对致死率的影响Fig.4 Effect of DES concentration on lethality
用体积分数为0.16%的DES溶液处理不同时间,其致死率如图5所示,由图5可看出,随诱变时间的延长,致死率逐渐增大,在处理时间达30 min时,致死率达到91.2%,因此以30 min为DES的最佳诱变时间。

图5 硫酸二乙酯处理时间对致死率的影响Fig.5 Effect of DES treatment time on lethality
2.2 菌落初筛结果
将UV诱变30 s,0.3 g/L NTG处理30 min以及0.16% DES处理30 min并经人工胃液处理后的干酪乳杆菌LC2W涂布在MRS-CaCO3平板上,各处理组菌落形态如图6所示,由图6可看出,菌落形态一致,均呈乳白色的圆形菌落,表面光滑,但溶钙圈有一定差异,挑取溶钙圈较大的菌落进行复筛。

图6 加碳酸钙的MRS平板上的菌落形态Fig.6 Colonies of the mutant strain on the MRS tablet with CaCO3
从图7诱变前后菌株显微图中可看出,菌株形态为杆状,但NTG诱变后的菌株形态呈长杆状,其他三株形态无较大差异,均为短杆状,说明NTG诱变对菌株影响较为显著。

图7 诱变前后菌株显微图片(100×)Fig.7 Micrograph of the stains before and after mutation(100×)
2.3 菌落复筛结果
菌落复筛结果如表1所示,LC2W-UV-11、LC2W-NTG-12两株菌在发酵18 h后即呈凝乳状态,有微量乳清析出,说明其产酸较快,12株正突变菌株发酵24 h后的pH和酸度如表3所示。通过3种诱变方法,最终筛选出1株产酸能力达112.7 °T的诱变株,较出发菌株提高了47.13%。

表1 诱变菌株产酸能力比较
注:同列不同小写字母表示差异显著(p<0.05)。
2.4 产酸能力比较
突变株LC2W-NTG-12与出发菌株LC2W的发酵曲线如图8所示,发酵初始时,诱变菌株pH下降速度较原始出发菌株略快;12 h以后,诱变菌株pH下降速度明显高于出发菌株;当发酵时间达到18 h时,诱变菌株pH已达到4.34,而出发菌株仅为4.75,差异显著(p<0.05)。由此说明,筛选出的菌株产酸能力较出发菌株具有明显优势。

表2 两株突变菌株与出发菌株LC2W的耐酸能力比较(×108 CFU/mL)
注:同列大写字母不同表示差异显著(p<0.05),大写字母相同表示差异不显著(p>0.05);同行小写字母不同表示差异显著(p<0.05),小写字母相同表示差异不显著(p>0.05)。

表3 诱变菌株LC2W-NTG-12遗传稳定性

图8 突变菌株LC2W-NTG-12与出发菌株LC2W发酵酸度曲线对照Fig.8 Comparison of the fermentation acidity curve of the mutagenesis strain LC2W-NTG-12 and parent strain LC2W
2.5 耐酸能力比较
由表2可看出,随着体系pH的降低以及处理时间的延长,活细胞数量逐渐减少。诱变菌株LC2W-NTG-12、LC2W-UV-11、出发菌株在pH1.5的高酸环境下2 h致死率分别为52.06%、56.36%、76.44%。在pH2.0的环境下,原始菌株和LC2W-UV-11活菌数在0.5 h即出现明显下降,而LC2W-NTG-12活菌数在1 h以后降低显著。
2.6 诱变菌株LC2W-NTG-12遗传稳定性实验
上述各代的产酸及耐酸能力基本一致,没有显著差异(p>0.05),说明了该诱变菌株的遗传稳定性好,不易发生退变。
3 结论
出发菌株LC2W发酵24 h后,发酵乳滴定酸度为76.6 °T,pH1.5酸处理2 h后的致死率为76.44%。经0.3 g/L的NTG处理30 min,再通过人工胃液处理、MRS-CaCO3平板筛选得到的LC2W-NTG-12诱变菌株,24 h的滴定酸度为112.7 °T,较出发菌株提高了47.13%,并且此菌株能耐受pH为1.5的高酸环境,2 h后的致死率仅为52.06%,显著低于出发菌株。紫外诱变30 s后得到菌株LC2W-UV-11,其发酵乳滴定酸度为98.2 °T,产酸能力较出发菌株酸度提高了28.20%,耐酸性提高了20.08%,诱变效果也较为明显。而硫酸二乙酯虽然是一种很强的诱变剂,但其诱变结果并不十分理想,得到的最优菌株的发酵乳酸度较出发菌株仅提高了14.10%。诱变成功的高产菌株遗传稳定性好,不易发生回复突变。
[1]曹瑞博,汪建明.干酪乳杆菌的功能性研究及其应用[J]. 中国食品添加剂,2009(s1):169-172.
[2]汪建明,赵仁国,肖冬光.高活性干酪乳杆菌粉末发酵剂初步研究[J].天津科技大学学报,2005,20(2):9-13.
[3]Porro D,Blanchim M,Brambilla L,et al. Replacement of a metabolic pathway for large-scale production of lactic acid from engineered yeasts[J].Appl Environ Microbiol,1999,65:4211-4215.
[4]Antoniusja M,Winklera A,Porro D,et al. Homofermentative lactate production cannot sustain anaerobic growth of engineered Saccharomyces cerevisiae:Possible consequence of energy-dependent lactate export[J]. Appl Environ Microbiol,2004,70:2898-2905.
[5]Painaik R,Louie S,Gavrilovic V,et al. Genome shuffling of Lactobacillus for improved acid tolerance[J]. Nat Biotechnol,2002,20:707-712.
[6]刘勇军,王昌禄,曹伟锋,等.细菌L-乳酸发酵的研究-耐高糖高酸菌株的选育[J]. 广州食品工业科技,2003(2):26-29.
[7]房耀维,范琳,牛艳芳,等.工业微生物育种技术研究进展[J].内蒙古师范大学学报,2003,23(2):158-161.
[8]孙剑秋,周东坡.微生物原生质体技术[J].生物学通报,2002,37(7):9-11.
[9]Khatta A A,Bazaraa W A. Screening,mutagenesis and protoplast fusion of Aspergillus niger for the enhancement of extracellular glucose oxidase production[J].Ind Micro & Bio,2005,32(7):289-294.
[10]Leslie A.Mutagenesis of strains of Propionibacterium to produce cold-sensitive mutants.[J]. Dairy Sci,1983,66(12):2482-2487.
[11]赵士豪,马同锁,张红兵,等.高产乳酸菌株的诱变[J].食品科技,2006,31(9):41-43.
[12]王玉华,李岩,裴晓琳,等.基因组改组提高干酪乳杆菌耐酸性生产L-乳酸[J].中国生物工程杂志,2006,26(2):53-58.
[13]吴惧,张嘉芷,张庆波,等.β-半乳糖苷酶高产菌株的诱变筛选及其发酵培养[J].食品工业科技,1997(1):5-8.
[14]马春丽,张兰威.紫外亚硝基胍复合诱变选育高产酸乳酸菌[J].中国酿造,2010(8):117-119.
[15]诸葛健.工业微生物实验技术手册[M].北京:中国轻工出版社,1994.
[16]芦烨,梁金钟,施铜铃.多抗性保加利亚乳杆菌的诱变和筛选[J].乳业科学与技术,2010(1):6-10.
[17]张扬,袁杰利.模拟消化环境对益生菌制剂的影响[J].中国微生态学杂志,2003,15(5):253-255.
[18]马春丽,张兰威.高产酸性能乳酸菌的诱变选育[J].中国乳品工业,2010,38(7):15-17.
[19]Adrianus J,Engelen,Peter H G. Determination of neutral lactase activity in industrial enzyme preparations by a colorimetric enzymatic method collaborative study[J].Joumal of AOAC International,1999,82(1):112-118.
[20]冯印,苏安祥,王玉华.复合诱变选育茁酶多糖高产菌株[J].中国酿造,2011(8):84-86.
[21]蒋妮真,吕炜锋,高向东,等.用紫外诱变和离子束注入筛选辅酶Q10高产菌[J].药物生物技术,2006,13(3):207-210.
[22]Li Y,Frank P,Bentley W E. Conditioned medium from listeria innocua stimulates emergence from a resting state:not a response to E.Coli quorum sensing autoinducer AI-2[J]. Biotechnol Prog,2006,22:387-393.
[23]古丽娜孜,库米拉,张晓燕,等.低温淀粉酶高产菌株的诱变选育[J]. 新疆农业大学学报,2013,36(4):288-292.
[24]梁金钟,李雯,王风青.产γ-氨基丁酸乳酸菌的筛选及诱变育种[J].食品科学,2013,34(23):228-232.
Screening high acid-producing and acid-resistantLactobacilluscaseistrains
HE Hui-ling1,MA Cheng-jie2,WANG Kun2,HU Zhong-ze1,*
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China; 2.Dairy Research Institute of Bright Dairy & Food Co.,Ltd.,Shanghai 200436,China)
In order to screen a high acid-producing and acid-resistant strain,LactobacilluscaseiLC2W was subjected by Ultraviolet(UV),Nitrosoguanidine(NTG),Diethyl sulfate(DES)respectively,and then treated with simulated gastric fluid. The results showed that the mutation strain LC2W-NTG-12 and LC2W-UV-11 which were subjected by 0.3 g/L NTG for 30 min and UV treatment for 30 s exhibited high acid-producing and acid-resistant. In the same amount of inoculation,the acidity of the fermented by the parent strain and mutation strain were 76.6 °T and 112.7 °T,98.2°T after 24 h,respectively. The acid-production rate of mutation strain was improved 47.13%,28.20%. In addition,when the strains were treated with the acid(pH=1.5),the mortality rate of parent stain and mutation strain were 76.44% and 52.06%,56.36% after 2 h,respectively. The acid-resistant rate of mutation strain was improved 24.38%,20.08%. But the effect of mutation strain LC2W-DES-33 which was subjected by 0.16% DES for 30 min was not obvious. The acid-production rate of mutation strain was improved only 14.10% compared with the parent strain. This implied that NTG mutation can effectively improve the acid-producing and acid-resistant of theLactobacilluscaseiLC2W.
Lactobacilluscasei;acid-producing;acid-resistant;mutation;screening
2016-05-27
何慧玲(1990-),女,硕士研究生,研究方向:食品加工,E-mail:15902736498@163.com。
*通讯作者:胡中泽(1968-),男,教授,硕士研究生,研究方向:食品加工,E-mail:huzz1968@126.com。
国家科技支撑计划项目(2013BAD18B01)。
TS252.1
A
1002-0306(2016)22-0217-06
10.13386/j.issn1002-0306.2016.22.034
