木瓜发酵液对非酒精性脂肪性肝病小鼠肝脏脂质代谢及AMPK/SIRT1通路的影响
2017-01-13吴利春侯梦莹张长城刘朝奇
涂 浩,吴利春,段 丽,尹 梦,侯梦莹,张长城,袁 丁,刘朝奇,*
(1.肿瘤微环境与免疫治疗湖北省重点实验室,湖北宜昌 443002;2.三峡大学医学院,湖北宜昌443002)
木瓜发酵液对非酒精性脂肪性肝病小鼠肝脏脂质代谢及AMPK/SIRT1通路的影响
涂 浩1,吴利春1,段 丽1,尹 梦1,侯梦莹1,张长城2,袁 丁2,刘朝奇1,*
(1.肿瘤微环境与免疫治疗湖北省重点实验室,湖北宜昌 443002;2.三峡大学医学院,湖北宜昌443002)
目的:观察木瓜发酵液对高糖高脂饲料诱导的非酒精性脂肪性肝病(NAFLD)小鼠脂质代谢及AMP激活蛋白酶(AMPK)/沉默信息调节因子1(SIRT1)通路的调控机制。方法:取雄性昆明小鼠32只,随机分为4组,即正常组、模型组、木瓜发酵液高(10 mL/kg)和低剂量组(5 mL/kg),每组8只。三周后,收集小鼠血液及组织样本。用试剂盒检测血清ALT、肝组织甘油三酯(TG)含量,分别用RT-PCR和Western Bloting检测p-AMPK和SIRT1基因的mRNA和蛋白表达水平。结果:与正常组比较,模型组小鼠病理证实肝组织脂质蓄积严重,血清ALT和肝脏TG水平明显升高(p<0.05),肝组织SIRT1、FoxO1和p-AMPK mRNA及蛋白表达均显著降低(p<0.05)。与模型组比较,木瓜发酵液明显改善肝组织脂质蓄积,肝组织TG含量明显下降(p<0.05),肝组织 SIRT1、FoxO1 mRNA和SIRT1、p-AMPK蛋白表达均显著上调(p<0.05),其中木瓜发酵液高剂量组较低剂量组效果好,但二者比较差异无统计学意义。结论:木瓜发酵液能够改善高糖高脂饮食诱导的NAFLD小鼠脂肪代谢紊乱,减轻肝脏脂质蓄积,其作用机制可能与肝细胞内AMPK/SIRT1通路的激活有关。
木瓜发酵液,非酒精性脂肪性肝病,AMPK/SIRT1通路,脂质代谢
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)为排除过量酒精因素的影响,以弥漫性肝细胞大泡性脂肪变性为主要特征的临床病理综合征疾病。流行病学研究显示,NAFLD在成年人中的发病率高达20%~33%,而在肥胖人群中的发病率高达到75%[1]。NAFLD与生活习惯,环境因素等多方面因素有关[2]。有研究显示AMPK/SIRT1通路是调节肝脏脂质代谢的重要通路[3],AMP激活蛋白酶(AMP-activated protein kinase,AMPK)能够感知机体内能量代谢的变化,并可以通过影响物质代谢的多个环节,维持肝脏糖脂代谢的平衡。沉默信息调节因子1(SIRT1)具有多种功能,与基因转录沉默、糖异生、脂质积累、胰岛素分泌等密切相关。
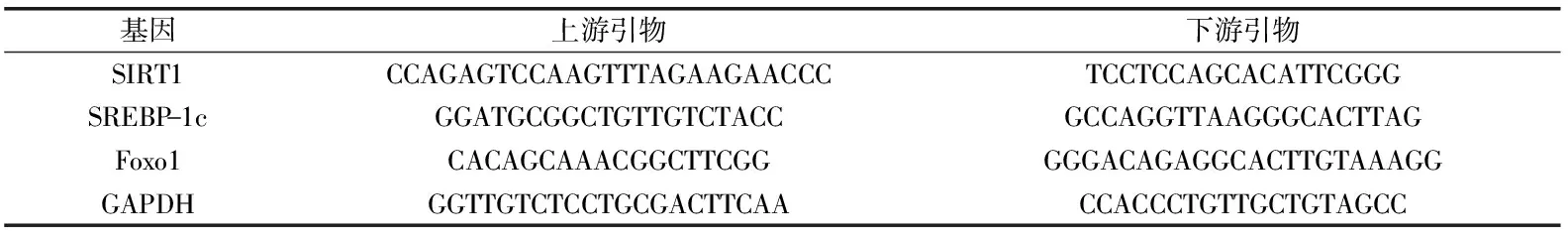
表1 PCR引物序列
木瓜(Chaenomelesspeciosa(Sweet)Nakai)为蔷薇科木瓜属植物贴梗木瓜的果实,具有食用、入药、观赏等多种用途。现代研究发现资木瓜对消化系统有较强的药理活性。前期本课题组研究发现木瓜发酵液对CCl4诱导的急性肝损伤有一定的防护作用[4]。
本研究采用高糖高脂饲料建立NAFLD小鼠模型,观察木瓜发酵液对NAFLD小鼠糖脂代谢及AMPK/SIRT1通路的影响并探讨其可能机制,为木瓜发酵液的开发利用提供了实验依据。
1 材料与方法
1.1 材料与仪器
SPF级昆明雄性小鼠 4~6周龄,体重18~22 g,三峡大学实验动物中心提供,动物生产许可证号(SCXK(鄂)2008-0005);胆固醇 国药集团化学试剂有限公司;高糖高脂饲料 按照普通饲料(56.5%)、胆固醇(3%)、胆酸钠(0.5%)、猪油(10%)、果糖(30%)重量比制备而成;总RNA提取试剂盒、逆转录试剂盒 大连宝生物科技有限公司;PCR引物 生工生物工程(上海)股份有限公司;兔单抗β- actin(sc-4778),兔多抗p-AMPKα1/2(sc-33524) 美国Santa Cruz公司;兔多抗SIRT1(#07-131) Millipore公司;羊抗兔二抗 武汉科瑞有限公司提供;显影化学发光剂ECL 碧云天生物技术研究所。
梯度PCR仪 德国Applied Biosysterms公司;Powerpas Basic蛋白电泳仪器 美国Bio-Rad公司;Gene Genius凝胶分析系统 英国SYNGNE公司;Gellogic 200凝胶成像分析系统 美国Kodak公司;DU730核酸蛋白分析仪 美国Beckman Coulter公司。
1.2 实验方法
1.2.1 木瓜发酵液的制备 按课题组已有的方法进行制备。基本过程包括:酵母菌液的活化、木瓜发酵及木瓜发酵液的处理等过程[5]。
1.2.2 非酒精性脂肪肝小鼠模型的建立 取雄性昆明小鼠32只,4~6周龄,随机分成4组,每组8只,即正常对照组、模型组、木瓜发酵液低(5 mL/kg)和高剂量组(10 mL/kg)。除正常对照组给予普通饲料外,其余各组均给予高糖高脂饲料造模,同时用木瓜发酵液低、高剂量给小鼠灌胃,持续3周;观察记录各组小鼠造模前后体质量变化、行为和状态变化。
1.2.3 小鼠生化指标检测 3周后,摘小鼠眼球取血,取小鼠肝脏,附睾脂肪,腹部脂肪,并称重,肝脏指数(%)=肝脏重量/体重×100,附睾指数(%)=附睾脂肪重量/体重×100,按照试剂盒操作说明检测血清ALT、肝组织甘油三酯(TG)含量。
1.2.4 肝脏组织HE染色 动物处死后,快速取10 mm×3 mm新鲜肝脏大叶组织块放入包埋盒中,用4%多聚甲醛溶液固定24 h,常规脱水后用石蜡包埋,切片,HE染色,光镜观察肝组织病理变化。
1.2.5 肝脏组织油红染色 取新鲜肝脏组织3块,组织块大小约为 1.0 cm×1.0 cm×1.0 cm,用OTC固定液固定肝脏组织块15 min后,在冰冻切片机上切片,切片厚度约10~15μm,进行常规油红O染色,光镜下观察肝脏脂滴分布情况。
1.2.6 RT-PCR检测小鼠肝组织SIRT1、Foxo1 和SREBP-1c mRNA的表达 按照试剂盒提供的方法提取肝脏组织总RNA,检测RNA完整性,测定其浓度,逆转录得cDNA,PCR扩增,PCR反应体系总体积为25 μL∶11 μL DEPC水,12.5 μL PCR Master mix(2×),分别加入0.5 μL SIRT1和FoxO1上下游引物,最后加入1 μL cDNA模板。

表2 小鼠NAFLD相关指标
注:与正常组比较,*:差异显著(p<0.05);与模型组比较,#:差异显著(p<0.05),##:差异极其显著(p<0.01)。使用GAPDH作为内参,引物序列见表1。产物经2%琼脂糖凝胶电泳,照胶,测定条带吸光度值,计算SIRT1、Foxo1和SREBP-1c与GAPDH吸光度比值。
1.2.7 Western Blot 检测肝组织p-AMPK、SIRT1蛋白的表达 称取50~80 mg 肝脏组织,按RIPA∶PMSF∶磷酸酶抑制剂=100∶1∶1的比例(体积比)配好裂解液,用PBS洗涤剪碎的肝脏组织后,分别加入800 μL配好的裂解液,置冰盒里充分裂解,经4 ℃、12000 r/min离心10 min后取上清,采用BCA蛋白浓度试剂盒测定蛋白浓度,将定量后的蛋白样品于100 ℃水浴10 min变性后,将蛋白样品进行电泳并转印至PVDF膜,将PVDF膜放置于5%脱脂牛奶封闭液中室温封闭1 h。分别加一抗后,置于4 ℃冰箱摇床孵育过夜,TBST洗膜,加二抗室温孵育1 h,ECL显色,用Image J软件分析条带。
1.2.8 统计学处理方法 实验数据采用 SPSS 18.0软件分析,使用Image J软件分析RT-PCR与Western Blot实验数据,数据均用均数±标准差(x±s)表示,组间数据采用单因素方差分析,以p<0.05有统计学意义。
2 结果与分析
2.1 小鼠生化指标检测
由表2可知,高脂饮食模型组小鼠的肝指数、附睾脂肪指数、血清ALT和肝脏甘油三酯含量均显著高于正常对照组(p<0.05),表明NAFLD模型诱导成功。与模型组比较,木瓜发酵液干预后可显著改善高脂饮食诱发的肝指数、附睾脂肪指数、血清ALT和肝脏甘油三酯水平的升高(p<0.05),表明木瓜发酵液可有效改善肝脏脂质代谢。
2.2 肝脏病理检测
从图1和图2可以看出,正常对照组小鼠肝组织HE和油红染色显示肝组织结构正常,可见中央静脉周围肝细胞形成的肝索呈放射状排列,结构清晰,肝细胞无脂肪变性以及炎症细胞浸润;高脂饲料模型组有一定程度的肝细胞肿胀、胞浆淡染、脂肪空泡形成及肝索结构紊乱;结果木瓜发酵液干预后肝细胞形态趋于正常,脂肪空泡明显减少,油红染色明显减少,肝组织结构基本正常。

图1 小鼠肝组织HE染色(100×)Fig.1 HE staining of liver tissue of mice(100×)注:a:正常对照;b:高糖高脂模型组;c:木瓜发酵液低剂量组;d:木瓜发酵液高剂量组;图2同。
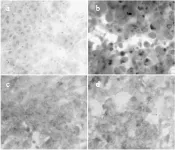
图2 小鼠肝组织油红染色(200×)Fig.2 Oil red staining of liver tissue of mice(200×)
2.3 mRNA水平检测代谢相关基因的表达
由图3可以看出,与正常组相比,模型组Foxo1和SIRT1 mRNA表达相比均显著降低(p<0.05),而SREBP-1c mRNA表达水平显著增高(p<0.05)。木瓜发酵液干预后Foxo1和SIRT1的mRNA表达水平与模型组比较显著增高,而SREBP-1c基因表达与模型组比较显著降低,表明木瓜发酵液处理显著改善高糖高脂膳食诱导的Foxo1、SIRT1和SREBP-1c基因表达异常。
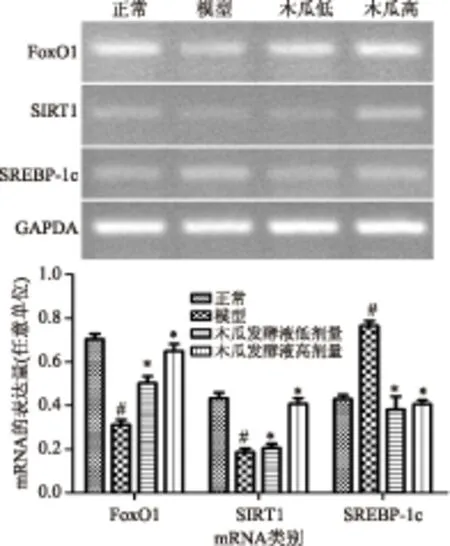
图3 肝组织中Foxo1、SIRT1和SREBP-1c基因mRNA的表达Fig.3 The mRNA expression levels of FoxO1,SIRT1and SREBP-1c mRNA in liver tissue of mice注:与正常组比较,#:差异显著(p<0.05),与模型组比较,*:差异显著(p<0.05);图4同。
2.4 Western Bloting检测能量代谢相关蛋白的表达
由图4可知,模型组SIRT1和p-AMPKα1/2的蛋白表达水平显著低于正常组(p<0.05),通过木瓜发酵液干预后可显著增加SIRT1和P-AMPKα1/2的表达。
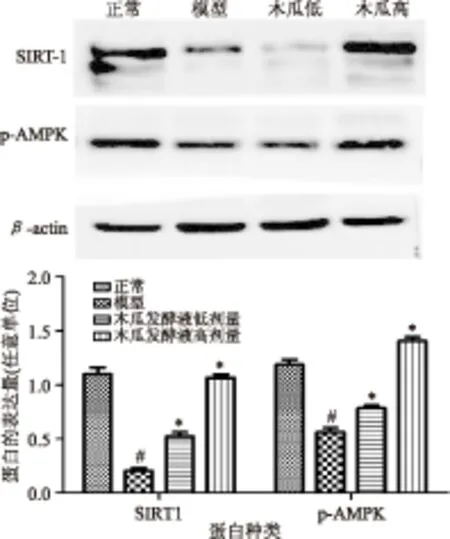
图4 肝组织p-AMPK和SIRT1蛋白的表达Fig.4 The protein expression levels of p-AMPK and SIRT1 in liver tissue
3 讨论
随着NAFLD在全球范围内发病率的逐年增高以及由此导致的肝硬化和肝癌引起的死亡率的上升,合理膳食作为预防NAFLD的新思路将受到人们的广泛关注。NAFLD属于代谢性疾病,与心脑血管疾病、糖尿病、癌症等疾病的发生发展具有密切相关性[6-7]。越来越多的研究发现多种抗氧化剂具有调节糖脂代谢活性,这可能成为今后预防治疗NAFLD新的潜在物质[8]。本实验模仿人们日常高糖高脂的饮食习惯,应用高糖高脂诱导小鼠NAFLD模型,结果发现木瓜发酵液也可以有效干预NAFLD的脂代谢紊乱,降低TG水平,改善肝脏脂质沉积。沉默信息调节因子(Sir2)相关酶类SIRTI是一种NAD+依赖的蛋白去乙酰化酶,不仅使组蛋白去乙酰化以介导基因沉默,还可与Foxo家族等多种靶基因或蛋白相互作用,对细胞生存、衰老、炎症反应和氧化应激等起到十分重要的调节作用。有研究发现二甲双胍可激活SIRT1,通过SIRT1-Foxo诱导细胞自噬的信号通路,改善ob/ob小鼠肝脏脂质沉积[9]。在本研究也发现,在NAFLD小鼠中SIRT1和Foxo1的表达降低,木瓜发酵液干预后可有效逆转SIRT1和Foxo1的表达,从而降低肝脏GT的水平。木瓜素有“百益果王”的美称,具有和肝和胃,降血压等功效。木瓜果实营养全面,含有糖类、蛋白质、多种维生素和矿物质多种营养成分,木瓜中所含的齐墩果酸成分具有降低转氨酶活性、促进肝细胞再生、防止肝硬化等功效。木瓜中的黄酮类物质具有稳定血管、降低血压、抗各种溃疡等作用[10]。木瓜发酵液中也富含这些物质,具有改善肝脏脂质代谢的功效。
应用雄性C57BL/6J小鼠高脂饮食制备的NAFLD模型中,给予α-硫辛酸(alpha-lipoic acid)进行干预,发现α-硫辛酸增强Sirtuin 1去乙酰化酶活性,激活AMPK的蛋白激酶[11]。通过激活Sirtuin 1/LKB1/AMPK通路,阻止SREBP-1c的入核和Foxo1进入细胞质,增加脂肪甘油三酯脂肪酶的表达和减少脂肪酸合酶的丰度。本实验的RT-PCR和Western Blot结果也显示木瓜发酵液增强Sirtuin 1去乙酰化酶活性,激活AMPK的蛋白激酶,降低SREBP-1c的表达,从而改善肝脏脂质代谢。
4 结论
通过高糖高脂饮食建立了肝细胞脂肪变性体内模型,实验结果表明木瓜发酵液可有效改善肝细胞脂肪变性,在分子水平通过调节AMPK/SIRT 1信号通路改善肝脏脂质代谢。此研究可为合理开发木瓜发酵液防治NAFLD提供新的思路。
[1]Mishra A,Younossi Z M. Epidemiology and natural history of non-alcoholic fatty liver disease[J]. La Revue Du Praticien,2012,62(10):135-144.
[2]Goyal N P,Schwimmer J B. The progression and natural history of pediatric non-alcoholic fatty liver disease[J]. Clinics in Liver Disease,2016,20(2):325-338.
[3]Santamarina A B,Oliveira J L,Silva F P,et al. Green tea extract rich in Epigallocatechin-3-Gallate prevents fatty liver by AMPK activation via LKB1 in mice fed a high-fat diet[J]. Plos One,2014,10(11):1-18.
[4]汤超,汤文凡,刘朝奇,等. 木瓜发酵液对小鼠四氯化碳诱发肝损伤的防护作用[J].食品科学,2013,34(13):271-274.
[5]焦新生,刘朝奇,逯平杰,等. 木瓜发酵工艺及其抗氧化活性研究[J]. 中华中医药杂志,2009(S1):97-99.
[6]Salomone F,Godos J,Zelber-Sagi S. Natural antioxidants for non-alcoholic fatty liver disease:molecular targets and clinical perspectives[J]. Liver International Official Journal of the International Association for the Study of the Liver,2016,36(1):5-20.
[7]Ajmera V H,Vanwagner L B,Gunderson E P,et al. 461 gestational diabetes mellitus is strongly associated with non-alcoholic fatty liver disease[J]. Gastroenterology,2016,111(5):658-664.
[8]Salomone F,Godos J,Zelber-Sagi S. Natural antioxidants for non-alcoholic fatty liver disease:molecular targets and clinical perspectives[J]. Liver International Official Journal of the International Association for the Study of the Liver,2016,36(1):5-20.
[9]Young Mi S,Yong-Ho L,Ji-Won K,et al. Metformin alleviates hepatosteatosis by restoring SIRT1-mediated autophagy induction via an AMP-activated protein kinase-independent pathway[J]. Autophagy,2015,11(1):46-59.
[10] 邹传宗. 木瓜活性成分及药理作用研究概述[J]. 园艺与种苗,2012(3):55-58.
[11] Yang Y,Li W,Liu Y,et al. Alpha-lipoic acid improves high fat diet-induced hepatic steatosis by modulating the transcription factors SREBP-1,FoxO1 and Nrf2 via the SIRT1/LKB1/AMPK pathway[J]. Journal of Nutritional Biochemistry,2014,25(11):1207-1217.
Effects of fermentedChaenomelesspeciosajuice on lipid metabolism and AMPK/SIRT1 pathway in mouse with non-alcoholic fatty liver disease
TU Hao1,WU Li-chun1,DUAN Li1,YIN Meng1,HOU Meng-ying1, ZHANG Chang-cheng2,YUAN Ding2,LIU Chao-qi1,*
(1.Hubei Key Laboratory of Tumor Microenvironment and Immunotherapy,Yichang 443002,China 2. Medical College,Three Gorges University,Yichang 443002,China)
Objective:To observe the effects of fermentedChaenomelesspeciosaJuice(FCJ)on the lipid metabolism and AMPK/SIRT1 pathway of non-alcoholic fatty liver disease(NAFLD)mice induced by high sugar and fat diet. Methods:Thirty-two SPF male Kunming mice were divided randomly into four groups:the control group,the model group,the high-dose FCJ-treated group(10 mL/kg),and the low-dose FCJ-treated group(5 mL/kg). After the treatment of three weeks,the blood and liver samples were collected. The activity of ALT in serum and triglyceride(TG)in liver tissues were detected with detection kits. The histology of liver tissues was observed with HE and red oil O staining. The mRNA and protein expression levels of p-AMPK and SIRT1 in liver tissues were measured with RT-PCR and Western Bloting. Results:Compared with the normal group,hepatic lipid accumulation of model group was severe showed by histopathological examination,the serum levels of ALT and TG in the liver tissue were increased significantly(p<0.05),the expression levels of SIRT1,FoxO1 mRNA and SIRT1,P-AMPK protein of liver tissues were significantly decreased(p<0.05). Compared with the model group,the hepatic lipid accumulation in FCJ-treated groups was obviously ameliorated,the serum ALT and TG levels of FCJ-treated groups were significantly decreased(p<0.05),the expression levels of hepatic SIRT1,FoxO1 mRNA and p-AMPK,SIRT1 protein in FCJ-treated groups were significantly up-regulated(p<0.05). The effect of high dose group was better than the low dose group,but the two were not statistically significant. Conclusion:FCJ can ameliorate the disorder of lipid metabolism in the NAFLD mice induced by feeding high sugar and fat diet,and the mechanism may be related to the activation of AMPK/SIRT1 pathway in hepatocytes.
fermentedChaenomelesspeciosaJuice;non-alcoholic fatty liver disease;AMPK/SIRT1 pathway;lipid metabolism
2016-05-24
涂浩(1991-),男,在读硕士研究生,研究方向:药理学,E-mail:tuhaofirst@163.com。
*通讯作者:刘朝奇(1962-),男,博士,教授,研究方向:分子生物学和免疫药理学,E-mail:ctgulcq@163.com。
国家自然科学基金项目﹙81473461﹚;三峡大学研究生科研创新基金(SDYC2016092)。
TS201.3
A
1002-0306(2016)22-0340-05
10.13386/j.issn1002-0306.2016.22.058
