四个品种小型猪血液学指标测定及比较
2017-01-12杨李厂周文兵周新初张建平杨伟敏
杨李厂, 周文兵, 丁 隽, 周新初, 张建平, 谢 东, 杨伟敏
(1. 上海睿智化学研究有限公司, 上海 201203; 2. 上海交通大学农业与生物学院, 上海 200240; 3. 上海甲干生物技术有限公司,上海 201112)
四个品种小型猪血液学指标测定及比较
杨李厂1, 周文兵1, 丁 隽1, 周新初2, 张建平3, 谢 东1, 杨伟敏1
(1. 上海睿智化学研究有限公司, 上海 201203; 2. 上海交通大学农业与生物学院, 上海 200240; 3. 上海甲干生物技术有限公司,上海 201112)
目的 分析比较四个品种小型猪的血液学生物学特性。方法 分别选取上海地区饲养的巴马小型猪、贵州小型猪和版纳小型猪及陆川小型猪,每个品种雌雄各20头,3~6月龄,测量其血液生理、血清生化与血凝指标,然后进行单因素方差分析,并进行数据比较。结果 四个品种的小型猪血液生理14个指标差异有统计学意义(P<0.05),血清生化12个指标组间差异有统计学意义(P<0.05),血凝4个指标差异都有统计学意义(P<0.05)。分别对各品种群体数据进行比较分析,巴马小型猪群体雌雄间血液常规、血清生化和血凝指标差异显著(P<0.05)的指标分别有6项、4项和3项,而贵州小型猪、版纳小型猪和陆川小型猪雌雄间差异指标较少或差异不显著。四品种小型猪相同性别间比较,也有较多指标差异显著。结论 测定和比较的巴马小型猪、贵州小型猪、版纳小型猪和陆川小型猪在血液学、血清生化和血凝等方面数据,为应用和选择小型猪开展相关生物医学和药物研究提供了基础数据。
巴马小型猪; 贵州小型猪; 版纳小型猪; 陆川小型猪; 血液生理; 血清生化; 血凝
中国小型猪品种资源丰富,1980年代已经开始开发。上海本地虽没有原产的小型猪品种,但上海在国内最早制定了实验用小型猪地方标准[1],首先详细规定了实验用小型猪的遗传分类方法,规范了环境与设施的技术要求。由于小型猪在解剖学、生理学、营养代谢等方面与人类相似,近年来被广泛应用在药物代谢动力学、药效动力学、药理以及毒理学研究中。
小型猪是模拟人类疾病模型的重要实验动物,在模型研究中血液学特性的检测尤为重要,本试验测定饲养于上海地区的巴马小型猪、贵州小型猪、版纳小型猪和陆川小型猪的血液学特性,并比较了各品种间的差异,以期为相关研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 实验动物 3~6月龄普通级巴马小型猪、贵州小型猪、版纳小型猪各40头,雌雄各半,由上海市浦东新区老港镇华新特种养殖场提供 [SCXK (沪) 2012-0013],种源分别来自广西、贵州和云南原产地; 3~6月龄普通级陆川猪40头,雌雄各半,由上海甲干生物科技有限公司提供[SCXK(沪)2010-0028],种源来自广西陆川。
1.1.2 动物饲养条件 普通级环境,每日定时、定量饲喂猪饲料, 自由饮水。
1.2 方法
1.2.1 血样采集 所有动物采血前禁食过夜(12~15 h),清醒状态下前腔静脉取血, 每只动物采血量为5~6 mL,分别用于血液学、血清生化和血凝指标的测定。
1.2.2 血液生理指标检测 取1 mL全血用EDTA抗凝,以SysmexXT-200iv全自动五分类动物血液分析仪检测各品种小型猪的红细胞数(RBC)、白细胞数(WBC)、血红蛋白(HGB)、红细胞比积(HCT)、平均红细胞体积(M C V)、平均红细胞血红蛋白(MCH)、平均血红蛋白浓度(MCHC)、红细胞容积分布宽度(RDW)、血小板数(PLT)、中性粒细胞数(NE)、淋巴细胞数(LY)、嗜酸粒细胞数(EO)、单核细胞数(MO)、嗜碱粒细胞数(BA)等14项指标。
1.2.3 血清生化指标的检测 取3 mL非抗凝血离心分离血清, 用Olympus AU400全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、肌酸激酶(CK)、总蛋白(TP)、白蛋白(ALB)、肌酐(CRE)、尿素氮(BUN)、总胆红素(TBIL)、甘油三酯(TG)、葡萄糖(GLU)、总胆固醇(TC)等12项生化指标。
1.2.4 血凝指标检测 取1.8 mL全血用柠檬酸钠抗凝,Destiny Plus全自动血凝仪(Trinity Biotech)检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原含量(FIB)、凝血酶时间(TT) 等4项指标。
1.2.5 数据处理 检测结果以表示,实验数据采用SPSS16.0统计软件进行统计处理。多组均数比较首先进行方差齐性检验,然后进行单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 血液生理指标
2.2 血清生化指标
通过对12个项目血清生化检测指标进行方差分析,结果显示四个品种间血清生化指标全部呈显著差异 (P<0.05) ,特别是碱性磷酸酶 (ALP) 和肌酸激酶(CK)。巴马小型猪群体有4项血清生化指标(ALT、ALB、ALP和TC)性别间差异显著。四品种小型猪雄性群体比较,血清生化指标中只有TBIL差异不显著,其余11项目指标均呈差异显著;雌性群体比较,血清生化指标只有ALB差异不显著,其余11项目指标均呈差异显著。详见表2。
2.3 血凝指标
血凝检测结果如表3。所有4个检测项目中,四个品种间差异都达到显著水平 (P<0.05)。巴马小型猪群体有3项血凝指标PT、APTT和FIB在雌雄间呈显著差异。四品种小型猪各品种雌雄群体分别比较,所有雌性和雄性品种群体间4项血凝指标都呈差异显著。
3 讨论
本研究表明,相对于其它小型猪品种,巴马小型猪的性别间血液学指标差异较大,巴马小型猪与另外三品种小型猪之间存在显著差异的指标较多,尤其是雄性群体之间差异更明显。这些在相关实验设计时都需要特别关注。
不过国内的小型猪资源丰富,除目前已经培育成功的巴马小型猪、贵州小型猪、版纳小型猪、五指山小型猪和西藏小型猪等几个常用品种外,各地都有利用当地小型猪资源进行医学研究,并陆续被应用于心血管疾病模型、代谢研究、口腔疾病模型甚至神经学等诸多领域[2]。生物学特性作为小型猪的基础应用研究,各品种的相关研究颇多,但是类似本文对多个品种小型猪的比较研究很少。由于缺少比较数据,使用不同种小型猪进行医学研究,将所获得的大量研究成果进行比较也会缺乏基础数据支持。
本试验首次选取了上海地区引入和饲养的四个品种小型猪进行血液学特性的检测与比较分析,得到了较为可靠的基础数据。取得的数据与中国实验用小型猪[3]的9项指标WBC、RBC、PLT、MCHC、RDW、HGB、HCT、MCV和MCH进行比较后发现各项均值都相近。本试验巴马小型猪WBC均值大于陈克研报道[4]的数据,其他指标差异较小; RBC与胡延廷等报道[5]的数据差异显著, 其余指标均值差异小或是无显著性差异。与连林生等报道[6]的版纳小型猪的血液生理均值相比,本试验中的版纳小型猪的WBC、HGB、HCT和PLT差异较大。在已有的参考指标,四个品种血液生理指标数值接近北京DB11T 828.4-2011的参考数据[7]。
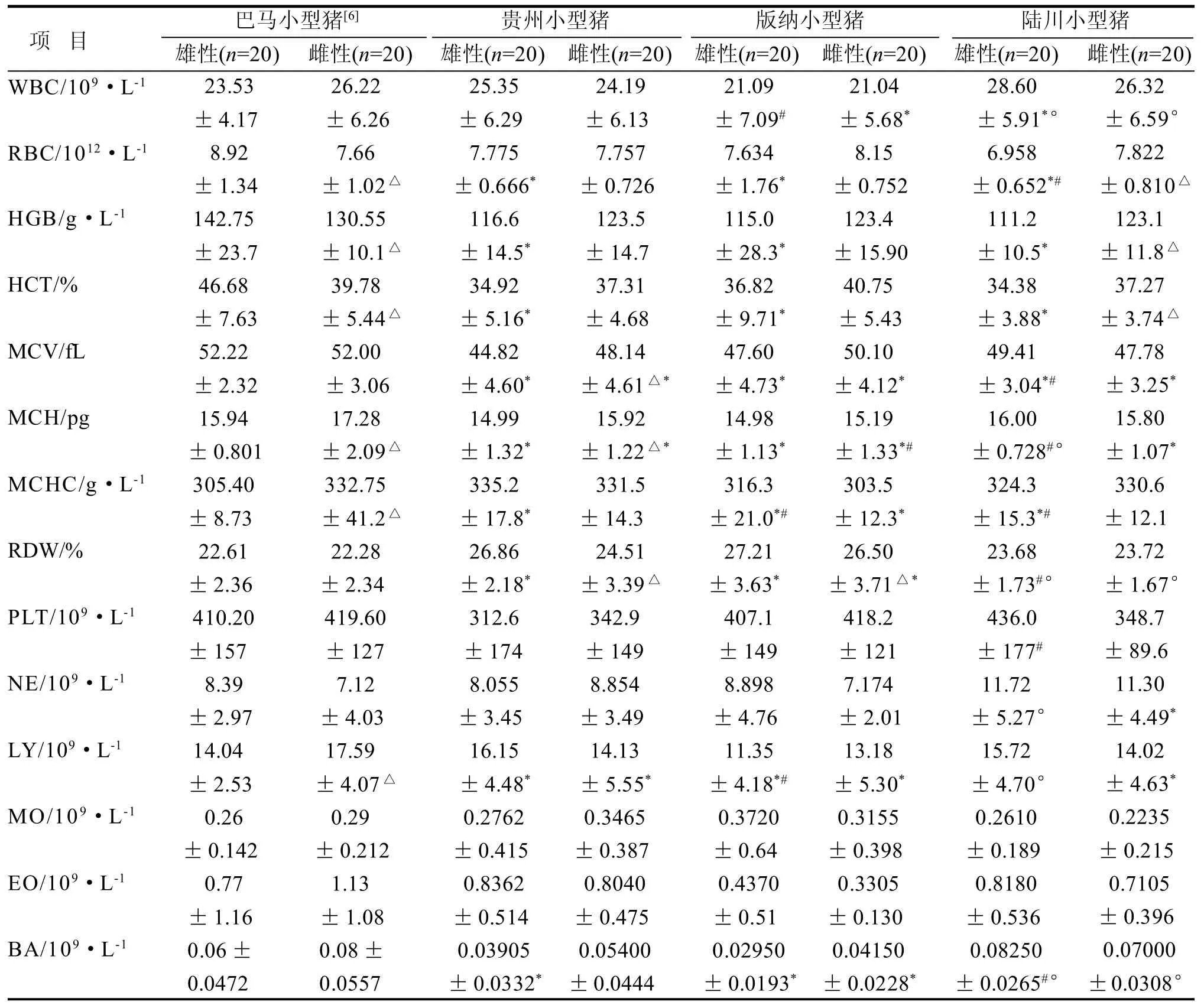
表1 四品种小型猪血液生理指标
血清生化指标在4个品种小型猪两个性别群体间的差异明显,与已有文献[4-6,8]报道的小型猪生化检测结果相比,数据范围相近。与丹麦的哥廷根小型猪参考范围相比[9],四个品种小型猪的大部分血清生化指标与其都接近, 数据范围同北京DB11T 828.4-2011的参考范围也都接近。
仪器和试剂等因素虽然能对同类试验的结果产生重大影响,但是这两个因素也最容易控制。本试验重点排除了动物相关的外界因素如生理状态、饲养环境和反应应激等对结果的干扰。生理因素是影响血液生理指标的重要因素之一, 如动物年龄、性别、品种、精神状态、活动情况、饮食及用药情况等都会影响血液生理检测结果。有研究报道[10],幼龄犬猫的RBC计数低于成年犬猫,国外研究结果[11]显示幼龄小型猪的RBC、HGB、HCT、MCHC和MCV比成年小型猪低。动物在剧烈运动或是外界因素刺激下, 肾上腺素分泌会升高,导致嗜中性粒细胞计数增加。因为日常与小型猪接触最多的是饲养员,本实验的小型猪在采血时由饲养员抓取保定,熟练实验技术员采集血样,尽量减小人为因素对小型猪生理以及血样质量的影响。
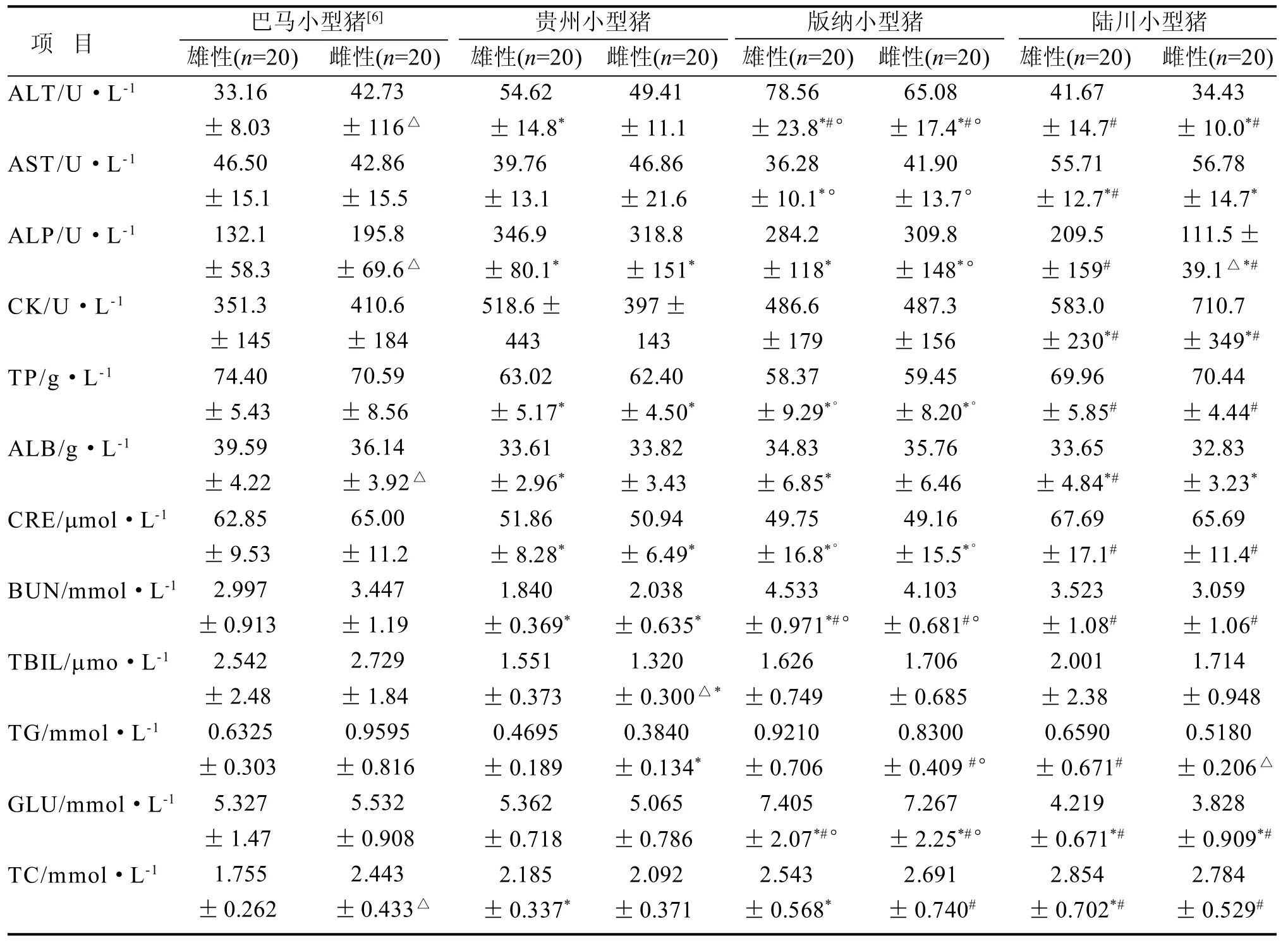
表2 四品种小型猪血清生化指标
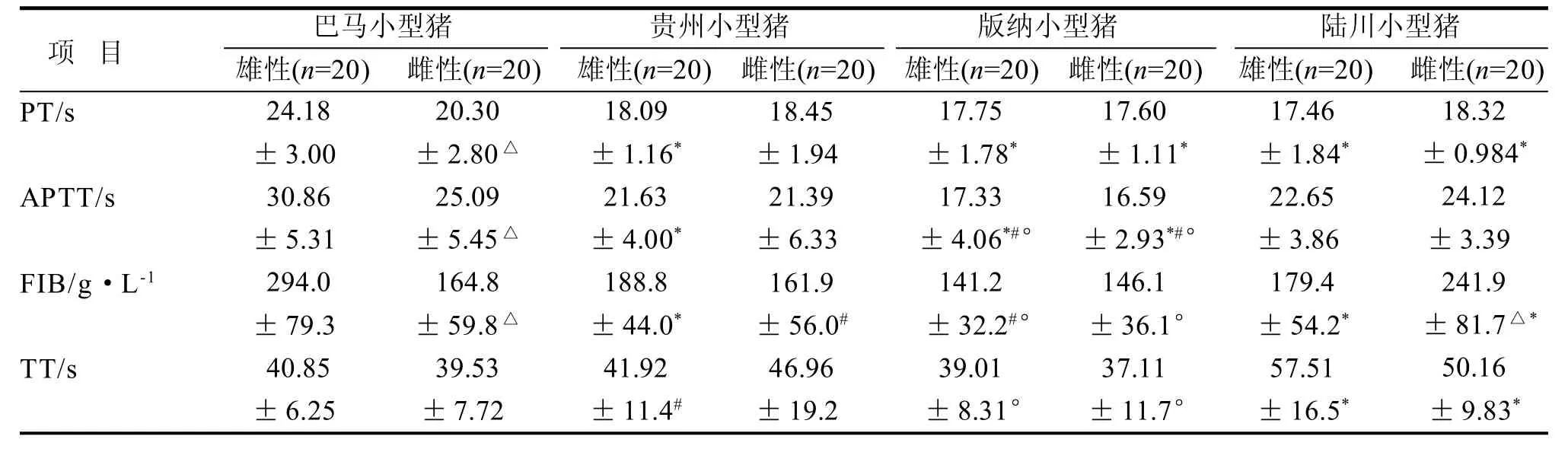
表3 四品种小型猪血凝指标
影响血清生化的动物相关因素也非常众多,并且同一因素还可能对不同指标产生相反的影响。例如仔猪离乳前后血清AMYL活性一直在升高,差异极显著; 血清TP、ALB、GLU含量在离乳后下降, 差异显著或极显著[12]。对于国内养殖场而言,最需要考虑的影响因素应该是高温和饲料添加剂。现有研究[13]表明, 高温条件下猪的血清总蛋白(第2 天)、球蛋白(第21天)、葡萄糖(第2天)、总胆固醇(第1、2、4天)及甘油三酯(第1天)含量均会显著降低。目前养殖企业使用的饲料添加剂种类众多,尤其是抗生素添加很普遍。绝大部分抗生素都会对动物的肝功能和肾功能产生影响。但是营养性的添加剂也可能导致猪群体血清生化指标的差异。对离乳仔猪日粮中添加植酸酶研究[14]表明,42日龄的仔猪血清中的葡萄糖、血清尿素氮和血清碱性磷酸酶水平,分别降低15.2%、22.2%和29.5%; 不过T3、T4和胰岛素水平却分别提高了15. 6%、4.4%和10.9%。
本试验采集的动物样品均来自实验动物养殖场,采用符合上海市地方标准的动物饲料,养殖场内也有较一般养殖场更严格的温度控制措施。因此,其研究数据能够为未来的医学模型研究和药物研究提供更好基础数据支持。
[1] DB31/T 240-2001, 实验动物 实验用小型猪[S].
[2] 袁进, 顾为望. 小型猪作为人类疾病动物模型在生物医学研究中的应用 [J]. 动物医学进展, 2011, 32(2):108-111.
[3] 冯媛媛, 白雪源, 贺津, 等. 中国实验用小型猪血液指标正常参考值分析[J]. 2013, 40(6):139-141.
[4] 陈克研, 师文, 孙倩, 等. 巴马小型猪在辽宁地区的适应性观察及血液生理生化指标检测[J]. 2014, 41(12):182-185.
[5] 胡建廷, 屈卉锦, 王韶艳, 等. 普通级巴马小型猪部分血液学指标的测定 [J]. 动物学进展, 2011, 32(9):66-68.
[6] 连林生, 王鹤云, 徐家珍, 等. 版纳微型猪的生物学特性 [J].上海实验动物科学, 1993, 13(4):185~191.
[7] DB11/T 828.4-2011 [S]. 实验用小型猪 第4部分: 病理学诊断规范.
[8] 郭雄明, 姚春涛, 赵玉琼, 等. 两个品系普通级和SPF级小型猪部分血液学指标的比较 [J]. 中国比较医学杂志, 2009, 19(2):40-42.
[9] Ellegaard L, Jorgensen KD, Klastrup S, et al. Hematologic and clinical chemical values in 3 and 6 months old Gottingen minipigs[J]. Scand J Lab Anim Sci , 1995, 22(4):239-248
[10] 何玉英, 陈艳云, 夏兆飞. 浅谈犬猫血常规检验的影响因素[J]. 中国兽医杂志, 2012, 48 (4):70-71.
[11] Yeom SC, Cho SY, Park CG, et al. Analysis of reference interval and age-related changes in serum biochemistry and hematology in the specific pathogen free miniature pig[J]. Lab Anim Res, 2012, 28(4):245-253.
[12] 李玉冰. 仔猪断奶应激对血清生化影响的研究[C]. 京津冀畜牧兽医科技创新交流会暨新思想、新观点、新方法论坛论文集. 河北: 2008.
[13] 刘圈炜, 卢庆萍, 张宏福,等. 持续高温对生长猪血清生化指标及肌肉营养物质含量的影响[J]. 动物营养学报, 2010, 22(5):1207-1213.
[14] 蔡青和, 计成, 岳洪源. 玉米豆粕型日粮中添加植酸酶对断奶仔猪生产性能、养分消化率及血清生化指标的影响[J]. 动物营养学报, 2004, 16(2):15-21.
Investigation on Biological Characteristics of Blood for Four Breeds of Minipigs
YANG Li-chang1, ZHOU Wen-bing1, DING Jun1, ZHOU Xin-chu2, ZHANG Jian-ping3, XIE Dong1, YANG Wei-min1
(1. Shanghai Chempartner Co. Ltd, Shanghai 201203, China; 2. School of Agriculture and Biology, Shanghai Jiaotong University, Shanghai 200240, China; 3. Shanghai Jiagan Bio-tech Co. Ltd, Shanghai 201112, China)
Objective To analyze and compare of the biological characteristics of the blood of four breeds of minipigs.MethodThe four breeds of minipigs including Bama minipigs, Guizhou minipigs, Banna minipigs and Luchuan minipigs at the age of 3 to 6 months reared in Shanghai area were selected to determine the hematology, serum biochemistry and blood coagulation values with 40 (half males and half females) in each breed. All data were analyzed by one-way ANOVA method and then compared.ResultAmong the four breeds of minipigs, 14 parameters of hematology, 12 parameters of serum biochemistry and 4 parameters of blood coagulation were significant different (P<0.05). Compared the results between males and females, 6 hematologic parameters, 4 serum biochemistry parameters and 3 blood coagulation parameters in Bama minipig were significantly different (P<0.05), a few parameters or no parameters of blood in Guizhou minipigs, Banna minipigs and Luchuan minipigs were significant different. There are many parameters existing significant different between same gender among four minipigs breeds. ConclusionThe parameters of hematology, serum biochemistry and blood coagulation of Bama minipigs, Guizhou minipigs, Banna minipigs and Luchuan minipigs provide the abundant biological data support when applying and selecting minipig for medical science model research and pharmaceutical research.
Bama minipig; Guizhou minipig; Banna minipig; Luchuan minipig; Hematology;
Q95-33
A
1674-5817(2016)06-0441-06
10.3969/j.issn.1674-5817.2016.06.008
2016-06-21
上海市实验动物创新行动计划项目 (13140900200)
杨李厂(1981- ), 男, 硕士, 研究方向: 动物生理/生化。 E-mail: lchyang@chempartner.cn
杨伟敏, 高级实验师, 研究方向: 实验动物科学与管理。 E-mail: wmyang1@chempartner.cn
Serum biochemistry; Blood coagulation
