颅内注射无水乙醇致小鼠脑损伤模型的初步观察
2017-01-12戴有金侯道荣
胡 凡, 戴有金, 侯道荣
(南京医科大学, 南京 210000)
颅内注射无水乙醇致小鼠脑损伤模型的初步观察
胡 凡, 戴有金, 侯道荣
(南京医科大学, 南京 210000)
目的 经颅注射无水乙醇建立小鼠脑损伤模型。方法 60只 ICR小鼠分为6组,颅内注射不同剂量的无水乙醇,建立小鼠脑损伤模型。7 d后对各组小鼠脑组织做病理、丙二醛 (MDA)、超氧化物歧化酶 (SOD)和基因表达等检测。结果 15 μL无水乙醇剂量组的死亡率为30%,造模成功率为100%; 造模后各实验组初期表现为行走和平衡功能障碍,后期恢复正常,但采食量和体质量明显下降。脑损伤造模后,神经细胞出现坏死,周围出现水肿并伴有神经元细胞和神经胶质细胞的细胞间隙扩大; 微血管外间隙扩大并且血管内有血细胞渗出; 神经细胞和神经胶质细胞的出现空泡样病变。脑组织SOD活性下降和MDA含量显著升高。Q-PCR检测环氧合酶-2(Cox-2),血管内皮细胞生长因子(VEGF)和突触小体相关蛋白-25(SNAP-25) mRNA表达水平结果表明,与对照组相比,各实验组COX-2, VEGF和SNAP-25 mRNA的表达显著升高。结论 颅内注射无水乙醇建立小鼠脑损伤模型较传统大鼠脑损伤模型的建立操作简单、模型表型均一,重复性好,成功率高。
脑损伤; 模型; 小鼠
在我国,脑损伤的发病率、致残率和病死率较高,严重威胁着人类的健康和生命安全,因此,脑损伤的研究已成为当今医学的研究热点之一。理想的脑损伤动物模型是进行脑外伤研究的基础,1970年代初,颅脑损伤的实验研究才开始起步。1981年,Feeney 等[1]参照动物脊髓损伤模型,设计了自由落体脑损伤装置,用于大鼠脑损伤实验研究。目前已设计了不同类型的脑损伤模型,如冻伤性脑损伤模型、液压伤脑损伤模型和自由落体脑损伤模型等[2-4]。各种脑损伤动物模型各有利弊,应用的侧重点也有差异。但在基础研究中尚缺乏一种完全符合再现性好、重复性强、可定量分级、适应性广和操作简单等要求的脑损伤动物模型。本研究采用颅内注射无水乙醇方法建立小鼠脑损伤模型, 以期为相关的脑损伤研究提供实验基础。
1 材料与方法
1.1 实验动物
清洁级雄性成年ICR小鼠60只, 体质量25~30 g,购自南京医科大学实验动物中心[SCXK (苏)2016-0002]。所有小鼠于南京医科大学动物中心清洁级设施饲养, 自由饮水、采食[SYXK (苏)2013-0015]。
1.2 主要仪器及试剂
2 ,3 ,5 -三苯基氯化四氮唑(TTC), T8877,美国Sigma公司; TRIzol试剂B5704-1,RT-PCR试剂盒,RR037A,日本Takara公司; 引物, 南京锐真生物公司; Q-PCR试剂盒,LC96, 瑞士Roche公司; Q-PCR仪,美国Applied Biosystems公司; 全自动组织脱水机、包埋机,日本樱花公司; 丙二醛(MDA,货号: A003-1)和超氧化物歧化酶(SOD, 货号: A001-1)检测试剂盒,南京建成生物工程研究所。
1.3 动物模型建立
小鼠分为6组,每组10只。实验组分为5 μL、10 μL、15 μL、20 μL和25 μL乙醇组, 对照组即假手术组,颅内注射质量分数0.9% 氯化钠5 μL。实验组小鼠称重后腹腔注射(0.2 mL/10 g)体积分数2%的水合氯醛麻醉。以bregma点为原点,后侧0.1 mm, 左侧1.0 mm, 使用牙科钻在颅骨钻孔后, 微量注射器缓慢注射相应体积无水乙醇, 深度3.0 mm,注射完毕停留数分钟,缓慢拔针,防止脑脊液渗出。注射完成后放回笼内饲养。每天称重并观察活动、采食和精神状态, 7 d后处死取脑组织检测。
1.4 行为学检查
随机选取造模前和造模后24 h各组小鼠(每组5只)进行神经损伤严重程度评分(NSS)[5],判断各组小鼠的脑损伤程度。
1.4 小鼠脑TTC染色
小鼠脱颈椎处死, 断头快速取脑, 脑组织 -20 ℃冰冻5 min后, 由前极向后冠状每隔2 mm切片。切片置于含2%TTC的0.2 mol/L磷酸缓冲液(pH 7.4)中,37 ℃ 避光孵育30 min后,在体积分数10%的中性甲醛溶液中固定后拍照。
1.5 小鼠脑组织病理观察
6 d后将小鼠处死,取出脑组织,10%甲醛溶液容器中固定,延长轴切开并脱水包埋。对蜡块进行切片(4 μm),用HE染色后置于载玻片进行固定,光学显微镜下观察脑组织病理形态学改变。
1.6 脑组织MDA和SOD测定
每组小鼠处死后,迅速打开颅腔取出脑组织,准确称取重量。在冰盘上用冷生理盐水冲洗,除去血液,滤纸拭干,放在小烧杯中按重量(g): 体积(mL)=1∶9的比例加入冷生理盐水,然后在冰上用眼科小剪刀尽快剪碎组织,放入匀浆管,补足冷生理盐水制成组织匀浆。组织匀浆用4 ℃离心10 min (3 000 r/min),取上清液进行SOD活性、MDA含量测定,具体操作方法均按南京建成生物工程研究所试剂盒说明书进行。
1.7 脑组织环氧合酶-2(COX-2), 血管内皮细胞生长因子(VEGF)和突触小体相关蛋白-25(SNAP-25) mRNA的表达
在1.5 mL无RNA酶离心管中将脑组织样品剪碎后,使用超声研磨机制成组织匀浆。使用TRIzol裂解细胞并抽提组织RNA。 参照RT-PCR试剂盒说明书逆转录成cDNA用于目的基因PCR扩增。程序设定为预变性95 ℃,10 min; 变性95 ℃,15 s;退火52~56 ℃,30 s; 延伸72 ℃, 30 s; 40个循环。各基因引物序列见表1。采用GraphPad Prism 5软件进行数据处理。
1.8 统计学方法
2 结果
2.1 一般观察
无水乙醇颅内注射后实验组小鼠较假手术对照组小鼠行动明显减少, 被毛凌乱, 无光泽。早期运动时头和身体向右侧偏斜, 1 h后恢复正常。15 μL、20 μL和25 μL组在1~2 d内出现死亡,15 μL和20 μL实验组的死亡率分别为30%和70%, 25 μL组死亡率为100%。对照组、5 μL和10 μL实验组未出现死亡各实验组术后1周体质量和采食量明显下降。

表1 Q-PCR引物列表
2.2 小鼠脑损伤后NSS评分
对照组小鼠NSS分值在造模前后无明显变化,而乙醇注射的各组小鼠造模后24 h NSS分值明显增高(P<0.01)(表2)。

表2 各组小鼠脑损伤前后 NSS分值比较
2.3 脑组织TTC染色
TTC是脂溶性光敏感复合物,与正常组织中的脱氢酶反应呈红色,而缺血组织内脱氢酶活性下降,不能反应产生变化而呈苍白色。TTC染色结果显示无水乙醇注射后脑组织出现坏死灶,呈苍白色; 梗死脑组织边界清晰(图1A, C),对照组未见异常(图1B)。
2.4 脑组织病理学检查
实验组注射部位主要病理改变为神经细胞周围出现水肿,神经元细胞和神经胶质细胞的细胞间隙扩大;微血管外间隙扩大并且血管内有血细胞渗出;神经细胞和神经胶质细胞的出现空泡样病变(图1F~G)。对照组脑组织微血管形态正常,神经元排列整齐(图1D)。
2.5 脑组织MDA和SOD水平检测
与对照组相比,无水乙醇颅内注射7 d后显著性降低脑组织中SOD的活力(P<0.01); 脑组织中MDA的含量水平显著升高(P<0.01)(表3)。
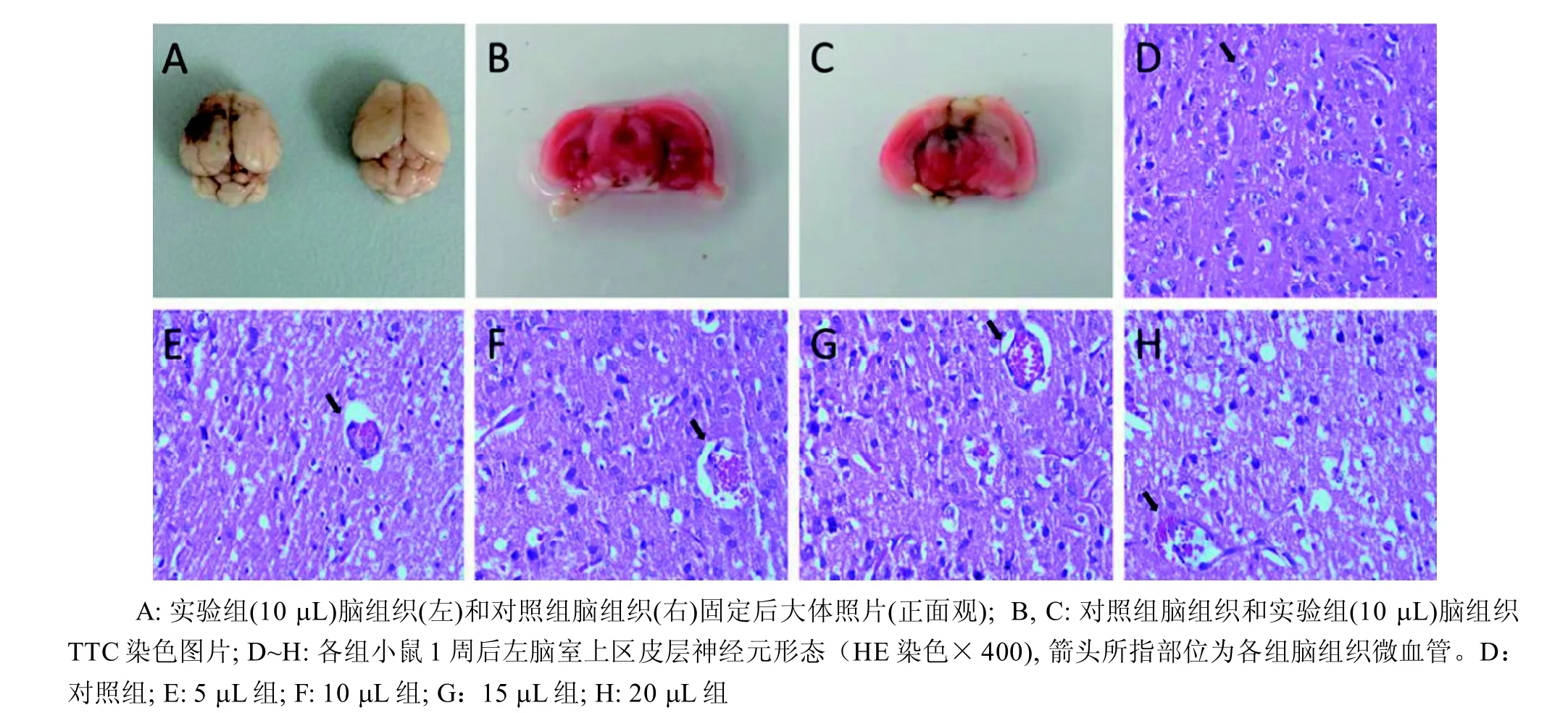
图1 各组小鼠脑组织TTC和HE染色

表3 各组小鼠脑组织匀浆中MDA和SOD水平
2.5 脑组织COX-2, VEGF和SNAP-25 mRNA表达
与对照组比较,特别是乙醇注射量大于5 μL时,COX-2, VEGF和SNAP-25 mRNA表达差异显著(P<0.05)(表4)。

表4 造模后各组小鼠脑组织COX-2, VEGF和SNAP-25 mRNA表达变化(-ΔΔ Ct)
3 讨论
乙醇是一种亲神经毒性物质,具有脂溶性,极易透过血脑屏障,与脑中丰富的卵磷脂结合,使神经细胞变性、神经纤维脱髓鞘、大脑皮质神经元活动受到抑制, 产生持久的神经毒性作用, 对中枢神经和周围神经均可造成损伤[6]。大脑有很高的氧代谢率,其对于由乙醇引起的氧化应激损伤尤为敏感。因此乙醇对肝、脑的损伤最为严重[7,8]。
本研究使用颅内注射无水乙醇的方法制作小鼠脑组织损伤动物模型。动物颅内注射不同剂量的乙醇后出现不同程度的死亡。存活的动物采食量和体质量显著下降。乙醇注射后早期出现歪脖,身体向右侧倾斜运动等行为症状,这一症状和大鼠颅内乙醇注射症状相似[9]。造模前后NSS评分也表明造模后小鼠出现了明显的脑组织损伤。小鼠的脑损伤主要病理改变为神经细胞周围出现水肿和坏死,神经元和神经胶质细胞的细胞间隙扩大; 微血管通透性增加并且血管内有血细胞渗出形成微血栓; 神经细胞和神经胶质细胞的出现空泡样病变; 同时还引起脑组织超SOD下降和MDA显著升高。SOD和MDA的水平或活性的高低与氧自由基导致的脑损伤相关。以上结果和放射、冷冻以及缺血所致动物脑损伤的结果相似[10-13]。
本研究中脑内乙醇注射引起SNAP-25, VEGF,COX-2的表达升高。SNAP-25是主要存在于中枢神经系统的蛋白质, 对毒物敏感且对神经递质的释放起重要作用[14]; SNAP-25 mRNA 表达增加说明Snap-25蛋白合成增多,SNAP-25 蛋白参与了神经递质的组装、转运和停靠等过程, 对神经递质的释放起到重要作用, 它的合成增多提示有更多的神经递质被释放。以此缓解乙醇所导致的小鼠惊厥抽搐等症状。本研究中乙醇注射初期小鼠出现头和身体倾斜和抽搐,此后恢复正常或许与此有一定关系。VEGF和COX-2在正常成熟脑组织中鲜有表达, 在缺氧、缺血、外伤、肿瘤、脱髓鞘病变等病理状态下, 脑组织中VEGF蛋白表达显著升高[15-18]。乙醇所致的脑损伤诱导了VEGF和COX-2的表达。VEGF具有促血管新生及致血管高渗两项生物学特性[19]。COX-2是一种可诱导酶[20],上调的COX-2进一步介导前列腺素E2(PGE2)的生成,促进局部血管扩张,引起毛细血管通透性增加,诱发红、肿、热、痛及缺氧等功能障碍的作用[21, 22]。缺氧又可以使脑组织能量代谢发生障碍,抑制细胞膜上的钠/钾ATP酶活性,影响细胞膜内外离子转运,形成细胞内高渗状态, 大量水分内流入胞内, 引发细胞水肿[23]。
成功的脑外伤实验有赖于既能反映脑损伤的特点,又便于进行观察和施加处理因素的脑外伤动物模型的建立。理想的脑外伤动物模型制作方法应具有: 再现性好、重复性强、可定量分级、适应性广和操作简单等特点。一个理想的动物模型应有一定的发病率和一定的死亡率[24]。研究表明颅内注射20 μL和25 μL无水乙醇导致死亡率较高, 15 μL注射剂量的死亡率是30%,是最好的剂量选择。该脑损伤模型制作方法具有以下优点: (1)损伤机制明确, 便于定性研究; (2)模型制作耗时少,方法简单,条件易于控制; (3)致损伤程度较为一致,定量准确,重复性好; (4)模型脑损伤定位准确,建模后便于后续实验定位,如干细胞损伤部位注射等;(5)所制备的动物模型的脑损伤以血管源性脑水肿为主, 同时伴有局部脑组织的坏死性损伤,性质与临床上创伤性脑水肿相似; (6)实验对象为小鼠, 价廉,便于大批量研究。本研究建立的颅内注射乙醇致脑损伤小鼠模型将为脑损伤的相关研究提供基础。
[1] Feeney DM, Boyeson MG, Linn RT, et al. Responses to cortical injury: I. Methodology and local effects of contusions in the rat[J]. Brain Res, 1981, 211(1):66-67.
[2] 袁绍纪, 朱诚, 陈柏林, 等. 大鼠急性创伤性脑水肿模型的建立[J]. 上海医学, 1989, 2(5):276-279.
[3] Chan PH, Fishman RA. Phospholipid degenadation and the early release of polyunsaturated Fatty acids in the evoluation of brain edema. In: Recent progress in the study and therapy of brain edema[M]. Go DG, Baethmann A, eds, New York: Plenem Press, 1984:193-202.
[4] McIntosh TK. Traumatic brain injury in the rat: Characterization of a lateral fluid-percussion model[J]. Neuroscience, 1989, 28(1):233-241.
[5] Shapira Y, Lam AM, Eng CC, et al. Therapeutic time window and dose response of the beneficial effects of ketamine in experimental head injury[J]. Stroke, 1994, 25(2):1637-1643.
[6] 李翠莲, 石秋艳. 慢性酒精中毒脑损害[J]. 实用心脑肺血管病杂志, 2010, 18(2):197-198.
[7] Fakoya FA, Caxton-Martins EA. Neocortical neurodegeneration in young adult Wistar rats prenatally exposed to ethanol[J]. Neurotoxicol Teratol, 2006, 28(2):229-237.
[8] 曾涛, 张翠丽, 宋福永, 等. 一次性大剂量乙醇摄入对小鼠肝脏损伤作用的研究[J]. 环境与健康杂志, 2009, 26(7): 579-582.
[9] 贺继刚, 沈振亚, 滕小梅, 等. 经颅注射无水乙醇建立大鼠脑损伤模型初步探讨[J]. 实验动物与比较医学, 2013, 33(2):117-120.
[10] 陈世文, 周晓平, 田恒力. 大鼠冷冻性脑损伤模型的建立[J]. 创伤外科杂志, 2007, 9(3):237-240.
[11] 白红民, 费舟, 章翔, 等. 大鼠二次脑损伤模型的建立[J]. 中华创伤杂志, 2002, 18(4):214-217.
[12] 马辰莺, 徐晓婷, 涂彧, 等. VEGF mRNA及蛋白在大鼠放射性脑损伤模型中的动态变化[J]. 中华放射医学与防护杂志, 2014, 34(6):405-410.
[13] 熊耀祖, 孙阳, 涂彧, 等. 大鼠放射性脑损伤模型中Cox-2 mRNA及蛋白的动态变化研究[J]. 中华放射医学与防护杂志, 2016, 36(1):24-27.
[14] 黄培军, 徐培渝. Snap-25 mRNA 在毒鼠强中毒大鼠脑组织的表达[J]. 四川大学学报: 医学版, 2004, 35(5):644-646.
[15] Karamysheva AF. Mechanisms of angiogenesis[J]. Biochemistry (Mosc), 2008, 73(7):751-762.
[16] Khan Z, Khan N, Tiwari RP, et al. Biology of Cox-2: all application in cancer therapeutics[J]. Curt Drug Target, 2011, 12(7):1082-1093.
[17] Sellers RS, Radi ZA, Khan NK. Pathophysiology of cyclooxygenases in cardiovascular homeostasis[J]. Vet Pathol, 2012, 47(6):601-613.
[18] Murono S, Inoue H, Tanabe T, et al. Induction of cyclooxygenase-2 by epstein-barr virus latent membrane protine 1 is involved in vascular endothelial growth factor production in nasopharyngeal carcinoma cells[J]. Proc Natl Acad Sci USA, 2001, 98(12):6905-6910.
[19] Greene-Schloesser D, Robbins ME, Peiffer AM, et al. Radiation-induced brain injury: a review[J]. Front Oncol, 2012, 2 (73):1-18.
[20] Kalinski P. Regulation of immune responses by prostaglandin E2[J]. J Immunol, 2012, 188(1):21-28.
[21] Ji K, Tsirka SE. Inflammation modulates expression of laminin in the central nervous system following if chemic injury[J]. Neuroinflamm, 2012, 9(159):1-12.
[22] Lucas J, Mack WJ. Effects of ionizing radiation on cerebral vasculature: a review[J]. World Neurosurg, 2014, 81(3-4): 490-491.
[23] Toomey DP, Murphy JF, Conlon KC, et al. Cox-2, VEGF and tumour angiogenesis[J]. Surgeon, 2009, 7(3):174-180.
[24] 温妙云, 郑侠, 邓医宇, 等. 内毒素诱导大鼠建立脓毒症脑损伤模型[J]. 广东医学, 2014, 35(3):198-200.
Establishment of Brain Injury Model in Mouse by Intracranial Injection of Anhydrous Ethanol
HU Fan, DAI You-Jin, HOU Dao-Rong
(Nanjing Medical University, Nanjing 210000, China)
ObjectiveTo establish a stable mouse model of brain injury by ethanol intracranial injection.MethodsSixty ICR mice were randomly divided into 6 groups: sham group (n=10), 5 μL group (n=10), 10 μL group (n=10), 15 μL group (n=10), 20 μL group (n=10) and 25 μL group (n=10). The mice were intranscranially injected with different doses of ethanol. After 7 days, pathological examination was performed and the level of malondialdehyde (MDA), superoxide dismutase (SOD) and relevant genes expression were detected.ResultsAfter model made, the ethanol injection mice showed walk and balance function obstacle at early time, and returned to normal later, but feed intake and body weight significantly decreased. With HE staining, the nerve cell necrosis and surrounding tissue edema, neurons and glial cells intercellular space expansion, microvascular clearance outside enlarge and vascular diapedesis, the nerve cells and glial cells cavity lesions were detected. The activity of SOD were decreased and content of MDA were increased. The cyclooxygenase-2 (COX-2) and vascular endothelial growth factor (VEGF) and synaptosomal-associated protein-25 (SNAP-25) mRNA expression was significantly increased in experimental group compared with control group, detected by Q-PCR.ConclusionThe mouse model of brain injury made by intracranial injection with ethanol have the advantages of simple, phenotypic uniformity, good repeatability, high success rate compared to traditional brain injury model making.
Brain injury; Model; Mouse; Ethanol
Q95-33
A
1674-5817(2016)06-0428-05
10.3969/j.issn.1674-5817.2016.06.005
