鸡GNAS基因启动子突变及其与肤色性状的相关性
2017-01-12王欢欢陈美玲楼立峰张成先陈贤惠章学东
王欢欢,陈美玲,楼立峰,张 雷,张成先,陈贤惠,章学东*
(1. 杭州市农业科学研究院,杭州 310024; 2. 浙江光大种禽业有限公司,海宁 310016)
鸡GNAS基因启动子突变及其与肤色性状的相关性
王欢欢1,陈美玲1,楼立峰1,张 雷1,张成先2,陈贤惠2,章学东1*
(1. 杭州市农业科学研究院,杭州 310024; 2. 浙江光大种禽业有限公司,海宁 310016)
为研究鸡GNAS基因突变情况及其对乌骨鸡肤色的影响,本试验选择东乡绿壳蛋鸡样本,采用PCR-RFLP和DNA测序方法,筛查肤色相关的GNAS突变位点;采用荧光定量PCR方法,检测EDN3、MC1R、GNAS、ADCY3基因的表达量;本试验还对3个鸡种进行了突变检测。结果显示,在家鸡20号染色体的11 167 660碱基位置存在T/C突变,该T2270C突变点是GNAS基因启动子的关键位点。PCR产物经DraI酶切电泳后,CC纯合基因型出现一条342 bp的条带;TC杂合基因型出现171和342 bp两条带;TT隐性纯合基因型出现一条171 bp的条带。3种基因型的肤色L值差异极显著(P<0.01),CC基因型的L值最小,表现为肤色最深;TT基因型的L值最大,表现为肤色浅白。EDN3基因的表达量以CC基因型最高,TT基因型最低,3种基因型间差异极显著(P<0.01)。MC1R、GNAS和ADCY3基因的表达量以CC基因型最高,但基因型间的表达差异均不显著(P>0.05);GNAS与上游MC1R基因的表达量无显著相关性,而与下游ADCY3基因的表达量极显著相关(P<0.01)。江山乌骨鸡、伊莎蛋鸡、东乡×伊莎测交组合鸡的突变分型结果符合理论值(P>0.05)。本研究表明,鸡GNAS基因启动子T2270C突变与肤色性状强相关,突变检测可辅助用于乌骨鸡的肤色分型育种。
鸡;GNAS基因;突变;肤色
鸟嘌呤核苷酸结合蛋白α亚基(Guanine nucleotide-binding protein Gs subunit alpha,GNAS)是位于细胞膜内侧的一类信号传导蛋白,参与细胞的多种生命活动[1]。在黑色素代谢通路中,GNAS与具有跨膜结构的黑素皮质素受体(MC1R)偶联,激活腺苷酸环化酶(ADCY),催化ATP生成第二信使cAMP,进而影响胞内黑色素的合成[2]。据家鸡全基因组测序数据,鸡GNAS基因位于20号染色体,全长为48 456 bp,含有10个外显子。研究表明,乌骨鸡真皮、内脏等部位的黑色素沉积现象,又称纤维化黑色变(Fibromelanosis,Fm),是由20号染色体上的Fm区域所决定的,乌骨鸡在该区域存在着两段拷贝数重复区(CNVs),其中一段CNVs包含有与黑色素沉积密切相关的EDN3基因[3-4],而GNAS等数个基因则处在两段CNVs的中间序列。同时,医学研究发现,人的GNAS基因突变导致黑色素瘤(Melanoma)、纤维骨性病变(Fibro-osseous)、纤维性发育不良(Fibrous dysplasia)等疾病的发生[5-7]。以上结果均提示,GNAS可能与黑色素性状有关。
国内多数乌骨鸡种的群体内肤色往往深浅不一,例如东乡绿壳蛋鸡的冠、喙、皮、肉、骨、胫、趾多呈乌黑色,但还有一定比例的白肤个体[8]。这种情况表明鸡种内存在乌肤主效基因的纯合与杂合,会对后续的育种应用造成影响。本研究目的在于筛选鸡的GNAS基因突变,探究GNAS突变是否与鸡的乌肤性状相关,以期为寻找有效的分子标记辅助育种方法提供依据。
1 材料与方法
1.1 突变检测样本
试验选用浙江光大种禽业有限公司保存的东乡绿壳蛋鸡150只、江山乌骨鸡60只、伊莎蛋鸡B系60只,以及东乡绿壳蛋鸡的测交后代67只。由专人饲养管理,按程序免疫。采集所有供试个体的翅静脉血液,加入70%乙醇中,酚/氯仿法抽提基因组DNA,于-20℃保存。
1.2 PCR-RFLP分析
根据鸡GNAS基因全序列(GenBank Accession No.:NC_006107.4),采用Primer 6.0软件设计启动子区引物(表1),交由生工生物工程(上海)股份有限公司合成。
表1 突变检测引物信息
Table 1 The information of primer for gene mutation detection

引物名称Primer引物序列(5′⁃3′)Primersequence碱基位置/bpBaseposition产物长度/bpProductlengthGNAS_promo3F:ACGACAGCAGGAAACGT11167489~11167505R:TGTGGCAGGCAGGTAACTGTGT11167809~11167830342
F. 上游引物;R.下游引物。表2同
F. Forward primer; R. Reverse primer. The same as Table 2
PCR反应体系:DNA 20 ng,2× Taq PCR Master Mix 12.5 μL,上下游引物各10 μmol·L-1,加水补至 25 μL。上ABI 9700型PCR仪(ABI,美国)进行扩增,反应程序:94 ℃ 5 min;然后进入PCR循环,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,35个循环;最后72 ℃延伸10 min。
将PCR产物用限制性内切酶DraI进行酶切,反应体系:PCR产物5 μL,10×buffer 2 μL,酶1 μL,加水补至20 μL。37 ℃酶切1 h。用1.5%琼脂糖凝胶电泳检测酶切产物,并送杭州擎科梓熙生物技术有限公司进行DNA测序。
1.3 肤色和表达量检测样本
于126日龄时,采用美能达CR400型色差计(Konica Minolta,日本)测定150只东乡绿壳蛋鸡的胸侧肤色L、a、b值。L为明度值(0~100),0表示黑色,100表示白色;a为红绿光值,正值表示偏红,负值表示偏绿;b为黄蓝光值,正值标示偏黄,负值表示偏蓝。
同一日龄,分别选取各基因型的东乡绿壳蛋鸡各6只,屠宰取胸侧皮肤样,液氮保存。采用TRIzol Plus RNA纯化试剂盒(Invitrogen,美国)提取总RNA,SuperScript Ⅲ反转录试剂盒(Invitrogen,美国)合成单链cDNA,于-20 ℃保存。
1.4 定量PCR
根据NCBI数据库中相关基因的mRNA序列,采用Primer 6.0软件分别设计EDN3、MC1R、GNAS、ADCY3 4个目的基因和18S内参基因的mRNA引物(表2),并交由生工生物工程(上海)股份有限公司合成。
表2 表达量检测引物信息
Table 2 The information of primer for gene expression detection

基因名称GeneGenBank序列号GenBankNo.引物序列(5′⁃3′)Primersequence产物长度/bpProductlength18SAF173612.1F:CCGGACACGGACAGGATTGACAR:CAGACAAATCGCTCCACCAACTAAG94EDN3XM_015296553.1F:CATCTGGATCAACACCCCAGR:ACTTTGATTCTGGCCCGTAG97MC1RNM_001031462.1F:CCTGCTCTGCCTCATTGGCTTCTR:GGTAGATGGTGGGCTGCTTCTG131GNASXM_015296547.1F:GCACCTCCAGTTGAACTAGCCAATR:CTCCGGTGGGAAATCGAAGTCT96ADCY3XM_015285193.1F:CTGACTTTGACGCACTCCTGGATGR:CCATGTAGGTGCTGCCGATGGT78
定量PCR反应体系:cDNA 1 μL,Power SYBR Green Master Mix 10 μL,上、下游引物各0.5 μL,加水补至20 μL。上CFX384多重实时荧光定量PCR仪(Bio-Rad,美国)进行扩增,反应程序:95℃ 1 min;然后进入PCR循环,95℃ 15 s,63℃ 25 s,40个循环。55~95℃绘制熔解曲线,每0.2℃读板一次。每个样本做3个重复,记录Ct值,2-△△Ct法计算目的基因的相对表达量。
1.5 统计分析
人(Homosapiens)、猪(Susscrofa)、小鼠(Musmusculus)、爪蛙(Xenopustropicalis)、鸡(Gallusgallus)、鹌鹑(Coturnixjaponica)、斑马鱼(Daniorerio)的GNAS基因序列来自NCBI数据库,分别以转录起始位点为基准,取其上游5 000 bp至下游1 000 bp共6 kb序列进行生物信息学分析。采用MEGA 5.1软件构建进化树[9];比对鸡-鹌鹑-人、鸡-鹌鹑-猪、鸡-鹌鹑-小鼠、鸡-鹌鹑-爪蛙、鸡-鹌鹑-斑马鱼共5组序列,计算各组每500 bp的保守碱基率(保守碱基数/碱基总数)。
以鸡GNAS基因的转录起始位点为基准,取其上游1~3 000 bp序列进行生物信息学分析。采用Neural Network Promoter Prediction(http://www.fruitfly.org/seq_tools/promoter.html)和FFROM(http://linux1.softberry.com/berry.phtml?topic=fprom&group=programs&subgroup=promoter)在线软件预测启动子。
肤色和表达量数据采用SPSS 21.0软件进行方差齐性检验,对齐性数据用单因素方差分析(Duncan法),对不齐性数据用独立样本非参数检验(Kruskal-Wallis法)。表达量数据之间的相关性采用SPSS 21.0软件中的双变量相关分析(Pearson相关系数)。突变检测值与理论值的符合度采用SPSS 21.0软件中的卡方检验(Fisher’s法)。上述分析均以P<0.05为差异显著,以P<0.01为差异极显著。
2 结 果
2.1 突变筛查和位点情况
7个物种的进化树见图1A,鸡和鹌鹑具有较高同源性,因此设定都包含有鸡和鹌鹑的5组比对序列,其保守碱基率曲线见图1B。在0~-3 000 bp范围内,5组保守碱基率稍低于两侧区域;同时,从鸡GNAS基因的SNP统计(图1C)来看,0~-3 000 bp的SNP个数稍高于两侧,这些均表明GNAS基因的转录起始位点上游3 000 bp以内更具筛查意义,因此选择-3 000~-1区域进行启动子突变探查。

A. 7个动物物种根据GNAS基因生成的进化树,采用最大似然法的Tamura-Nei模型,以斑马鱼为遍历根。B. 5组比对序列的每500 bp的保守碱基率曲线,X轴0表示GNAS基因的转录起始位点。C. 鸡GNAS基因的每500 bp的SNP个数统计值曲线,X轴0表示转录起始位点A. Show the phylogenetic tree of 7 species by GNAS genetic distance, based on the Tamura-Nei model of maximum likelihood method, in zebrafish traversal root. B. Show the GNAS conserved rates for each 500 bp of 5 groups, X-axis “0” represents the transcription start site. C. Show the GNAS SNP statistical curve for each 500 bp, X-axis “0” represents the transcription start site图1 GNAS基因进化树、保守碱基率和SNP统计Fig.1 The phylogenetic tree, conserved rates and SNP statistics of GNAS
经探查和筛选,得到位于-2 270 bp处的突变位点(染色体上碱基位置11 167 660,rs号314048279)。该SNP为T/C突变(简称T2270C),DraI酶切电泳后有3种条带结果:CC纯合基因型出现一条342 bp条带;TC杂合基因型出现171和342 bp两条带;TT隐性纯合基因型出现一条171 bp条带,酶切图和测序图分别见图2A和图2B。
两种软件的启动子预测结果见表3,当T2270C碱基(即查找序列的714处)为T时,在该点附近均预测到启动子;而T2270C突变为C时,该点附近的启动子消失,表明T2270C是启动子的关键位点。
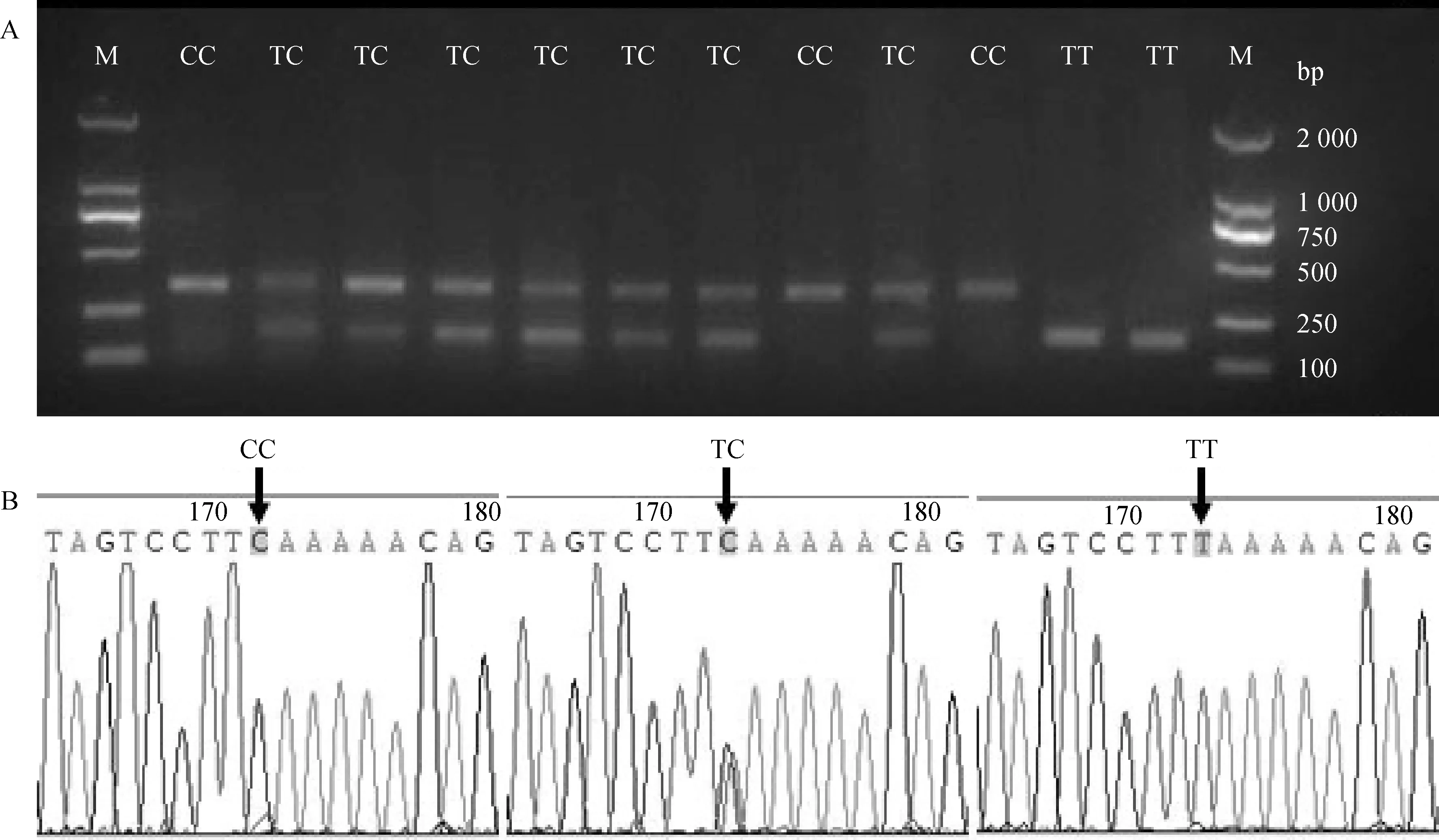
A. Dra I酶切电泳结果,CC、TC、TT分别代表3种基因型,M为DNA相对分子质量标准。B. 3种基因型的测序结果,箭头所指碱基为突变位点A. The electrophoresis result after Dra I enzyme digestion, CC, TC, TT represent the 3 genotypes respectively, M mean DNA marker. B. The sequencing result of the 3 genotypes, and the bases pointed by arrows are the mutation sites图2 突变位点酶切和测序图Fig.2 The digestion and sequencing maps of the mutation site
表3GNAS基因启动子预测结果
Table 3 The prediction results ofGNASgene promoter

软件名称SoftwareT2270C为T时的预测结果PredictionresultwhenT2270CwasTT2270C为C时的预测结果PredictionresultwhenT2270CwasCNeuralNetworkStartEndScorePromoterSequence7037530.94AGGTAGTCCTTAAAAACAGTGGTGCCTGGCTTC⁃ACCCTGGGCATATCAG160416540.90CATGTGATAATCAAAATTCCCCCCACTCTTGGACT⁃GCTGCATCTGCCCTGStartEndScorePromoterSequence160416540.90CATGTGATAATCAAAATTCCCCCCACTCTTGGAC⁃TGCTGCATCTGCCCTGFFROM1promoter/enhancer(s)arepredictedPromoterPos:746LDF:-0.722TATAboxat712+7.427TTAAAAA0promoter/enhancer(s)arepredicted
带方框浅灰底色字符为突变位点
The character with border and light-gray shading are the mutation sites
2.2 突变与肤色的相关性
3种突变基因型的肤色L、a、b值见图3(n=150)。组间L值差异极显著(P<0.01),CC基因型的L值最小,表现为肤色最深;TT基因型的L值最大,表现为肤色浅白。a为正值,b为负值,但3组间均无显著差异(P>0.05)。
2.3 不同突变基因型的相关基因表达量
3种突变基因型的EDN3、MC1R、GNAS和ADCY3基因表达量见图4(n=3×6)。EDN3基因表达量的组间差异极显著(P<0.01),以CC基因型的为最高,TT基因型的为最低。MC1R、GNAS和ADCY3基因表达量的组间差异均不显著(P>0.05),但以CC基因型的表达量最高。GNAS基因与上游MC1R基因的表达量之间的相关性不显著,而与下游ADCY3基因表达量之间的相关性极显著(P<0.01)。
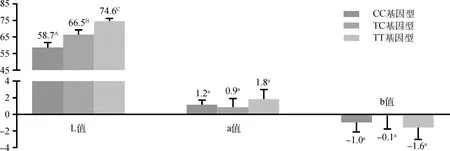
柱形图上方数据为各基因型的肤色平均值,肩标小写字母不同表示差异显著(P<0.05);大写字母不同表示差异极显著(P<0.01)。柱形图的灰度根据各基因型的肤色L值模拟生成The data upon each column is the average value of skin color of each genotype, and the different superscript lowercase letters represent significant difference (P<0.05), meanwhile the different superscript uppercase letters represent extremely significant difference (P<0.01). The gray level is simulated according to the skin color L value of each genotype图3 突变基因型的肤色值Fig.3 The skin color values of the mutation genotypes
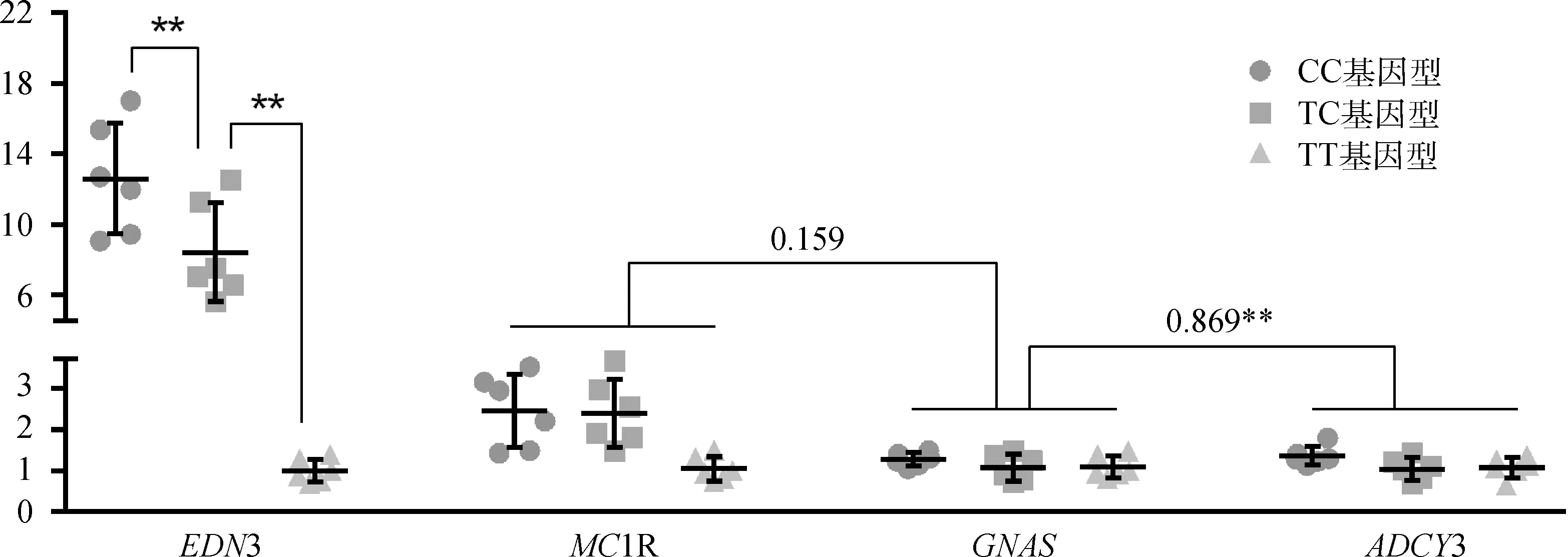
图中的散点表示各基因型的基因表达量,横竖线分别表示平均值和标准差。EDN3基因上方的“**”表示基因型间的差异极显著(P<0.01)。MC1R和GNAS、GNAS和ADCY3基因之间的数值为表达量的相关性值,“**”表示相关性极显著(P<0.01)The scatters in each column represent the gene expression level of each genotype, and the horizontal and vertical line represent the mean and standard deviation, respectively. The “**” upon EDN3 gene represent extremely significant difference among 3 genotypes (P<0.01). The value between MC1R and GNAS, GNAS and ADCY3 are the correlation values of gene expression, and the “**”represent extremely significant difference (P<0.01)图4 突变基因型的相关基因表达量Fig.4 The expression levels of the related genes of the mutation genotypes
2.4 不同鸡种的突变检测情况
3个鸡种的GNAS突变检测结果见表4。江山乌骨鸡肤色全黑,经检测基本为CC基因型。伊莎蛋鸡B系的肤色白,检测全为TT基因型。将东乡绿壳蛋鸡公鸡与伊莎蛋鸡B系母鸡进行肤色测交,检测无白肤后代的家系群体(有3个家系,3♂×18♀的后代共67只,均无白肤)基本为TC基因型。卡方检验表明,以上检测结果与理论值相符(P>0.05)。
表4 鸡种的GNAS突变检测结果
Table 4 The detection results ofGNASgene mutation in chicken breeds
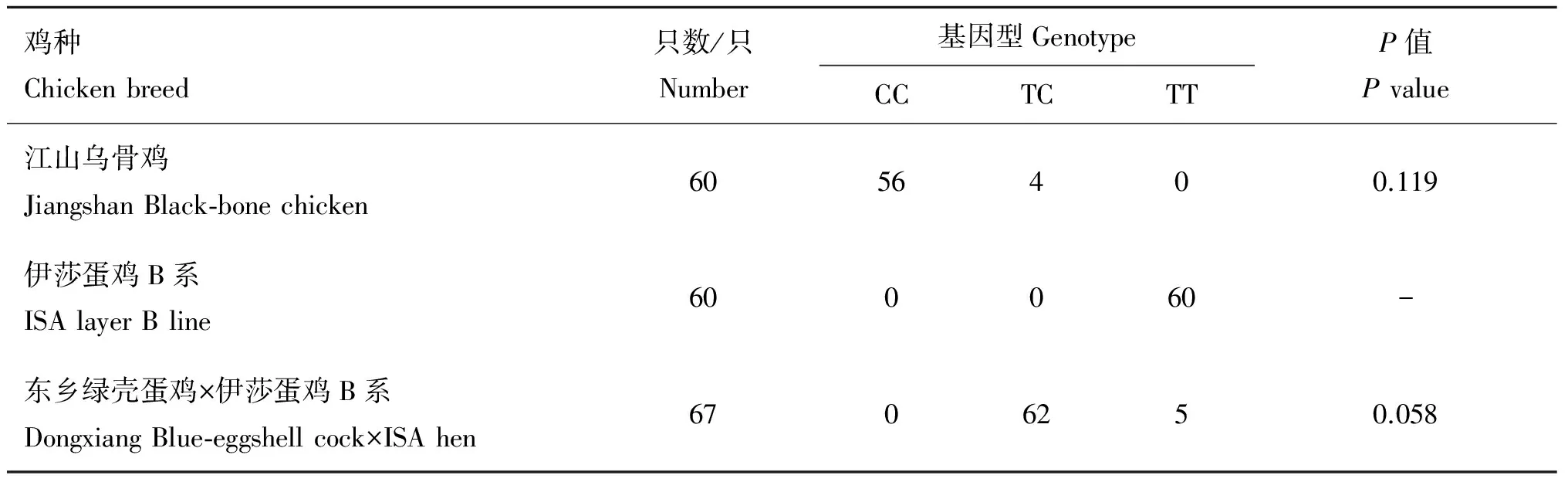
鸡种Chickenbreed只数/只Number基因型GenotypeCCTCTTP值Pvalue江山乌骨鸡JiangshanBlack⁃bonechicken6056400.119伊莎蛋鸡B系ISAlayerBline600060-东乡绿壳蛋鸡×伊莎蛋鸡B系DongxiangBlue⁃eggshellcock×ISAhen6706250.058
3 讨 论
据报道,和GNAS同属鸟嘌呤核苷酸结合蛋白(GNA)基因家族的GNAQ、GNA11基因的突变型与恶性黑色素瘤病人存在相关性[10-11],而人GNAS基因第5外显子T393C多态与黑色素瘤、膀胱癌、肺癌等恶性肿瘤生存期显著相关[5,12-13];第8外显子R201H、R201C突变在纤维性发育不良病中的发生率达86%[7]。本研究筛查到了鸡GNAS基因的启动子区突变,其不同基因型间的肤色明度值差异显著,但在针对鸡相应于人GNAS的外显子区的突变筛查中没有发现类似位点。虽然人的黑色素瘤、纤维性发育不良和鸡的纤维化黑色变(Fm)都牵涉机体的黑色素、纤维组织等成分,但与这些表象相关联的GNAS突变并不一样,这应是因为物种以及具体性状不同所致。本研究同时检测了与黑色素沉积密切相关的EDN3基因表达量,发现在GNAS基因T2270C突变的CC纯合基因型中,其EDN3表达量要高于TT隐性基因型10倍以上,这一结果与B. Dorshorst等关于丝羽乌骨鸡(乌肤纯合)、新汉普夏鸡(白肤对照)的检测结论一致[3],也反映出该GNAS突变确实与黑色素以及乌肤性状有关。
就GNAS的上下游通路基因而言,MC1R已被证实是控制鸡黑色素性状的重要基因[14],但主要关联羽色,本研究检测到MC1R在皮肤中的表达量低,且与GNAS表达量相关性不强;ADCY3作为GNAS下游的结合效应物,直接受其调节,检测发现二者的基因表达量呈现出强相关性。据此推测,GNAS启动子突变可能是通过影响本底以及下游基因的表达,最终反映到肤色差异,但更明晰的分子调控机制还需要深入研究发掘。启动子突变一般通过转录因子结合而调控靶基因表达,比如TERT基因启动子的C228T、C250T突变与人黑色素瘤强相关,机制是突变产生ETS转录因子的共有结合位点,从而增强了基因的转录活性[15-16];在对鸡的Piwil1基因NF-Y转录因子、L-FABP基因C/EBPα转录因子实行定点突变后,启动子活性呈显著下降或升高[17-18]。因此,后续可重点分析该GNAS突变附近的转录因子,研究突变引起的启动子活性变化情况。
当前,家禽育种领域内已有一些基因突变的研究应用,例如K. L. Wells等通过全基因组SNP扫描发现无毛鸡品系的FGF20基因存在R179X突变,并开发出dCAPS标记方法进行检测[19];Q. Chu等通过FMO3基因T329S突变的TaqMan探针法检测,在北京油鸡群体中逐步剔除含鱼腥味缺陷的个体[20]。本研究的GNAS基因突变在东乡绿壳蛋鸡中得到性状关联验证,即CC纯合型的乌肤深色度要显著高于TC杂合型。因此在早期选择时,可结合GNAS分子标记,对东乡绿壳蛋鸡进行肤色分型,提高选种效率。进一步地,可扩展研究并应用在其他乌骨鸡种中,实现肤色性状的定向培育。
[1] WEINSTEIN L S, LIU J, SAKAMOTO A, et al. Minireview: GNAS: normal and abnormal functions [J].Endocrinology, 2004, 145(12): 5459-5464.
[3] DORSHORST B, MOLIN A M, RUBIN C J, et al. A complex genomic rearrangement involving the endothelin 3 locus causes dermal hyperpigmentation in the chicken[J].PLoSGenet,2011,7(12):e1002412.
[4] SHINOMIYA A, KAYASHIMA Y, KINOSHITA K, et al. Gene duplication of endothelin 3 is closely correlated with the hyperpigmentation of the internal organs (Fibromelanosis) in Silky chickens [J].Genetics, 2012, 190(2): 627-638.
[5] FREY U H, FRITZ A, ROTTERDAM S, et al. GNAS1 T393C polymorphism and disease progression in patients with malignant melanoma [J].EurJMedRes, 2010, 15(10): 422-427.
[6] TABAREAU-DELALANDE F, COLLIN C, GOMEZ-BROUCHET A, et al. Diagnostic value of investigatingGNASmutations in fibro-osseous lesions: a retrospective of 91 cases of fibrous dysplasia and 40 other fibro-osseous lesions [J].ModPathol, 2013, 26(7): 911-921.
[7] SHI R R, LI X F, ZHANG R, et al. GNAS mutational analysis in differentiating fibrous dysplasia and ossifying fibroma of the jaw [J].ModPathol, 2013, 26(8): 1023-1031.
[8] 国家畜禽遗传资源委员会.中国畜禽遗传资源志·家禽志 [M]. 北京:中国农业出版社, 2011.
CHINA NATIONAL COMMISION OF ANIMAL RESOURCES. Animal genetic resources in China·chicken [M].Beijing: China Agriculture Press, 2011. (in Chinese)
[9] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J].MolBiolEvol, 2011, 28(10): 2731-2739.
[10] VAN RAAMSDONK C D, BEZROOKOVE V, GREEN G, et al. Frequent somatic mutations of GNAQ in uveal melanoma and blue naevi [J].Nature, 2009, 457(7229): 599-602.
[11] VAN RAAMSDONK C D, GRIEWANK K G, CROSBY M B, et al. Mutations in GNA11 in uveal melanoma [J].NEnglJMed, 2010, 363(23): 2191-2199.
[12] FREY U H, EISENHARDT A, LÜMMEN G, et al. The T393C polymorphism of the Gαs gene (GNAS1) is a novel prognostic marker in bladder cancer [J].CancerEpidemiolBiomarkersPrev, 2005, 14(4): 871-877.
[13] 龚虹云.GNAS1 T393C单核苷酸多态性与肺癌生存及放化疗副反应相关性研究 [D]. 武汉: 武汉大学, 2012.
GONG H Y. Association of the GNAS1 T393C polymorphism with survival in advanced lung cancer and side effects in chemotherapy and radiotherapy [D]. Wuhan: Wuhan University, 2012. (in Chinese)
[14] 杨永升, 邓学梅, 李 宁, 等.MC1R是控制鸡黑色素形成的候选主效基因 [J]. 生物化学与生物物理进展, 2004, 31(6): 500-505.
YANG Y S, DENG X M, LI N, et al. MC1R is the candidate gene regulating melanin synthesis in chicken[J].ProgressinBiochemistryandBiophysics, 2004, 31(6): 500-505.(in Chinese)
[15] HUANG F W, HODIS E, XU M J, et al. Highly recurrent TERT promoter mutations in human melanoma [J].Science,2013, 339(6122): 957-959.
[16] HORN S, FIGL A, RACHAKONDA P S, et al. TERT promoter mutations in familial and sporadic melanoma [J].Science, 2013, 339(6122): 959-961.
[17] 夏明秀, 常国斌, 陈 蓉, 等. 鸡Piwil1基因启动子区转录调控元件的初步分析 [J]. 畜牧兽医学报, 2013, 44(9): 1349-1354.
XIA M X, CHANG G B, CHEN R, et al. Preliminary analysis of transcription regulation elements in the promoter region ofPiwil1 gene in chicken[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(9): 1349-1354. (in Chinese)
[18] 贺 綦, 孙婴宁, 李 辉, 等. 鸡L-FABP启动子区C/EBPα结合位点的定点突变分析 [J]. 畜牧兽医学报, 2015, 46(9): 1496-1501.
HE Q, SUN Y N, LI H, et al. Site directed mutagenesis for C/EBPα binding sites in chickenL-FABPpromoter[J].ActaVeterinariaetZootechnicaSinica, 2015, 46(9): 1496-1501. (in Chinese)
[19] WELLS K L, HADAD Y, BEN-AVRAHAM D, et al. Genome-wide SNP scan of pooled DNA reveals nonsense mutation in FGF20 in the scaleless line of featherless chickens [J].BMCGenomics, 2012, 13:257.
[20] CHU Q, ZHANG J, ZHU S, et al. The detection and elimination of flavin-containing monooxygenase 3 gene T329S mutation in the Beijing You chicken [J].PoultSci, 2013, 92(12): 3109-3112.
(编辑 郭云雁)
GNAS Gene Promoter Mutation in Chicken and the Correlation with Skin Color Traits
WANG Huan-huan1,CHEN Mei-ling1,LOU Li-feng1,ZHANG Lei1,ZHANG Cheng-xian2,CHEN Xian-hui2,ZHANG Xue-dong1*
(1. Hangzhou Academy of Agricultural Sciences,Hangzhou 310024,China;2.ZhejiangGuangdaPoultryBreedingCompany,Haining310016,China)
The study aimed to investigate the mutation ofGNASgene and its effect on skin color traits in chicken. Dongxiang Blue-eggshell chicken (Gallusgallusdomestica) was chose and theGNASmutation sites related to skin color were screened using PCR-restriction length polymorphism (RFLP) and DNA sequencing in this study. We detected expression of theEDN3,MC1R,GNASandADCY3 genes using fluorescence quantitative PCR, and the mutation sites among 3 chicken breeds. The results showed that there was a T/C mutation at base 11 167 660 on chicken chromosome 20 and the mutation (T2270C) was crucial for theGNASgene promoter. AfterDraI enzyme digestion for PCR products, the CC homozygous genotype, the TC heterozygous genotype and the TT recessive homozygous genotype presented one band at 342 bp, two bands at 171 and 342 bp, and one band at 171 bp, respectively. The L values of skin color were statistically significantly different among 3 genotypes (P<0.01). The individuals with CC genotype had the lowest L value, which presented the darkest skin, and the individuals with TT genotype had the highest L value, which presented the lightest skin. Expression of theEDN3 gene was highest and lowest in individuals with the CC and TT genotype, respectively, and the difference among 3 genotypes was extremely significant (P<0.01). Expression of theMC1R,GNASandADCY3 genes was highest in individuals with CC genotype, but the difference among genotypes was not significant (P>0.05). The correlation ofGNASwithMC1Rwas non-significant in expression, and the correlation withADCY3 was extremely significant (P<0.01). The typing results according to mutation detection in Jiangshan Black-bone chicken, ISA layer, test-crossing offspring of Dongxiang Blue-eggshell cock and ISA hen, conformed to the theoretical values (P>0.05). The study indicate that the T2270C mutation inGNASgene promoter in chicken is correlated strongly with the skin color traits, and detection of the mutation can be used in the breeding of black-bone chicken.
chicken;GNASgene;mutation;skin color
10.11843/j.issn.0366-6964.2016.12.004
2016-05-16
国家肉鸡产业技术体系综合试验站(CARS-42-Z07);浙江省公益技术研究农业项目(2015C32106)
王欢欢(1986-),女,黑龙江佳木斯人,畜牧师,硕士,主要从事动物遗传育种工作,E-mail: wennuan2009@163.com
*通信作者:章学东,研究员,E-mail:bigzhengliang@hotmail.com
S831.2
A
0366-6964(2016)12-2354-08
