附子中6种生物碱质谱裂解机制及醇解产物研究*
2017-01-11翅潘德林朱雅宁郝
张 翅潘德林朱雅宁郝 莉
[1.华润三九(雅安)药业有限公司,四川 雅安 625000;2.成都中医药大学,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137]
·实验报告·
附子中6种生物碱质谱裂解机制及醇解产物研究*
张 翅1,2△潘德林1,2朱雅宁1,2郝 莉1
[1.华润三九(雅安)药业有限公司,四川 雅安 625000;2.成都中医药大学,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137]
目的探讨附子中6种生物碱裂解规律,研究双酯型生物碱乙醇解产物。方法 采用HPLC-ESI-MS技术,在正离子模式下,扫描分析双酯型生物碱在乙醇的转化产物,并阐述其规律。结果通过对已知6种生物碱的多级质谱分析及文献调研,总结了6种酯型生物碱的裂解规律,并确定了双酯型生物碱的乙醇产物。结论3种双酯型生物碱在乙醇中,发生乙醇解反应,分别生成8-乙氧基新乌头碱、8-乙氧基乌头碱和8-乙氧基次乌头碱;由于反应在加热条件下进行,还有焦乌头碱的产生。
附子 乌头碱 双酯型生物碱 裂解规律 醇解产物
附子为毛茛科植物乌头 (Aconitum carmichaeli Debx.)子根的加工品,是临床常用的中药材,具有回阳救逆、补火助阳、散寒止痛等功效[1],被誉为“回阳救逆第一品”。其主要化学成分乌头碱类生物碱,既是发挥药效的主要有效成分,又是乌头、附子中的主要有毒成分[2-3]。该类成分中的双酯型生物碱毒性最大,对热不稳定,容易发生水解和乙醇解反应。液质联用技术在中药成分研究中已经广泛应用[4-5],该技术与电喷雾电离技术联合(HPLC-ESI-MS)用于样品的快速分析及鉴定,具有灵敏度高、特异性强、快速、操作简单等优势。已经有文献利用该技术对附子中生物碱的水解反应开展研究,分析了乌头碱水解产物及其裂解产物、裂解规律[6-8]。本文对其醇解反应开展研究,通过HPLC-ESI-MS获得质谱数据并进行分析,推断出6种生物碱的质谱裂解行为,阐述了双酯型生物碱醇解转化规律,为含附子药品的质量分析及安全性评价提供依据,有利于附子相关药品的安全合理应用。
1 材料与方法
1.1 仪器 AE-240电子天平(METTLER),Agilent1260高效液相色谱仪,Thermo LCQ-FLEET质谱仪,UPT-1-40L优普超纯水器,AS20500超声仪(SCIENCE)。
1.2 试药 新乌头原碱(批号:110799-201307,中国食品药品检定研究院);乌头原碱 (批号:110720-200410,中国食品药品检定研究院);次乌头碱(批号:110798-201307,中国食品药品检定研究院);苯甲酰新乌头碱(批号:111795-201102,中国食品药品检定研究院);苯甲酰乌头碱(批号:111794-201303,中国食品药品检定研究院);苯甲酰次乌头碱 (批号:111796-201303,中国食品药品检定研究院);乙腈(色谱纯,Merck);水为超纯水;其他试剂均为分析纯。
1.3 色谱条件 Agilent ZORBAX Extend-C18色谱柱(4.6 mm×250mm,5 μm),流动相40 mmol/L乙酸铵缓冲液(用氨水调pH=9.9,A);乙腈(B),梯度洗脱0~10 min,72%A;10~15 min,72%~67%A;15~45 min,67%~50% A;45~60 min,50%A;流速1 mL/min,柱温25℃;检测波长235 nm。
1.4 质谱条件 电喷雾离子源,正离子模式检测;雾化器压强340 kPa;质量扫描范围:m/z 100~1500;干燥气体温度320℃,干燥气体(N2)流量5 L/min,碰撞气体为Ar。
1.5 供试品溶液的制备 分别精密称取对照品苯甲酰新乌头碱2.24 mg,苯甲酰次乌头碱2.51 mg,苯甲酰乌头原碱2.68 mg,新乌头碱1.31 mg,次乌头碱1.73 mg,乌头碱1.46 mg,用无水乙醇定容至100 mL(校正体积为99.4809 mL)容量瓶,得到对照品质量浓度分别为:苯甲酰新乌头碱22.5169 μg/mL,苯甲酰次乌头碱25.2310 μg/mL,苯甲酰乌头原碱26.9398 μg/mL,新乌头碱13.1684 μg/mL,次乌头碱17.3903 μg/mL,乌头碱14.6762 μg/mL的混合对照品。量取供试品溶液50 mL至圆底烧瓶中,加热回流60 min,冷却后,即得。检测方法按照1.3和1.4条件进行检测。
2 结 果
2.1 混标对照品乙醇解前后色谱图比较 见图1和图2。6种生物碱基本可以达到分离,并且在ESI正离子模式下均可产生[M+H]+。根据对照品的保留时间和分子量,确定图2中1、2、3、4、5和6号峰分别为苯甲酰新乌头碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、新乌头碱、乌头碱和次乌头碱。通过醇解前后液相色谱图比较可以发现,经过醇解后新增加了图2中的7、8、9、10和11共5个色谱峰。其混标溶液总离子流图见图3。

图1 混合对品乙醇解前HPLC色谱图
2.2 已知生物碱裂解规律分析 6种酯型生物碱结构图见图4,在ESI正离子模式下,乌头类生物碱最常见的丢失碎片离子是CH3COOH、CH3OH、H2O等,通过研究各个对照品的多级质谱可以发现有如下特征离子:[M+H-32]+,[M+H-50]+,[M+H-60]+,[M+H-60-32-28]+,推断规律如下:

图2 混合对品乙醇解后HPLC色谱图

图3 混标溶液总离子流图

图4 6种酯型生物碱结构图
离子[M+H-32]+:在乌头类生物碱中,碎片32主要来源于甲氧基结构,这6种已知的生物碱结构存在4个甲氧基,根据文献采用量子化学计算结构认为丢失的顺序为C-16位、C-11位、然后是C-6位[9]。
离子[M+H-60]+:通过对比双酯型生物碱和单酯型生物碱中MS2,发现双酯型生物碱乌头碱、新乌头碱、次乌头碱存在[M+H-60]+,而单酯型生物碱并没有发现此碎片离子峰,推测离子[M+H-60]+来源于双酯型生物碱8位上的侧链CH3COO和15位上的H组成,即为脱去一分子CH3COOH产物[10],见图6。

图5 6种生物碱的质谱图
离子[M+H-60-32-28]+:对比双酯型生物碱和单酯型生物碱的碎片离子峰可以发现,双酯型生物碱的质谱图中均有碎片离子[M+H-60-32-28]+出现,碎片28一般是由CH2=CH2或者CO裂解产生,而只有乌头碱上有乙基取代,所以碎片28只可能来源于CO[11],见图6。

图6 双酯型生物碱裂解碎片离子结构
离子[M+H-50]+:从对照品二级质谱数据发现离子[M+H-50]+存在于苯甲酰新乌头碱和苯甲酰乌头原碱中,而苯甲酰次乌头碱不存在此离子峰,见图5。根据结构可以初步判断,碎片50的产生主要是脱去一分子水和一分子甲醇产生的。对比三种单酯型生物碱的结构,C-15和C-8上均有羟基,而C-3位上只有苯甲酰次乌头碱没有羟基,可以初步判断离子[M+H-50]+中一分子水主要来自C-3位脱去一分子水[12],见图7和图8。
图7苯甲酰新乌头碱和苯甲酰乌头碱裂解碎片离子结构
在这6种已知的生物碱质谱中,没有出现丢失苯甲酸的离子,即[M+H-122]+;因为如果丢失苯甲酸离子,会在9位和14位之间形成双键,而双键所连接的4个原子不在同一平面,这导致双键的扭曲张力太强而无法形成。所以在二级或三级质谱中没有苯甲酸离子信号。

图8 苯甲酰次乌头碱裂解碎片离子结构
2.3 醇解产物定性 8号峰MS图显示相对分子量为618(见图9),与新乌头碱相对分子量相比减少了14;MS2图显示,存在[M+H-50]+,不存在[M+H-60]+和[M+H-60-28]+离子,说明不存在乙酰基,因此7号峰不是去甲基产物,判断为8位没有乙酰氧基存在;MS3图显示,碎片离子显示有[M+H-50-46]+出现,应为C8位脱去1分子乙醇的产物。根据已知新乌头碱和苯甲酰新乌头碱裂解规律以及文献查阅[13],鉴定7号峰应为8-乙氧基新乌头碱。

图9 8号峰、9号峰和11号峰的质谱图
9号峰的分子量为632,11号峰的分子量为602,同样的推理方法得出9号峰和11号峰分别为8-乙氧基乌头碱和8-乙氧基次乌头碱(见图10、图11);乙醇解反应式见图12。

图10 8-乙氧基新乌头碱和8-乙氧基乌头碱裂解碎片离子结构
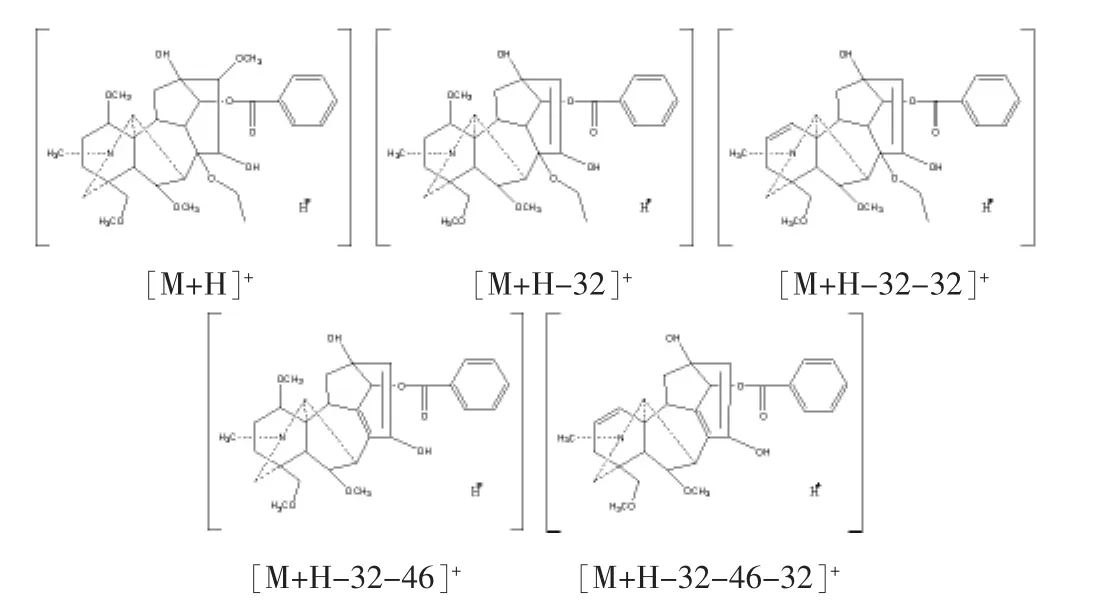
图11 8-乙氧基次乌头碱裂解碎片离子结构

图12 双酯型生物碱乙醇解反应
2.4 其他产物定性 7号峰从MS1可知(图13),分子量为556;从MS2图上可以看出,不存在碎片离子峰[M+H-60]+,说明不存在8-位乙酰基;存在碎片离子[M+H-32-28]+,说明存在CO基团。经查阅文献,比对碎片离子峰,确定为焦乌头碱,是由乌头碱加热转化生成[14]。
3 讨 论
乌头碱类生物碱中乌头碱、新乌头碱、次乌头碱等双酯型生物碱毒性最强,致死量极小。临床应用时常需先煎久煎以减弱其毒性,其减毒机制是破坏C8位所连接的酯键,由乌头碱等双酯型生物碱水解生成苯甲酰乌头碱等单酯型生物碱,达到减毒增效的目的。目前已有较多文献对附子中乌头碱质谱裂解行为和双酯型生物碱的C8位所连接的酯键分解反应开展研究。陈玉娟等采用ESI-MS正离子模式扫描分析乌头碱的多级质谱碎片,分析了乌头碱的质谱裂解行为[10];李铮等也采用ESI-MS正离子模式对乌头碱、中乌头碱和次乌头碱的水解产物进行多级质谱检测[15];王峰峰等利用液质联用技术,分别对乌头碱、次乌头碱和新乌头碱在水中和乙醇中的高温分解产物进行定性分析[11]。这些研究阐明了部分乌头碱的裂解规律,但都是对单一生物碱质谱裂解规律、水解及醇解产物的研究。由于生物碱之间存在相互作用,系统地对附子中6种生物碱质谱裂解规律开展研究,并对破坏双酯型生物碱C8位酯键的方法开展研究,仍然有很重要的意义。

图13 7号峰质谱图
本文系统地研究了附子中6种酯型生物碱质谱裂解机制,为附子药材、含附子的药品以及含有该类生物碱的生物样品快速定性、定量鉴别提供了依据,为类似化合物结构的鉴定和预测提供了参考。对于含有此6种生物碱的药材及制剂,本研究为其质量标准制定提供了参考,有利于其临床安全合理应用。
附子作为毒性药材,对其进行减毒增效一直是研究热点。传统中药材多采用水液煎熬,现代制药工艺中对部分中药材采用醇液提取,取得较好的效果。本文分析了双酯型生物碱乙醇解产物,并总结了其裂解规律。新乌头碱、乌头碱和次乌头碱3种双酯型生物碱在乙醇中发生乙醇解反应,分别生成8-乙氧基新乌头碱、8-乙氧基乌头碱和8-乙氧基次乌头碱。这些研究探索了一种破坏双酯型生物碱C8位所连接酯键的方法,为附子的减毒增效提供了一种新思路,也为后续研究乙醇解物质的毒性和药效奠定基础,同时为该类生物碱对照品溶液的配置不能选择水和乙醇溶剂提供了理论支撑。
本文是对六种生物碱对照品的混合物开展研究,没有加入其他干扰成分,没有分析药材中其他成分对反应的交叉影响。结合药材成分、生产工艺做进一步的乙醇解反应研究,是作者正在开展的工作。
[1] 国家药典委员会.中华人民共和国药典[M].一部.北京:中国医药科技出版社,2010:177-178.
[2] 肖日平,赖小平,赵亚,等.附子6种生物碱在比格犬体内药动学研究[J].中草药,2014,37(2):284.
[3] 黄志芳,易进海,唐小龙,等.乌头类药材酯型生物碱含量测定方法的优化[J].中国实验方剂学杂志,2013,19(14):101.
[4] 刘祥东,梁琼麟,罗国安,等.液质联用技术在医药领域中的应用[J].药物分析杂志,2005,25(1):110.
[5] 李蓓佳,向诚,杨秀伟,等.应用高效液相色谱-质谱联用技术研究通脉颗粒的指纹图谱[J].药学学报,2010,45(11):1410.
[6] 刘永刚,刘倩,张宏桂,等.高效液相色谱-质谱联用法研究乌头碱的水解产物[J].中国新药杂志,2007,16(4):303.
[7] 黄勤安,张聿梅,何轶,等.乌头碱水解转化规律的研究[J].中国中药杂志,2007,32(20):2143.
[8] 黄志芳,唐小龙,罗恒,等.HPLC-Q-TOF-MS分析附子的化学成分及煎煮过程中的变化规律[J].中国实验方剂学杂志,2015,21(1):57.
[9] 陈兰慧,金莲姬,苏忠民,等.乌头碱类生物碱电喷雾串联质谱行为及碎片离子稳定性的量子化学计算[J].高等学校化学学报,2005,26(12):2340.
[10]陈玉娟,王会堂,凡炼炼.乌头碱的质谱裂解行为分析[J].科技创新导报,2010,7(2):7.
[11]王峰峰,宋兆辉,张兰兰,等.乌头碱、新乌头碱、次乌头碱水解和醇解产物的研究[J].中国中药杂志,2012,37(11):1564.
[12]Yue H,Pi Z.Studies on the aconitine-type alkaloids in the roots of Aconitum carmichaeli Debx.By HPLC/ESIMS/MS[J]. Talanta,2009,77(4):1800.
[13]Wu SL,Liu F.8-O-Ethyl-yunaconitine from the roots of aconitum carmichaeli debx[J].Acta Crystallogr Sect E Struct Rep Online,2012,68(Pt 7):o2238.
[14]von Alred Kate,Hanspeter Rudin.Milde alkalische hydrolyse von aconitin[J].Helvetica Chimica Acta,1984,67:2017.
[15]李铮,谭鹏,王春国,等.乌头碱,中乌头碱,次乌头碱及水解产物的电喷雾质谱裂解机制研究[J].现代仪器,2011,7(2):42.
Study on the Fragmentation Behavior and Alcoholysates of Aconitum Alkaloids in Aconitum Carmichaeli Debx
ZHANG Chi,PAN Delin,ZHU Yaning,et al.China Resources SanJiu(Ya'an)Pharmaceutical Co.,Ltd.,Sichuan,Ya'an 625000,China.
Objective:To investigate the pyrolysis mechanism of six alkaloids in Aconitum carmichaeli Debx,and identify their alcoholysates.Methods:HPLC-ESI-MS was used in this study.The first and multi-stage mass spectrum of aconitum alkaloids were obtained in positive ion mode.Results:Through the analysis of multi-stage mass spectrometry,the fragmentation patterns of six alkaloids were illuminated,and the alcoholysates of the diester alkaloids were identified.Conclusion:Three diester alkaloids are alcoholyzed in ethanol and generated three new products respectively,8-ethoxy-mesaconitine,8-ethoxy-aconitine and 8-ethoxy-hypaconitine;pyraconitine is generated at the same time because the reaction proceeds under heating.
Aconitum carmichaeli Debx;Aconitine;Diester alkaloids;Fragmentation regularity;Alcoholysate
R285.5
A
1004-745X(2016)12-2278-05
10.3969/j.issn.1004-745X.2016.12.021
2016-07-21)
国家“重大新药创制”科技重大专项(2013ZX09201018)
△通信作者(电子邮箱:zhangchi1728@163.com)
