肝豆状核变性的MRI诊断与临床相关分析
2017-01-10丁辉黎胜强蔡立君
丁辉 黎胜强 蔡立君
(1.贵州省第二人民医院影像科,贵州 贵阳 550001;2.贵州医科大学附属医院神经内科,贵州 贵阳 550004)
肝豆状核变性的MRI诊断与临床相关分析
丁辉1黎胜强1蔡立君2
(1.贵州省第二人民医院影像科,贵州 贵阳 550001;2.贵州医科大学附属医院神经内科,贵州 贵阳 550004)
肝豆状核变性; 磁共振成像; 血清铜蓝蛋白; K-F 环
肝豆状核变性(HLD)又称威尔逊氏病(WD),是一种铜代谢异常的常染色体隐性遗传疾病[1],主要由第13号染色体上基因突变或缺陷导致。HLD 患者体内游离铜离子不能被铜蛋白结合,过量铜离子在患者肝脏、大脑和角膜等部位沉积产生毒性,引起患者各系统功能异常改变[2-3]。如早期诊断及时治疗,效果良好[4]。现将我院住院及门诊确诊 30例 HLD 患者临床病史、头颅MRI及实验室检查等资料分析,旨在探讨HLD头部MRI表现及其与临床病史的相关性。
1 资料与方法
1.1 临床资料 选择2010年3月至2015年3月我院住院及门诊确诊的HLD 患者 30 例,男 20 例,女 10 例;年龄9~42 岁,平均(17.23 ±5.87)岁。HLD 诊断标准[5]:(1)有肝损害或神经系统临床表现;(2)血清铜蓝蛋白(CP)降低(<200 mg/L);(3)尿铜升高(>100 μg/24 h); (4)裂隙灯下可见双侧角膜出现典型黄棕色 K-F 环。同时具备以上1~3项者可拟诊为HLD。
1.2 方法 HLD患者头颅MRI检查使用GE 1.5T MR 超导型磁共振成像机,头颅线圈,层厚6~8 mm,层间距1~2 mm,SE序列T1WI:TE21 ms,TR1 741 ms;T2WI: TE113 ms,TR5 000 ms;T2WI Flair 序列:TE151 ms,TR8 402 ms;DWI序列:TE113 ms,TR4 500 ms。常规横断面,部分加矢冠状T2WI。诊断标准[6]:(1)肝功能衰竭者表现为双侧苍白球、中脑背侧对称性的短 T1 高信号改变;(2)青少年或年轻成人患者的双侧基底节、中脑背侧、丘脑、大脑脚、小脑上脚和齿状核出现长 T1长T2或短T2信号;(3)常常出现脑白质萎缩,有时可在大脑半球的白质内出现局灶性的长 T1长T2或短T2信号。抽取拟诊为 HLD 患者禁食后的新鲜血清,采用免疫比浊法检测血清铜蓝蛋白;眼科裂隙灯下行K-F 环检查。
1.3 观察指标 观察患者头颅MRI影像资料、首发症状、合并损害、血清铜蓝蛋白量、K-F环等。
2 结 果
2.1 临床特征 30例 HLD 患者中,以神经精神症状首诊者 26例(87%),主要表现为肢体震颤、全身不自主运动、活动笨拙、言语不流畅、步态不稳、肌张力增高等锥体外系异常症状及精神行为异常等;肝脏症状首诊 2 例(7%),主要为黄疸表现;合并肝硬化者 6例(20%),血液系统异常者 5 例(17%)。K-F 环及血清铜蓝蛋白K-F 环阳性者 25 例(83%);血清铜蓝蛋白<0.2 g/L者 28 例(93%)。
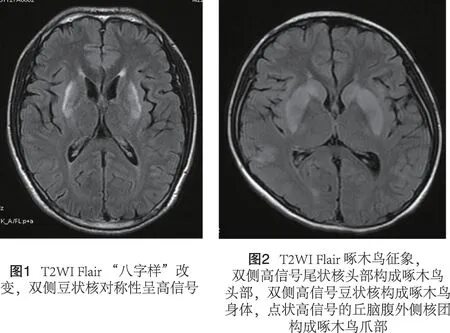
2.2 头颅MRI 30例患者头颅 MRI 检查均可见双侧基底节区对称性条状或新月形异常信号。其中壳核26例,尾状核 13 例,丘脑 11 例,苍白球3例,红核2例,黑质、大脑脚网状结构、脑桥桥核、额叶白质各 1 例。病灶呈长 T1,短T2、长 T2信号,以长T1长T2为主,FIR 高信号,DWI呈等低或高信号。典型者在 T2WI 及 FIR 图像基底节层面上,依据受累基底节神经核团的不同,分别表现为“八”字、啄木鸟样等征象(图1)。豆状核病变者呈“八”字样改变。啄木鸟样改变为双侧对称影像,由两侧病变的尾状核头部构成啄木鸟头部,高信号实心的壳核构成啄木鸟身体,呈点状高信号的丘脑腹外侧核团构成啄木鸟爪部,双侧则形成对称啄木鸟影像。见图2。T1WI 中上述影像表现为长 T1 较低信号。丘脑病变者呈缺爪啄木鸟样改变。14 例患者呈轻度或中度脑萎缩,表现为不同程度的脑沟池增宽、加深及脑室系统扩大等脑萎缩表现。见图3,4。

3 讨 论
HLD 是一种常染色体隐性遗传的铜代谢异常疾病,因染色体13q14. 3的致病基因 ATP7B突变,导致ATP酶功能减弱或丧失,使血清铜蓝蛋白减少及肝细胞排泄到胆汁的铜减少,铜离子积聚在肝并释放入血,造成肝脏、大脑、肾和角膜等器官的功能发生障碍,从而出现一系列的铜中毒表现,引起渐进性锥体外系症状、精神异常、肝硬化、肾损坏及角膜K-F环色素沉着[7]。HLD发病率呈1/3 000~1/100 000,在中国较多见,且多见于青少年。
HLD的临床表现多表现为神经系统症状,包括震颤,构音障碍,唾液增多,言语不流畅,运动协调障碍,肌张力障碍,共济失调,肢体震颤,全身不自主运动,活动笨拙,步态不稳,肌张力增高等[7]。HLD 主要侵害肝脏及神经系统,以消化系统症状首诊者其肝脏病变严重程度与颅内病变程度无明显相关性;而以神经系统症状首诊者头颅MRI多有异常表现,症状严重程度与颅内病变多呈正相关,少部分患者合并消化系统及血液系统损害。
MRI由于对颅内结构具有较高软组织密度分辨率,已被作为诊断HLD的一种重要辅查技术。HLD 头颅典型MRI表现形式多样,累及豆状核、苍白球、丘脑、尾状核、脑干、下丘被盖部、红核、黑质、脑白质和齿状核灰白质等部位,病变广泛,呈对称性长T1 、短T2或长T2信号[8]。病灶区MRI信号改变,多呈长T1及稍长T1、长T2及稍长T2信号。脑灰质呈长T2信号,其病理机制可能是脑水肿、胶质增生、神经元坏死或囊性变。脑白质呈长T2信号,其病理机制可能是脱髓鞘、软化、海绵样变性等。少数病例呈短T2信号,其病理机制可能为铜离子沉积增多,导致顺磁短T2效应超过脑水肿及胶质增生造成的长T2效应。脑萎缩多系广泛脑实质由于铜沉积,导致神经元损坏、减少、退变,相邻脑组织软化或海绵状异常改变,使脑沟池及脑室系统增宽、增大,导致大脑和小脑皮髓质层的萎缩[9]。
弥散加权成像(DWI)通过测量施加扩散敏感梯度场前后组织信号强度的变化,检测人体组织中水分子扩散运动状态受限制的方向和自由度,间接反映组织微观结构的变化特点,其能敏感检测到先于形态学改变而组织细胞内水分子运动变化相关病变[10]。部分HLD患者的脑实质病灶DWI序列上呈高信号,其病理基础多为神经细胞变性肿胀、细胞毒性水肿,导致弥散受限,病灶处于进展活动期。等低信号病灶多系非活动期,受损细胞水分子弥散运动未受限,表现为渐进性细胞变性、脱髓鞘,自由水分子增多,可根据其DWI信号改变,指导临床的治疗及疗效观察。除了以往常规检查的 T1WI、T2WI、T2WIFlair、DWI序列,现MRS、SWI、DTI等特殊扫描序列也被越来越广泛地用于HLD 患者头颅影像学诊断,并且可更深入帮助了解局部解剖部位受损的情况及评估病情疗效等[11-13]。
总之,HLD在头颅MRI成像中具有较典型特征,呈多样性、累及多个部位并多伴有脑萎缩。同时,进展期病灶在DWI序列上弥散受限呈高信号,MRI异常表现与疾病的严重程度呈正相关,弥散受限与疾病过程的持续时间呈负相关[11]。因此,根据MRI特征,结合其临床表现和实验室检查,可为HLD的早期诊断及治疗效果评价提供有价值依据。
[1] Lutsenko S.Modifying factors and phenotypic diversity in Wilson's disease[J].Ann N Y Acad Sci,2014(1315):56-63.
[2] Espinoza H,Yeinis P,Munoz R,et al.Wilson's disease:re-view[J].Iatreia,2013(1):58-66.
[3] Alam ST,Rahman MM,Islam KA,et al.Neurologic mani-festations,diagnosis and management of Wilson's disease in children-an update[J].MymensinghMed J,2014(1):195-203.
[4] Harada M.Pathogenesis and management of Wilson dis-ease[J].Hepatol Res,2014(4):395-402.
[5] Hahn SH.Population screening for Wilson's disease[J].AnnN Y Acad Sci,2014(1315):64-69.
[6] 鱼博浪.中枢神经系统影像诊断与临床[M].北京:人民军医出版社,2008:44-46.
[7] 中华医学会神经病学分会帕金森病及运动障碍学组,中华医学会神经学分会神经遗传病学组. 肝豆状核变性的诊断与治疗指南[J].中华神经科杂志,2008,41(8):566-569.
[8] Gupta A,Chakravarthi S,Goyal MK. Face of giant panda:a rare imaging sign in Wilson's disease[J]. QJM,2014(7):579.
[9] Jigar R,Parekh,Preetesh R,et al. Wilson's disease:‘face of giant panda’and‘trident’signs together[J]. Oxford Medical Case Reports,2014(1):16-17.
[10] Woodhams R,Ramadan S,Stanwell P,et al. Diffusion-weighted imaging of the breast:principles and clinical applications[J]. Radiographics,2011,31(4):1059-1084.
[11] Pulai S,Biswas A,Roy A,et al.Clinical features,MRI brain,and MRS abnormalities of drug-naïveneurologic Wilson's disease[J]. Neurol India,2014(2):153-158.
[12] Bai X,Wang G,Wu L,et al.Deep-gray nuclei susceptibil-ity-weighted imaging filtered phase shift in patients with Wilson's disease[J].Pediatr Res,2014(3):436-442.
[13] Li G,Zhou X,Xu P,et al.Microstructure assessment of the thalamus in Wilson's disease using diffusion tensor imaging[J]. Clin Radiol,2014(3):294-298.
R445.2
B
1000-744X(2016)04-0405-02
2016-01-20)
