野生水芹的急性毒性及遗传毒性研究
2017-01-10王雨吴克枫俞红刘泳廷刘佳
王雨 吴克枫 俞红 刘泳廷 刘佳
(贵州省疾病预防控制中心,贵州 贵阳 550004)
野生水芹的急性毒性及遗传毒性研究
王雨 吴克枫 俞红 刘泳廷 刘佳
(贵州省疾病预防控制中心,贵州 贵阳 550004)
野生水芹; 急性毒性; 遗传毒性
野生水芹[Oenanthe javanica (BI.) DC.简称水芹],隶属于伞形科水芹属,又名楚葵、野芹菜,为多年水生宿根草本植物[1]。近年来国内外学者对水芹的活性成分开展分析并通过动物药理实验研究证实,水芹含有挥发油类、甾醇类、醇类、脂肪酸类、黄酮类等成分,在抗肝炎、抗心律失常、抗糖尿病和降血压、降血脂等方面具有多方面用途,被认为是一种优质的保健蔬菜[2-3],但其毒性研究少见报道,本研究为探讨水芹安全性,选用了急性毒性和遗传毒性试验对其进行毒理学检测。
1 资料与方法
1.1 临床资料
水芹由市场购得,选用地上可食部分,洗净晾干后放入70 ℃通风式烘箱中干燥至恒质量,粉碎过100目筛,放置干燥器中备用。1 g干粉等于13 g水芹鲜重。实验中剂量均指鲜重。
本研究所用动物为SPF级昆明小鼠,购自贵州医科大学实验动物中心,实验动物生产许可证号SCXK(黔)2012-0001,动物质量合格证号:小鼠0201504、0201211,购进动物适应性喂养3 d,辐照灭菌清洁级饲料由苏州双狮实验动物饲料科技有限公司提供。饲料合格证号为苏饲审(2009)05032。动物房为屏蔽环境,温度18~24 ℃,湿度40%~70%。实验动物使用许可证号SYXK(黔)2014-001。
1.2 主要仪器及试剂
生物显微镜、手术器械、恒温培养箱、高压灭菌器、恒温水浴摇床、电子天平、全自动菌落计数仪、常规试剂。
1.3 实验方法
参照中华人民共和国卫生部2003年《保健食品检验与评价技术规范》[4]。
1.3.1 急性毒性实验 实验采用最大耐受剂量法。选用体质量为18~22 g昆明种小鼠20只,雌雄各半。根据急性毒性剂量分级标准,试验剂量设为15 g/(kg·bw)灌胃前禁食16 h,灌胃后连续观察两周,记录动物中毒表现及死亡情况。
1.3.2 Ames试验 采用平板掺入法,测试菌株为TA97、TA98、TA100、TA102,经鉴定各种生物学特性均符合要求。受试物剂量为8、40、200、1 000、5 000 μg/皿,同时设自发回变、溶剂对照和阳性对照,在加和不加S9混合液的条件下分别进行测试。整套试验在相同条件下重复做两次。
1.3.3 小鼠骨髓嗜多染红细胞微核实验 选用昆明种小鼠50只,体质量25~30 g,随机分为5组,每组10只,雌雄各半,以环磷酰胺50 mg/(kg·bw)剂量为阳性对照,蒸馏水为阴性对照,试验组高、中、低3个剂量分别为10.00 g/(kg·bw)、5.00 g/(kg·bw)、2.50 g/(kg·bw)。采用间隔24 h两次经口灌胃法进行试验,于第2次给予受试物后6 h颈椎脱臼处死动物,取胸骨制片,甲醇固定,Giemsa染色,每只动物油镜下观察1 000个嗜多染红细胞(PCE)中出现的微核细胞数,计算微核率(‰),计数200个PCE的同时计数观察到的正染红细胞(NCE)数,并计算PCE/NCE比值。
1.3.4 小鼠精子畸形试验 选用体质量25~35 g雄性昆明种小鼠25只,随机分为5组,每组5只,以环磷酰胺50 mg/(kg·bw)剂量为阳性对照,蒸馏水为阴性对照。实验组高、中、低3个剂量分别为10.00 g/(kg·bw)、5.00 g/(kg·bw)、2.50 g/(kg·bw)连续5 d经口灌胃给予受试物,于首次灌胃后35 d颈椎脱臼处死动物,取双侧附睾制片,伊纤染色,每只小鼠观察1 000个完整精子,计算精子畸形率(%)。
1.4 统计学处理
采用SPSS 18.0软件包进行统计学分析,P<0.05为差异有统计学意义。
2 结 果
2.1 急性毒性试验
以15 g/(kg·bw)剂量的水芹灌胃20只小鼠(雌雄各半),未观察到实验动物出现中毒症状和死亡,样品MTD>15 g/(kg·bw)属急性无毒级。
2.2 Ames试验
自发回变、溶剂对照菌落数均在正常范围,加与不加S9混合液的受试物各剂量组的回变菌落数与阴性对照组的回变菌落数之比(MR)均<2,亦无剂量-反应关系,而阳性对照组与溶剂对照组的回变菌落数之比>2。表明水芹无诱 导TA97、TA98、TA100、TA102回复突变能力,见表1,2。


剂量/(μg/皿)TA97-S9+S9TA98-S9+S9TA100-S9+S9TA102-S9+S98161±34132±1739±349±5154±36144±39304±63325±5640140±42133±32 17±1442±2163±46157±66282±98295±56200132±33124±1224±830±8155±45183±20287±33353±741000167±35200±1325±7 31±22168±58167±45327±47287±465000156±39161±4424±4 32±13175±37162±53357±31263±44蒸馏水170±25148±2733±638±4186±14189±8 248±32263±34DMSO151±24149±1738±840±4155±17158±18289±20288±14敌克松2284±2121137±84 MMS3116±936108±3772⁃AAF1743±1416567±4503011±1201.8⁃二羟基蒽醌899±163


剂量/(μg/皿)TA97-S9+S9TA98-S9+S9TA100-S9+S9TA102-S9+S98145±31176±3126±238±9128±13175±47316±67 328±10240140±29133±3223±839±9120±21135±30334±32285±16200134±50161±3429±739±4179±34140±28289±11319±291000140±31183±29 37±1119±8138±30130±32329±63320±465000208±22134±1631±642±9150±21142±25314±42302±76蒸馏水159±9166±934±747±4193±7 181±12285±28273±42DMSO149±17150±1938±839±8152±17146±16282±31262±22敌克松268±1471859±530MMS3144±1216254±3872⁃AAF1666±134 6187±1283272±4581.8⁃二羟基蒽醌〛873±124
2.3 小鼠骨髓嗜多染红细胞微核试验
各剂量组微核率与阴性对照组比较差异无统计学意义(P>0.05),阴性对照组与环磷酰胺组比较差异有统计学意义(P<0.01)。各组PCE/NCE值均在正常值范围内。故在本试验剂量范围内,小鼠骨髓嗜多染红细胞微核试验结果为阴性,见表3。

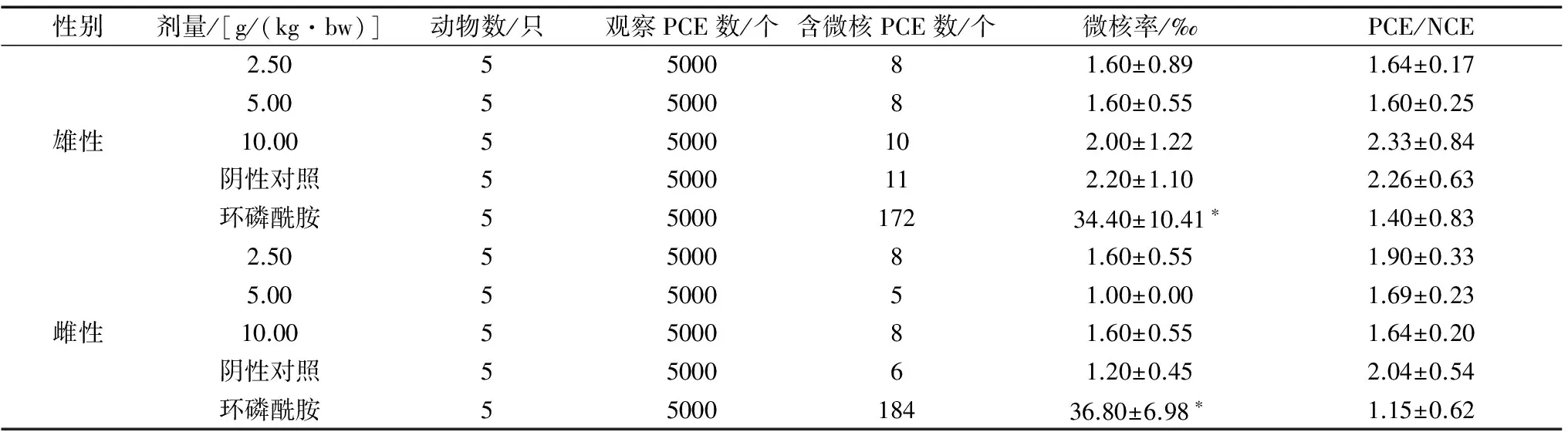
性别剂量/[g/(kg·bw)]动物数/只观察PCE数/个含微核PCE数/个微核率/‰PCE/NCE2.505500081.60±0.891.64±0.175.005500081.60±0.551.60±0.25雄性10.0055000102.00±1.222.33±0.84阴性对照55000112.20±1.102.26±0.63环磷酰胺55000172 34.40±10.41∗1.40±0.832.505500081.60±0.551.90±0.335.005500051.00±0.001.69±0.23雌性10.005500081.60±0.551.64±0.20阴性对照5500061.20±0.452.04±0.54环磷酰胺5500018436.80±6.98∗1.15±0.62
注:与阴性对照组比较,*P<0.01。
2.4 小鼠精子畸形试验
阴性对照组与环磷酰胺组比较差异有统计学意义(P<0.01),各剂量组与阴性对照组比较,差异均有统计学意义(P<0.05),且有明显的剂量-反应关系,故在本试验剂量范围内,小鼠精子畸形试验结果为阳性。见表4。
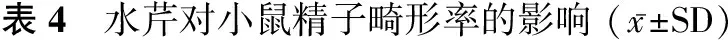

剂量/[g/(kg·bw)]动物数/只观察精子数/个香蕉/个精子畸形类型/个无钩不定形其他精子畸形合计畸形数/个畸形率/%2.505500071860391242.48±0.37∗5.0055000205783492094.18±0.85∗∗10.00550003487109162464.92±0.96∗∗阴性对照5500010144324911.82±0.19环磷酰胺55000106104130914318.62±0.98∗∗
注:与阴性对照组比较,*P<0.05;与阴性对照组比较,**P<0.01。
3 讨 论
急性毒性试验可在短时间内观察给予受试物后动物所产生的毒性反应,为进一步进行毒性试验的剂量提供依据;遗传毒性试验的组合应考虑原核细胞与真核细胞、生殖细胞与体细胞、体内与体外试验相结合的原则,对受试物的遗传毒性以及是否具有潜在致癌作用进行筛选。Ames试验广泛应用于检测化学物的致突变性,是原核细胞基因突变试验的首选;微核与染色体损伤有关,测定骨髓PCE的微核发生率是检测细胞遗传损伤的一个非常有效的指标;精子畸形试验能够检测多种类型的化学物对生殖细胞的诱变作用[5]。本次我们对水芹进行了急性毒性和遗传毒性的研究,水芹的小鼠精子畸形试验各剂量组精子畸形率均显著高于阴性对照组,且呈剂量-反应关系,表明水芹可能对生殖细胞有诱变作用。
水芹的黄酮类物质含量是旱芹的2倍[6],其中芹菜素的含量也高于其他蔬菜[7]。国内外学者对黄酮安全性的研究存在分歧,一方面黄酮类化合物被认为具有抗炎、抗菌、抗病毒、抗肿瘤、抗氧化等多种生物活性[8];另一方面一些体外实验和动物实验发现了某些黄酮类化合物具有毒副作用,包括遗传毒性、致癌毒性、抗营养效果等[9]。Rueff等[10]认为黄酮类化合物在体内的代谢可以部分解释遗传毒性和致癌性研究得出冲突结论的原因。芹菜素属黄酮类化合物,有研究[11-12]发现,芹菜素可致精子质量及形态变化,对睾丸组织有一定的损伤作用[13],提示具有遗传毒性。故水芹致小鼠精子畸形率升高可能与芹菜素的作用有关,具体作用机制有待进一步研究。水芹资源在我国各地均有分布,尤以中东部和南方各省更为多见,是很多地区的传统特色水生蔬菜,但本次实验研究表明,在未进行综合全面的安全性评价之前,不宜盲目大量开发采食野生水芹。
[1] 吴征镒.新华本草纲要[M].上海科学技术出版社,1988:369.
[2] 李银姬,朴惠善.水芹的研究进展[J].延边医学院学报,1996,19(4):243-245.
[3] 黄凯丰,时政,欧腾,等.水芹的营养保健成分分析[J].江苏农业科学,2011,39(5):434-435.
[4] 中华人民共和国卫生部.保健食品检验与评价技术规范[S].北京:卫生部法制与监督司编印,2003.
[5] 黄幸纾,陈星若.环境化学物致突变、致畸、致癌试验方法[M].杭州:浙江科学技术出版社,1985:3-13,218-265.
[6] 刘恒蔚,高梦祥,饶贵珍.野生水芹与早芹的营养成分比较分析[J].中国野生植物资源,2007,26(1):36-38.
[7] 刘淑萍,邸丁.不同种类蔬菜中黄酮类成分的含量分布[J].河北联合大学学报:自然科学版,2012,34(3):112-114.
[8] 张华峰,王瑛,黄宏文.黄酮类化合物生物合成途径的进化及其在淫羊蒮中的研究展望[J].中草药,2006,37(11):1745-1751.
[9] 汪何雅.黄酮类化合物的潜在毒性[J].卫生研究,2007,36(5):640-642.
[10] Rueff J,Laires A,Borba H.Genetic toxicology of flavonoids:the role of metabolic conditions in the induction Of reverse mutation SOS functions and sister-chromatid exchanges[J].Mutagenesis,1986,1(3):179-183.
[11] 张晓晶.芹菜素对小鼠睾丸氧化还原平衡及功能的影响阳[D].兰州大学,2013,27-28.
[12] 吴双,陈文材,刘玲飞,等.芹菜素对大鼠精子质量及性激素的影响[J].毒理学杂志,2014,28(5):385-388.
[13] 寇咏梅,郭晓霞.芹菜素对生殖系统及内分泌影响的研究进展[J].国际生殖健康/计划生育杂志,2013,32(4):305-308.
R282.71
B
1000-744X(2016)04-0375-03
2016-01-30)
