MMP-2在缺氧缺血性脑损伤新生大鼠海马中的表达及意义
2017-01-10殷杰陈蓉肖东凡
殷杰 陈蓉 肖东凡
(1.贵州医科大学,贵州 贵阳 550004;2.贵州省人民医院新生儿科,贵州 贵阳 550002)
MMP-2在缺氧缺血性脑损伤新生大鼠海马中的表达及意义
殷杰1,2陈蓉2△肖东凡1,2
(1.贵州医科大学,贵州 贵阳 550004;2.贵州省人民医院新生儿科,贵州 贵阳 550002)
目的 探讨在缺氧缺血性脑损伤(HIBD)新生大鼠海马中基质金属蛋白酶-2(MMP-2)的表达及其作用。方法 将7 d龄新生SD大鼠42只随机分为假手术组及HIBD模型组,后者根据处死时间分为 6 h、12 h、24 h、48 h、3 d、7 d组(n=6),采用免疫组织化学方法检测各组大鼠海马中MMP-2的表达水平。结果 MMP-2蛋白表达量在HIBD后呈逐渐增高趋势,在24 h至3 d时间段增长趋势平缓,到7 d时显著增高达高峰;与假手术组比较,24 h组、48 h组、3 d组、7 d组差异均有统计学意义(P<0.05)。结论 MMP-2在新生大鼠HIBD后各时间点表达有不同程度的变化,可能参与了HIBD的发生发展。
基质金属蛋白酶-2; 缺氧缺血性脑损伤; 新生大鼠; 海马
新生儿缺氧缺血性脑病(HIE)是围产期窒息缺氧引起新生儿死亡及神经发育障碍的原因之一,目前仍无较好的预防及治疗措施。其发病机制复杂,其中血脑屏障的破坏及通透性改变导致脑水肿是早期发生的主要病理过程和损害因素。基质金属蛋白酶(MMPs)是一组Zn2+依赖的蛋白水解酶,主要参与细胞外基质及基底膜的降解和重塑[1]。其中MMP-2是MMPs基因家族中的一个重要成员,对脑损伤后血脑屏障的破坏发挥着重要的调节作用[2],但最近研究[3-4]表明MMP-2还可能参与了神经损伤的修复,故目前关于MMPs在缺氧缺血性脑损伤(HIBD)后脑组织中的表达研究观点不一,其作用尚未完全明确。本实验旨在观察 HIBD 的发生发展过程中MMP-2在海马的动态表达变化,以探讨其在 HIBD病程中的作用及意义,为临床治疗HIE提供理论依据。
1 资料与方法
1.1 材料
1.1.1 实验动物及分组 健康7 d龄SD大鼠(清洁级,母鼠带养)42只,雌雄不限,体质量8~15 g(购自贵州医科大学实验动物中心),批号: ISCXK(黔) 2012-001。随机分成假手术组(n=6)、HIBD模型组(n=36),根据处死时间点HIBD组又分6个亚组:6 h、12 h、24 h、48 h、72 h、7 d,每个亚组6只。
1.1.2 主要试剂及仪器 兔抗鼠MMP-2单克隆抗体(美国abcam,ab86607);山羊抗鼠一步法免疫组化聚合物检测试剂盒(北京中杉金桥,PV-6002);4%多聚甲醛(武汉博士德,AR1068);600数显三用恒温水浴箱(金坛市友联仪器研究所);密闭缺氧舱(上海新华医院研究所);8%O2+92%N2混合气体(贵阳申建气体公司);倒置显微镜(日本Nikon TE-2000)。
1.2 方法
1.2.1 动物模型的制备 根据改良Rice法,大鼠乙醚吸入麻醉后,将其仰卧固定于操作板上,常规消毒切开颈部皮肤,分离并结扎左颈总动脉, 缝合切口,待大鼠清醒后置于37 ℃恒温水浴密闭缺氧舱中,以2 L/min流量向舱内通入8%O2+92%N2混合气体,2 h后恢复正常供氧并将大鼠送回母鼠身边喂养。假手术组仅切开颈部皮肤, 分离左颈总动脉后不予结扎, 缝合切口后不做低氧处理。
1.2.2 标本与切片制备 将各组大鼠用10%水合氯醛(300 mg/kg)腹腔麻醉后,开胸暴露心脏,自心尖进针向左心室内灌注无菌生理盐水,同时剪开右心耳,至流出液体清亮,肝脏及肺脏变白后,继续灌注4%多聚甲醛至大鼠僵硬后,断头取全脑组织置于4%多聚甲醛中室温固定72 h以上。取固定好的脑组织,从视交叉及其后5 mm处行冠状切面(包括海马区),经过脱水、石蜡包埋后,切片(4 μm),贴片于防脱载玻片上,60 ℃烤片2 h备用。
1.2.3 免疫组织化学检测 切片常规脱蜡至水,120 ℃乙二胺四乙酸(EDTA)抗原修复液修复2 min;3%H2O2孵育浸泡10 min,阻断内源性过氧化物酶;PBS冲洗3 min×3次,滴加一抗(MMP-2,1∶100),湿盒中4 ℃过夜,PBS冲洗3 min×3次;滴加聚合物检测试剂,37 ℃孵育15 min,PBS冲洗2 min×3次;滴加DAB显色试剂显色,显微镜下观察显色,自来水适时终止,苏木素复染,自来水返蓝;脱水、透明后封片。以细胞浆着色为黄色或棕黄色判定为MMP-2蛋白阳性表达,高倍镜下在海马区随机取5个视野采图,利用Image pro plus6.0图像分析软件测定积分光密度值(IOD)。
1.3 统计学处理
2 结 果
各组海马区MMP-2 蛋白表达见图1,假手术组海马区可见MMP-2有少量阳性细胞表达(图1a),HIBD各组海马区MMP-2蛋白表达于缺氧缺血后呈逐渐增加趋势,但在24 h至3 d时间段增长趋势平缓(图2),到7 d时胞浆染色最深(图1g),蛋白表达至高峰(图2)。与假手术组比较,HIBD模型组24 h、48 h、3 d、7 d MMP-2蛋白表达差异有统计学意义(P<0.05)。见表1。

图1 各组大鼠海马区MMP-2蛋白表达(×400)
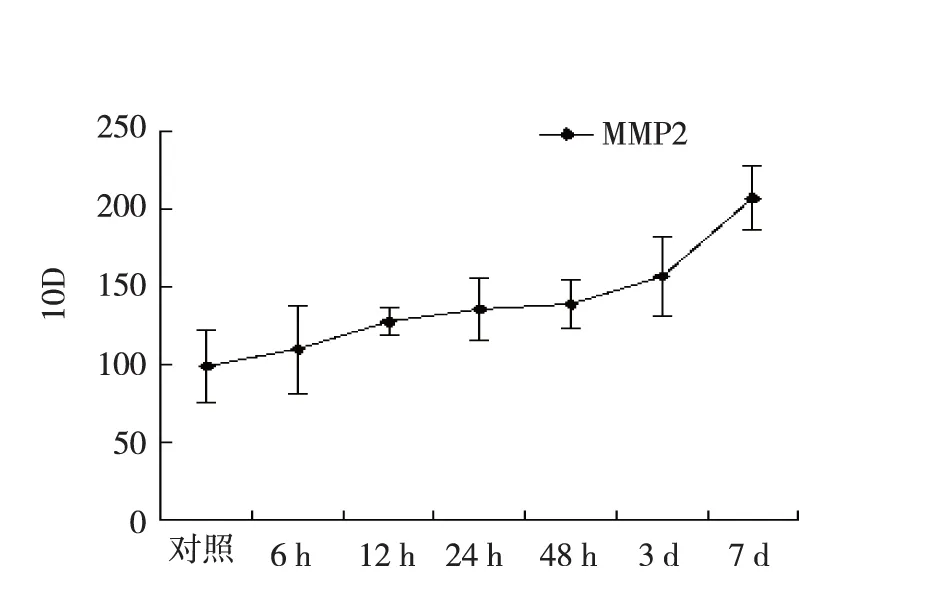
图2 各组MMP-2积分光密度值(IOD)趋势
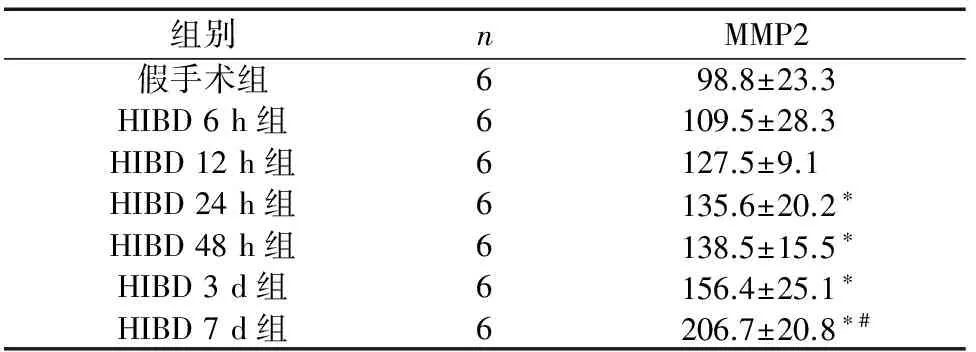
组别nMMP2假手术组698.8±23.3HIBD6h组6109.5±28.3HIBD12h组6127.5±9.1HIBD24h组6135.6±20.2∗HIBD48h组6138.5±15.5∗HIBD3d组6156.4±25.1∗HIBD7d组6206.7±20.8∗#
注:与对照组比较,*P<0.05;与HIBD模型组前一时间点比较,#P<0.05。
3 讨 论
MMPs是一类锌依赖性蛋白水解酶家族,研究[5]表明,该家族中MMP-2对细胞外基质分子的降解及其对血脑屏障的破坏与脑损伤密切相关。MMP-2即明胶酶A,在中枢神经系统中主要由神经元、脑血管内皮细胞、神经胶质细胞、巨噬细胞等合成和分泌,其作用底物包括胶原蛋白、弹性蛋白、蛋白多糖和纤维连接蛋白等[6]。Rosenberg等[7]早期发现在大鼠脑内注射MMP-2可促使血脑屏障开放,因其可降解细胞外基质的主要成分如Ⅳ型胶原、纤维连接蛋白和脑血管基底膜,导致血管源性脑水肿,故现将MMPs作为脑损伤严重程度的标志。通过应用MMPs抑制剂及类似物来抑制MMPs表达从而发挥对血脑屏障保护作用的研究已成为热点。
本研究结果显示HIBD后MMP-2在海马区蛋白表达呈逐渐增高趋势,从24 h开始与对照组比较差异有统计学意义,但在24 h至3 d期间增长趋势缓慢,差异无统计学意义。3 d后显著增高,到7 d时达高峰,与陈大庆等[8]研究基本一致。说明缺氧缺血刺激可诱导MMP-2表达增加,其可能参与HIBD后血脑屏障的破坏,但可能并非是导致HIBD后脑水肿的主要因子。一般认为,HIBD后血脑屏障的破坏及通透性增高造成的脑水肿于24~48 h达高峰。本实验中HIBD后MMP-2表达高峰出现较晚,与脑水肿高峰时间不符。而近年多数研究提示,MMP-2与神经修复有着密切关系。Szepesi等[3]及Cossanzo等[4]研究表明,MMP-2可促进神经损伤后突触的结构重建及再生。本实验结果显示HIBD后MMP-2表达于7 d时达高峰,与血管生成及神经胶质增生出现的时间基本平行,提示MMP-2在HIBD恢复阶段可能发挥修复作用。马跃文等[9]对大鼠进行跑台训练,发现7 d及14 d时缺血再灌注脑损伤组大鼠较假手术组Longa神经功能评分明显降低,MMP-2及VEGF表达水平显著升高,提示高表达的MMP-2和VEGF可能通过诱导血管发生而在神经保护中起着重要作用。Romanic 等[10]观察到大鼠脑缺血后24 h MMP-2出现在梗死区巨噬细胞,其活性在第5天达到高峰,故认为MMP-2 可能有助于巨噬细胞向缺血区域的转移,其主要功能为吞噬细胞碎片和坏死机体组织,有助于组织损伤的修复。
MMP-2 在HIBD发生发展过程中可能起着双重作用,HIBD早期,MMP-2参与降解细胞外基质及基底膜,导致血脑屏障结构及功能受损;而在HIBD晚期,MMP-2可能促进突触再生、新生血管生成,有利于神经修复。现在许多研究应用MMPs抑制剂,通过其抑制MMPs表达起到保护血脑屏障作用。但考虑到MMP-2的双重作用,在MMPs抑制剂运用到临床治疗前还需进行更进一步研究,如其治疗HIE最佳时间窗的选择。同时鉴于MMP-2在HIBD晚期的保护作用,MMPs或类似物的应用可能为HIE的治疗开辟新的道路,同样其神经修复的具体机制仍需更深入的探索。
[1] Kim YS,Joh TH.Matrix metalloproteinases,new insights into the understanding of neurodegenerative disorders[J].Biomolecules ,2012,20(2):133-143.
[2] Liu J,Jin X,Liu KJ,et al.Matrix metalloproteinase-2-mediated occludin degradation and caveolin-1-mediated claudin-5 redistribution contribute to blood-brain barrier damage in early ischemic stroke stage[J].The Journal of Neuroscience: The official journal of the society for neuroscience ,2012,32(9):3044-3057.
[3] Szepesi Z, Bijata M,Ruszczycki B,et al.Matrix metalloproteinases regulate the formation of dendritic spine head protrusions during chemically induced long-term potentiation[J].PLoS ONE ,2013,8(5):1-11.
[4] Costanzo RM,Perrino LA . Peak in matrix metalloproteinases-2 levels observed during recovery from olfactory nerve injury[J].Neuro Report,2008,19:327-331.
[5] Saran Feng,Jiannong Cen,Yihong Huang,et al.Matrix metalloproteinase-2 and-9 secreted by leukemic cells increase the permeability of blood-brain barrier by disrupting tight junction proteins[J].PLoS One ,2011,6(8):e20599.
[6] Kurzepa Jacek,Kurzepa Joanna,Golab Piotr,et al.The significance of matrix metalloproteinase (MMP)-2 and MMP-9 in the ischemic stroke[J].International Journal of Neuroscience,2014,124(10):707-716.
[7] Rosenberg GA,Dencoff JE,Correa N,et al.Effect of steroids on CSF matrix metalloproteinases in multiple sclerosis:relation to blood-brain barrier injury[J].Neurology,1996,46(6):1626-1632.
[8] 陈大庆,张荣,朱烈烈,等.大鼠脑出血后MMP-2、MMP-9的表达与神经元凋亡关系的实验研究[J].福建医药杂志,2008,6:4-6.
[9] 马跃文,强琳.跑台训练对大鼠脑缺血再灌注后脑组织基质金属蛋白酶-2和血管内皮生长因子表达的影响[J].中国康复医学杂志,2012,6:519-523.
[10] Romanic AM, White RF,Arleth AJ,et al. Matrix metalloproteinase expression increases after cerebral focal ischemia in rats. Inhibition of matrix metalloproteinase-9 reduces infart size[J]. Stroke, 1998,29(8):1020-1030.
Expression and significance of MMP-2 in the hippocampus of neonatal rats after hypoxia-ischemia brain damage
YinJie1,ChenRong2,XiaoDongfan1.
1.GuizhouMedicalUniversity,Guiyang550004,China. 2.DepartmentofNeonatal,People'sHospitalofGuizhouProvince,Guiyang550002,China.
Objective To explore the expression and significance of matrix metalloproteinase-2 (MMP-2) in hypoxia-ischemia injury with infant rats. Methods 42 neonatal SD rats of 7 days old were randomly divided into sham operation group and hypoxia-ischemia brain damage model group, the latter group was further divided into six subgroups based on different time points following HIBD ( 6 h, 12 h, 24 h, 48 h, 3 d, 7 d) (n=6 in each group), the expression of MMP-2 was determined by immunohistochemical method. Results The expression of MMP-2 protein increased gradually after HIBD and showed a slow growth trend in 24 h group to 3 d group, and reached the peak at 7 d. Compared with the sham group, there was statistical significantly differences (P<0.05) in the MMP2 expression in 24 h,48 h, 3 d,7 d groups. Conclusion The expression of MMP-2 have changed differently at various level after HIBD which may be participated the development process of HIBD, and MMP-2 may also be involved in the repair of brain injury.
Matrix metalleproteinase-2; Hypoxia-ischemia brain damage; Neonatal rats; Hippocampus
贵州省科学技术基金资助项目[黔科合J字(2008)2308号]
R722.19
A
1002-6975(2016)04-0348-03
2015-09-21)
△通信作者,E-mail:chenr9999@yahoo.com.cn
