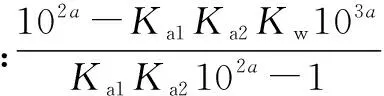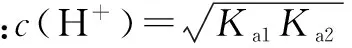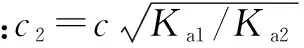由一道奥赛题引出的有关草酸氢钠溶液离子浓度的思考
2017-01-09郭子锐
由一道奥赛题引出的有关草酸氢钠溶液离子浓度的思考
湖北省武汉外国语学校(430022) 郭子锐●
在2015年湖南省化学竞赛(A卷)中,选择题第九题如下:草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液的增加,溶液中粒子浓度关系正确的是( ).
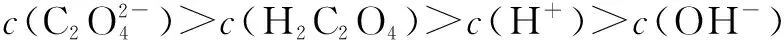
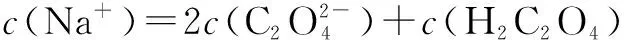
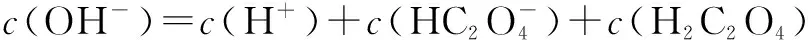

该题的标准答案是BD两项,A项未被选中.
笔者经过探究之后对此存疑,根据笔者所进行的定量计算,A项应为正确答案,推演过程如下:
草酸的一级二级电离常数是很容易查到的,可以从此入手来探究该问题.
设NaHA溶液,设二元弱酸H2A的一级电离常数Ka1,二级电离常数Ka2,水的电离常数为Kw.
溶液中存在以下平衡:

这实际上是A2-的水解方程式
当c(HA-)>K1=Kw/Ka2时,有c(A2-)>c(OH-)
c(OH-)与c(H+)的大小关系,直接比较HA-的水解与电离常数大小即可,这里不赘述.
c(H+)与c(A2-)的关系,推导过程要复杂许多:
设c(HA-)=c,c(H+)=c1,c(A2-)=c2,c(OH-)=c3,c(H2A)=c4。由HA-的电离、水解平衡和水的电离平衡分别可得以下三个式子:
c1c2=cKa2①c3c4=cKw/Ka1②c1c3=Kw③
由质子守恒有:c1+c4=c2+c3,即c4=c2+c3-c1④
代入②式,得c3(c2+c3-c1)=cKw/Ka2
⑤
⑥
⑦
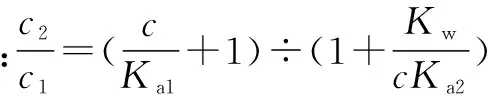
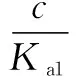
以上,笔者得出了比较这类二元弱酸盐溶液中离子浓度的方法.现在用它来解决问题:草酸的一二级电离常数分别是Ka1=5.4×10-2,Ka2=5.4×10-5.比较氢离子和草酸根的关系,知公式左边为1×10-4(暂且忽略草酸氢根的水解与电离),右边为1×10-11,左边明显大于右边,即氢离子浓度小于草酸根,由题目条件知氢离子浓度大于氢氧根浓度,再由质子守衡得A项正确.
当然,此处忽略草酸根的水解与电离会造成误差.
题目中有些时候没有给出溶液的浓度,而是给出pH.如果只知道溶液的pH而不知道浓度又该如何计算呢?现也给出以下方法:设A2-浓度为c1,H2A浓度为c2,溶液pH为a,其它字母同上.易得H+浓度为10-a,OH-浓度为Kw·10a.知有H2A2H++A2-K=Ka1Ka2,故有=c2
①
又由质子守恒:c1+Kw·10a=c2+10-a
②
③
将其除以Kw·10a以比较c1与氢氧根浓度大小关系,
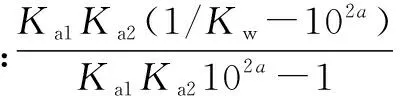
④
这里笔者想提一下正负号的问题,由①式得c1/c2=Ka1Ka2102a,所以当④式分母大于零时,有c2 ⑤ 现比较⑤式与零的大小关系.分母在溶液呈酸性时为正而碱性时为负,分子则需要计算,可以通过比较Ka1Ka2Kw104a与1的大小关系得. 可以看到这两种算法似乎都有些繁琐,且都可能遇到难以计算的误差问题.既然如此,可以做一点近似工作,看看能否使计算变得简便. 这种计算方法对于高中生而言似乎更加实用且简便,考虑到Ka1、Ka2、KW在一般情况下的数量级,这种方法得出的结论从一个侧面指出,在浓度不特别小时,A2-的浓度比氢氧根和氢离子大得多. 由此可见,利用高中范围内所学的质子守恒、平衡常数等知识,完全可以定量的算出溶液中各微量离子浓度间的大小关系,这样得到的关系较传统的定性分析更为严谨. G632 B 1008-0333(2016)34-0080-01