基于超声波诱导孢子萌发与糖化酶活力表征移种策略高效合成柠檬酸
2017-01-09王宝石陈坚孙福新庞海强李由然张梁丁重阳顾正华石贵阳
王宝石, 陈坚,2, 孙福新, 庞海强, 李由然, 张梁, 丁重阳, 顾正华, 石贵阳*
1(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡, 214122)2(江南大学,工业生物技术教育部重点实验室,江苏 无锡, 214122)3(江苏国信协联能源有限公司,江苏 宜兴,214200) 4(山东省费县检验检测中心,山东 费县,273400)
基于超声波诱导孢子萌发与糖化酶活力表征移种策略高效合成柠檬酸
王宝石1, 陈坚1,2, 孙福新3, 庞海强4, 李由然1, 张梁1, 丁重阳1, 顾正华1, 石贵阳1*
1(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡, 214122)2(江南大学,工业生物技术教育部重点实验室,江苏 无锡, 214122)3(江苏国信协联能源有限公司,江苏 宜兴,214200) 4(山东省费县检验检测中心,山东 费县,273400)
柠檬酸作为最成熟的平台化合物,近年来在新型行业的应用需求呈现出逐渐增长的趋势,实现其高效生产具有重要的现实意义。针对柠檬酸传统发酵方式中存在的种子培养前期延滞期长与发酵菌种活力波动大的缺陷,采用超声波预处理黑曲霉孢子120 s,诱发孢子级联反应而活化孢子,提高种子活力,缩短种子培养时间1.5 h,发酵效率提升8.13%;发酵罐水平系统研究种子整个生命周期中的关键指标变化规律,发现自身分泌的糖化酶能够直观反映细胞活力,以此为移种标准,契合柠檬酸同步糖化发酵的特点。集成超声波诱导孢子萌发与糖化酶活力表征移种的策略,获得高活力发酵菌种,总发酵时间缩短7.9 h,发酵产率提升11.76%,实现了柠檬酸高效合成。研究结果同时对于丝状真菌或类似微生物为主体的发酵过程具有良好借鉴意义。
超声波诱导;黑曲霉孢子;同步糖化发酵;柠檬酸;糖化酶
柠檬酸(citric acid)又名枸橼酸,是一种重要的、多功能的有机酸,广泛应用于食品、医药,化工等领域[1-3];同时柠檬酸是最成熟的平台化合物,伴随着生物聚合、药物运输、 细胞培养等新兴产业领域的广泛应用[4-5],现每年以5%的速度增长,是世界第二大发酵产品,产量仅次于酒精[6];因而,柠檬酸的发酵生产一直是学者关注的热点[7-8]。
黑曲霉由于酶系丰富,发酵效率高、副产物少等优势,是柠檬酸生产最重要的发酵菌种[9-10]。发酵法生产柠檬酸研究方向主要集中在廉价原料开发[11-13],发酵过程菌丝体形态控制[14-16],新型发酵模式探索[2, 12, 17]等方面,而关于发酵罐中黑曲霉整个生命周期中生长规律及高活力种子培养方法却鲜有报道[15]。黑曲霉属产孢微生物,孢子萌发是丝状真菌整个生命周期的关键步骤[18],是启动发酵过程的重要元件[19],它会显著影响种子生长与活力[20-22];孢子萌发过程包括孢子活化与肿胀发芽两个阶段,它是对变换环境条件的生理性应答[23]。在种子培养过程的前期,孢子萌发需要较长的延滞期,从而延长了种子培养时间,尤其是在工业化生产中,增加了发酵设备运行时间,提高了运行成本。成熟种子转接时机也是影响发酵的重要因素,而在现有发酵过程中,移种时机选择多带有经验性,往往依据摇瓶培养优化的参数,仍然以种龄作为移种时机的关键指标[24-25];种子培养过程的动态性与复杂性引起的发酵菌种活力波动大而难以满足实际生产需求,往往会引起发酵过程波动,进而影响发酵效率。如何缩短孢子萌发时间,培养高活力的种子,选择合适移种时机对于提高柠檬酸发酵效率至关重要。
本研究基于丝状真菌孢子萌发的生理性特点,提出超声波激活孢子,诱发孢子萌发级联反应,缩短种子培养周期,提高种子活力;在发酵罐中培养黑曲霉种子,系统研究黑曲霉整个生命周期中的特征生理参数变化规律,同时基于柠檬酸淀粉质粗料发酵模式与同步糖化发酵(simultaneous saccharification and fermentation,SSF)的特点,提出以种子糖化酶活力表征的移种策略。组合超声波预处理诱导孢子快速萌发培养种子与种子糖化酶活力表征的移种策略,缩短种子培养时间,提高了种子活力,实现柠檬酸的高效合成。
1 材料与方法
1.1 菌种与培养基
1.1.1 菌种
黑曲霉H 915(Aspergillusniger,柠檬酸生产菌株)。
1.1.2 培养基
斜面培养基:PDA培养基。
玉米粉液化过程:玉米粉与水按照1∶3质量比混合均匀,调节pH至5.8~6.0,添加耐高温α-淀粉酶30 U/g玉米粉,90 ℃保温,并不断搅拌均匀,至碘试合格为止,得玉米液化混液;液化混液经布氏漏斗抽滤,得液化清液。
种子培养基:玉米液化混液,添加硫酸铵与水按照一定的比例混合,调节总糖11%~12%,总氮0.23%~0.25%。
发酵培养基:玉米液化清液、玉米液化混液与水按照一定的比例混合,调节总糖16%~16.5%,总氮0.08%~0.09%。
1.2 仪器与设备
高转速摇床,江苏太仓市强乐实验设备有限公司;恒温培养箱,上海跃进医疗器械厂;紫外及可见光分光光度计UV2450,日本Shimazu公司;高效液相色谱系统及工作站,美国戴安公司;台式高速离心机,德国Eppendorf公司;24-L发酵罐,江南大学自动化研究所与浙江新昌德力石化设备有限公司联合研制;凯式定氮仪+凯式消化炉UDK159,意大利VELP。
1.3 培养方法
菌种活化及保存:将保藏的黑曲霉孢子转接至茄子瓶,37 ℃恒温培养箱倒置培养7 d,置于4 ℃冰箱中保存,备用。
孢子悬液制备:用无菌水洗下孢子,用玻璃珠打撒孢子,用血球计数板计数。
超声波预处理孢子:将制备的浓度为4×105个/mL黑曲霉孢子悬液置于超声波清洗仪中超声处理120 s,立即接种种子培养基。
摇瓶发酵培养:250 mL摇瓶,装液量40 mL,培养温度37 ℃,摇床转速320 r/min,培养72 h结束发酵检测。
24L发酵罐种子培养:黑曲霉孢子悬液以浓度4×105个/mL接种,装液量18 L,培养温度37 ℃,转速与DO偶联将DO控制在40%。
24L发酵罐发酵培养:成熟种子液接种量10%(v/v),装液量18 L,培养温度37 ℃,转速与DO偶联将DO控制在50%。
1.4 检测方法
发酵液离心(10 000×g,4 ℃,10 min),发酵液上清用于检测残总糖、残还原糖、糖化酶活力与柠檬酸,菌丝球用去离子水清洗3遍,105 ℃烘至恒重,测定生物量。残总糖与还原糖采用菲林法测定;糖化酶活力采用GB 8276—2006;柠檬酸含量采用HPLC测定(Shodex SUGAR SH1011柱子 (6 μm×300 mm×8 mm),紫外检测,210 nm,0.005 mol/L稀硫酸),重复3次实验。
2 结果与分析
2.1 超声波预处理孢子对种子生长与柠檬酸产量的影响
表1可以看出,策略A溶解氧开始下降时间为9±0.3 h,急剧下降时间为12±0.6 h;策略B溶解氧开始下降时间为7.5±0.3 h,急剧下降时间为10.5±0.5 h。孢子经超声波处理后,DO开始下降与急剧下降时间分别缩短了16.7%,12.5%,缩短了种子前期较长的延滞期,从而缩短种子培养时间,同时提升了最大菌体量,这可能是由于孢子经超声波处理后,激活孢子受体,启动孢子系列反应[18,26]。为了评估超声波预处理培养的种子对柠檬酸产量的影响,将培养的种子液以10%(v/v)接种量分别接种到24 L发酵罐进行发酵实验,结果如表1所示。从表1可以看出,孢子经预处理后,柠檬酸产量增加,残总糖降低;发酵周期缩短4 h,柠檬酸产率分别提高了8.13%。同时,发酵总时间(包括种子培养时间与发酵时间)缩短了5.5 h,提高了柠檬酸发酵效率。表明孢子经过超声波预处理不仅缩短了种子培养时间,同时提高了发酵种子活力。

表1 黑曲霉孢子超声波预处理对种子生长和柠檬酸发酵的影响
模式A:直接接种孢子为对照组;模式B:孢子超声波预处理120 s为实验组。
2.2 发酵罐培养的黑曲霉种子生理特性及生长动力学
黑曲霉孢子悬液以浓度4×105个/mL接种至24 L发酵罐,系统考察种子整个生命周期中生理参数变化规律,结果如图1所示。图1可以看出,0~8 h,总糖与还原糖含量基本不变,此阶段孢子处于休眠调整期,逐渐吸水膨胀,为孢子萌发作充分准备;8 h开始孢子逐渐萌发,此阶段因自身未分泌糖化酶不能生成还原糖,还原糖含量开始明显下降;12 h开始,孢子已完全萌发并逐渐生长形成菌丝,总糖含量开始急剧下降,伴随自身分泌的糖化酶活力增加,还原糖含量开始上升。糖化酶活力呈现先升高后下降的趋势,在24 h时,糖化酶活力达到最高;还原糖含量也呈现类似的变化趋势,24 h开始,还原糖生成速度远低于消耗速度,还原糖含量直线下降。从柠檬酸产物变化曲线可以看出,16 h开始,柠檬酸产量明显增加,呈直线上升趋势,28 h柠檬酸合成速率放缓;pH变化曲线看出,培养8 h开始,培养液pH急剧下降,16 h 开始,培养液pH下降变化平稳。
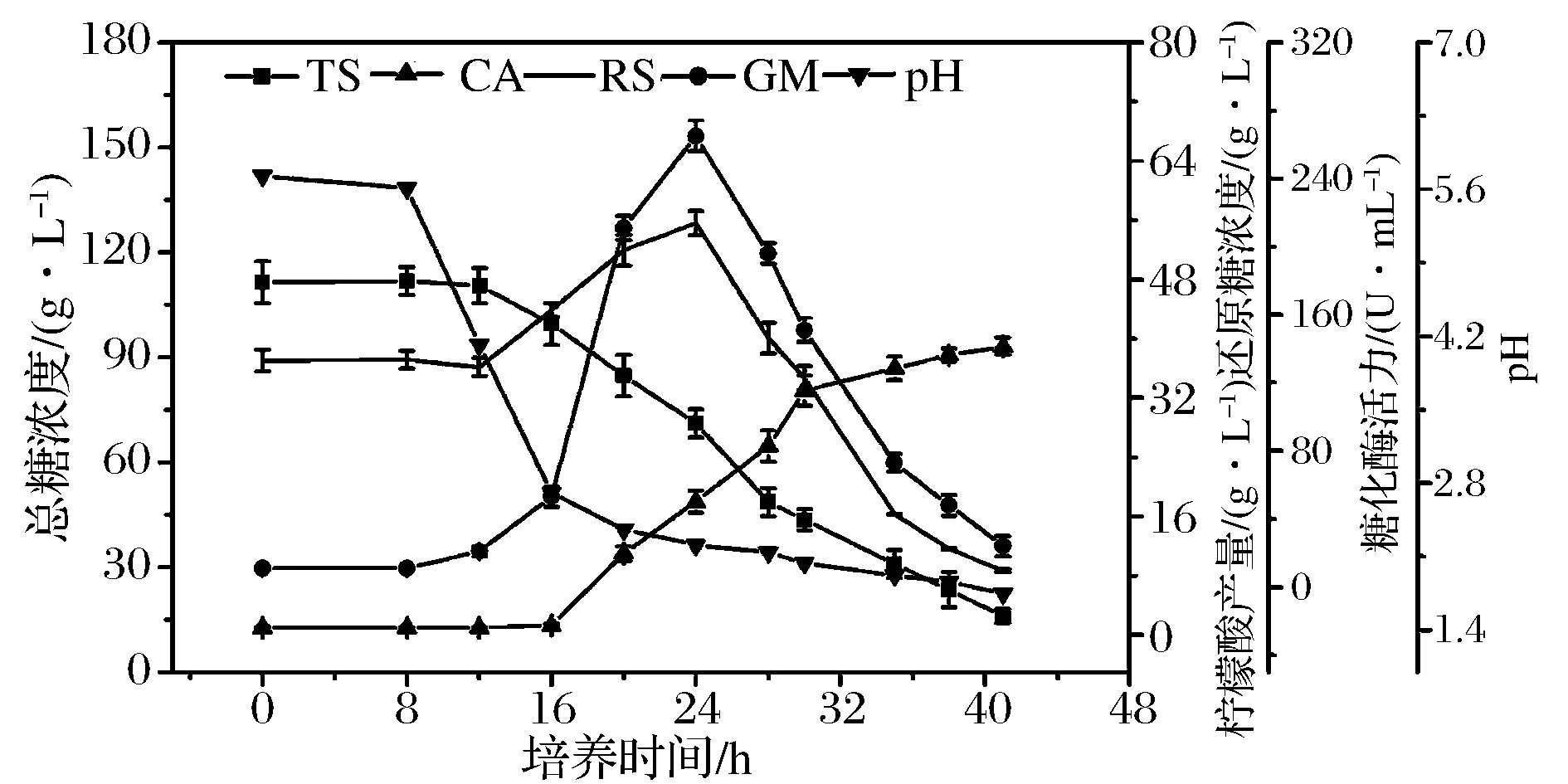
TS-总糖;RS-还原糖;CA-柠檬酸;GM-糖化酶图1 发酵罐培养的黑曲霉种子生理特性Fig.1 Physiological properties of the seed of Aspergillus niger cultured in the fermenter
柠檬酸发酵过程属于淀粉质原料粗料发酵,淀粉质原料经液化后利用黑曲霉自身分泌的糖化能力进行同步糖化发酵。基于同步糖化发酵的工艺特点,发酵过程中葡萄糖生成速度会显著影响发酵效率的提升,黑曲霉糖化酶活力会直接影响葡萄糖供给速率[27-28];因此,转接发酵时,种子糖化酶活力会显著影响发酵过程。种子糖化酶活力及生长动力学变化规律如图2所示,总糖消耗速率与柠檬酸合成速率均呈现先升高后下降的趋势,糖化酶活力呈现类似的趋势;糖化酶活力可以直观反映种子活力,因此,可以选择糖化酶活力作为移种的特征指标。
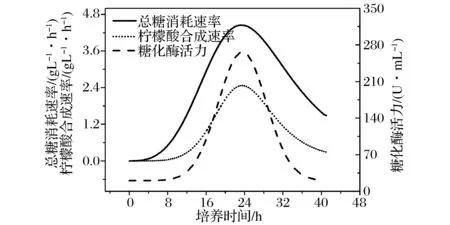
图2 发酵罐培养的黑曲霉种子生长动力学Fig.2 Growth kinetics of the seed of Aspergillus niger cultured in the fermenter
2.3 基于黑曲霉种子糖化酶活力移种的柠檬酸发酵
通过对发酵罐培养的黑曲霉种子生理特性与生长动力学参数考察,黑曲霉自身分泌的糖化酶活力能够直观反映种子活力,契合柠檬酸同步糖化发酵的特征,为考察以糖化酶活力为移种标准的发酵过程,将发酵培养过程中不同糖化酶活力的种子转接摇瓶发酵培养,发酵结果如图3所示。随着接入种子糖化酶活力的增加,柠檬酸产量明显增加,发酵残总糖明显降低;在酶活力最高时转接发酵(酶活力270 U/mL),柠檬酸产量最高,发酵残糖最低。以上研究结果表明,种子较高的糖化酶活力,能够较好地协同柠檬酸同步糖化发酵过程,因而可以选择糖化酶活力作为移种的特征指标。
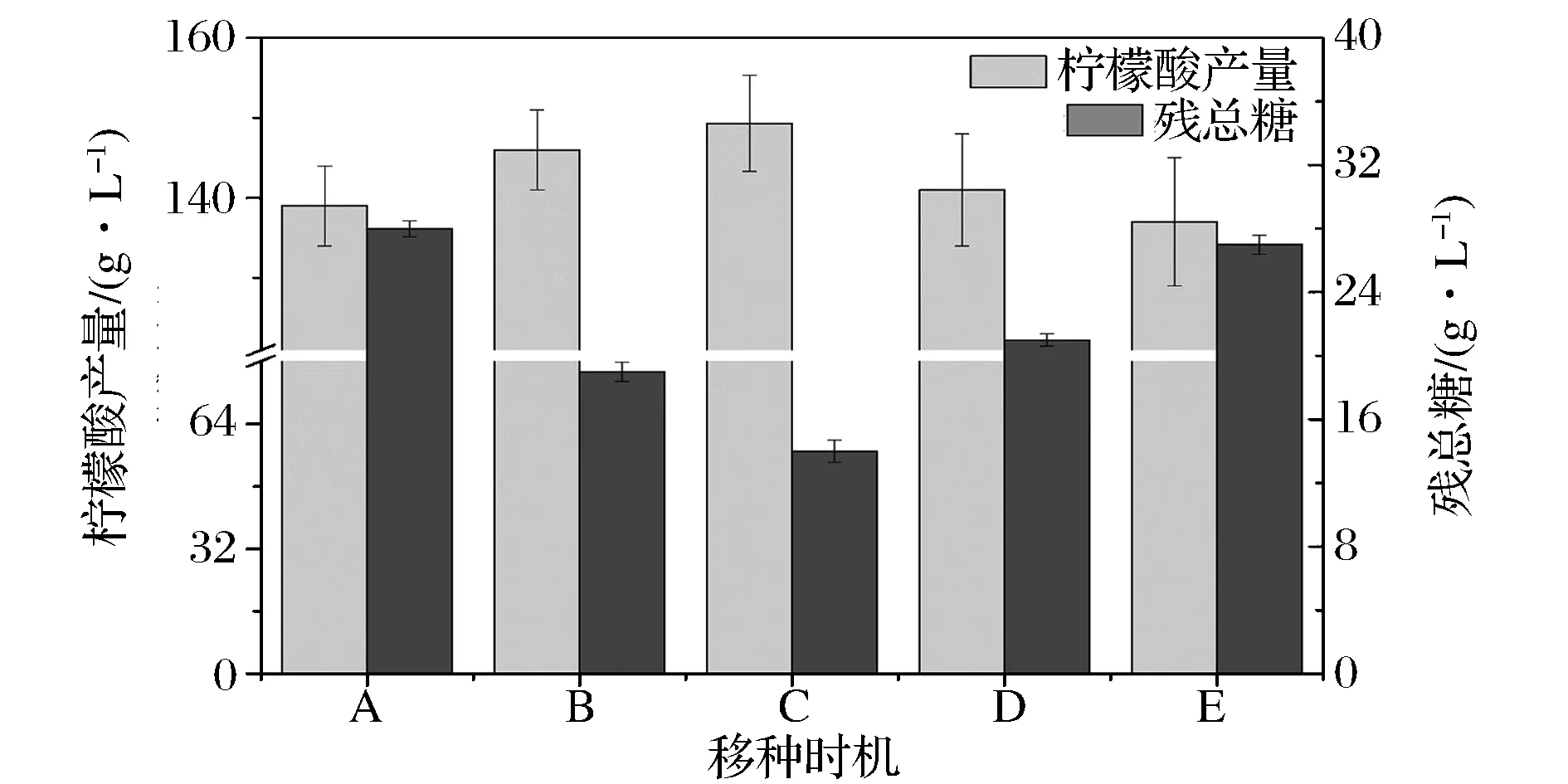
A-种龄20 h,酶活210 U/mL; B-种龄22 h,酶活240 U/mL; C-种龄24 h,酶活270 U/mL; D-种龄26 h,酶活229 U/mL; E-种龄28 h,酶活196 U/mL图3 不同糖化酶活力移种的柠檬酸发酵Fig.3 Citric acid fermentation based on the glucoamylase activity of the seed of Aspergillus niger
2.4 基于孢子超声波预处理与糖化酶活力移种的柠檬酸发酵
在微生物发酵过程中,发酵菌种质量是决定发酵成败的关键,选择合适的移种时机有助于提高发酵效率。超声波预处理孢子,可以激活了孢子受体,启动孢子系列反应,缩短孢子萌发时间,提高种子活力。黑曲霉种子生长过程中,自身能够分泌糖化酶,选择高活力的糖化酶种子转接发酵,能够协同柠檬酸同步糖化发酵,提高发酵效率。超声波预处理孢子120 s培养种子,与糖化酶活力最高时移种方式为实验组,以孢子直接接种培养种子,与传统种龄移种方式为对照组,结果如图4与表2所示。图4可以看出,实验组比对照组需要更短调整期,柠檬酸产量呈直线上升的趋势(图4-a),实验组的柠檬酸合成速率明显高于对照组(图4-d);发酵残总糖浓度直线下降的趋势,实验组消耗速率高于对照组(图4-b);发酵还原糖浓度呈现先增加后下降的趋势,实验组下降趋势明显快于对照组(图4-c)。研究结果表明,孢子经过超声波预处理后,缩短种子培养周期,培养的种子活力更高;糖化酶活力最高时转接发酵,缩短产酸调整期,保障葡萄糖供给速率,协同柠檬酸发酵过程,提高发酵效率。发酵过程参数如表2所示,发酵周期缩短6 h,柠檬酸体积产率由2.55±0.09 g/L提高到2.85±0.17 g/L,提高11.76%,总发酵周期(移种时机与发酵周期)缩短7.9 h。以上研究结果表明,组合孢子预处理培养种子与糖化酶活力表征的移种策略,能够协同柠檬酸同步糖化发酵过程,显著提高了发酵效率。
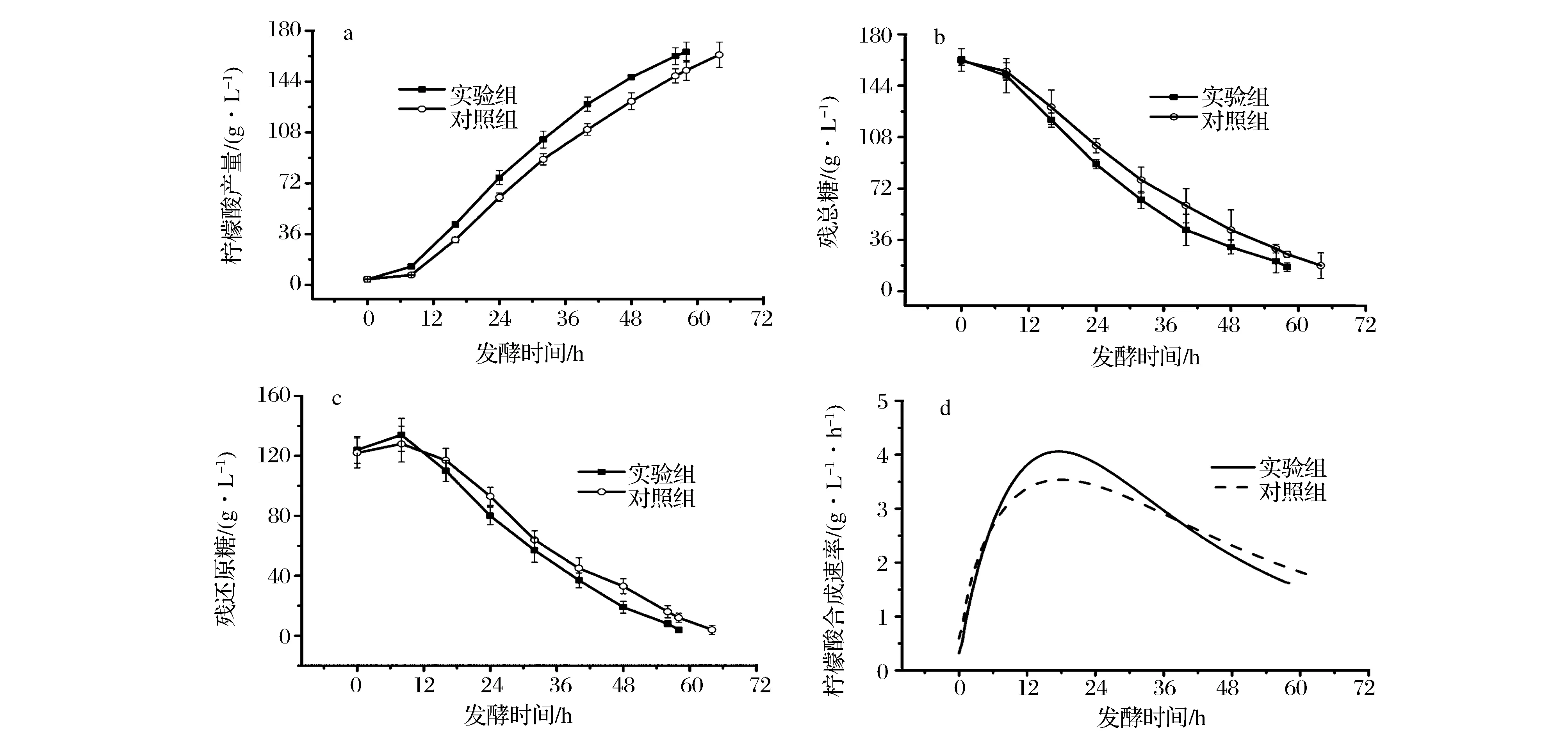
图4 两种模式下的柠檬酸发酵中柠檬酸产量(a),残总糖(b),残还原糖(c)与柠檬酸合成速率(d)Fig.4 Citric acid (a), residual total sugar (b), residual reducing sugar (c), and citric acid production (d) in the two fermentation modes

培养模式种子移种时机/h发酵周期/h柠檬酸产量/(g·L-1)残总糖/(g·L-1)体积产率/[g·(L·h)-1]总发酵时间/h对照组254±0264±18163±1818±12255±009894±01实验组235±0858±23165±3617±13285±017815±01
注:对照组为孢子直接接种培养与传统种龄移种方式;实验组为孢子超声波预处理120 s培养与糖化酶活力移种方式。
3 结论
微生物发酵过程中,高质量种子是决定发酵成败的关键因素。基于黑曲霉孢子萌发的生理特性,提出超声波预处理孢子120 s,诱导孢子快速萌发,缩短种子培养时间,提高种子活力,发酵产率提高8.13%。在发酵罐水平培养种子,系统研究其整个生命过程中生理学特性及生长动力学参数,发现自身分泌糖化酶并能直观反映细胞活力,契合柠檬酸同步糖化发酵的特点,可以作为移种的特征指标。基于超声波诱导孢子萌发与糖化酶活力表征的移种策略,移种后的菌种活力显著提升,产酸调整期缩短,发酵产率提升11.76%,总发酵时间缩短7.9 h,显著提高了发酵效率。
[1] DHILLON G S, BRAR S K, VERMA M, et al. Utilization of different agro-industrial wastes for sustainable bioproduction of citric acid byAspergillusniger[J]. Biochemical Engineering Journal, 2011,54 (2): 83-92.
[2] DHILLON G S, BRAR S K, KAUR S, et al. Bioproduction and extraction optimization of citric acid fromAspergillusnigerby rotating drum type solid-state bioreactor[J]. Industrial Crops and Products, 2013, 41: 78-84.
[3] BETIKU E, ADESINA O A. Statistical approach to the optimization of citric acid production using filamentous fungusAspergillusnigergrown on sweet potato starch hydrolyzate[J]. Biomass and Bioenergy, 2013, 55: 350-354.
[4] SINGH DHILLON G, KAUR BRAR S, VERMA M, et al. Recent advances in citric acid bio-production and recovery[J]. Food and Bioprocess Technology, 2011, 4(4): 505-529.
[5] ANASTASSIADIS S, MORGUNOV I G, KAMZOLOVA S V, et al. Citric acid production patent review[J]. Recent Patents on Biotechnology, 2008, 2(2): 107-123.
[6] KHURSHID S, ALI S, ASHRAF H, et al. Mutation ofAspergillusnigerfor hyperproduction of citric acid from black strap molasses[J]. World Journal of Microbiology and Biotechnology, 2001, 17(1): 35-37.
[8] WEYDA I, LÜbeck M, AHRING B K, et al. Point mutation of the xylose reductase (XR) gene reduces xylitol accumulation and increases citric acid production inAspergilluscarbonarius[J]. Journal of Industrial Microbiology & Biotechnology, 2014, 41(4): 733-739.
[9] CARLOS L P S V, SOCCOL R, CRISTINE RODRIGUES, et al. New perspectives for citric acid production and application[J]. Food Technology Biotechnology, 2006, 44(2): 141-149.
[10] THOMPSON J C, HE B B. Characterization of crude glycerol from biodiesel production from multiple feedstocks[J]. Applied Engineering in Agriculture, 2006, 22(2): 261-265.
[11] LIU X Y, LV J S, XU J X, et al. Citric acid production in yarrowia lipolytica SWJ-1b yeast when grown on waste cooking oil[J]. Applied Biochemistry and Biotechnology, 2015, 175 (5): 2 347-2 356.
[12] MOSTAFA Y S, ALAMRI S A. Optimization of date syrup for enhancement of the production of citric acid using immobilized cells ofAspergillusniger[J]. Saudi Journal of Biological Sciences, 2012, 19(2): 241-246.
[13] KARTHIKEYAN A, SIVAKUMAR N. Citric acid production by Koji fermentation using banana peel as a novel substrate[J]. Bioresource Technology, 2010, 101(14): 5 552-5 556.
[14] IKRAM-UL-HAQ, ALI S, QADEER M A, et al. Control ofAspergillusnigermorphology to enhance citric acid production under liquid culture[J]. Pakistan Journal of Botany, 2003, 35(4): 533-539.
[15] PAPAGIANNI M, MATTEY M. Morphological development ofAspergillusnigerin submerged citric acid fermentation as a function of the spore inoculum level. Application of neural network and cluster analysis for characterization of mycelial morphology[J]. Microbial Cell Factories, 2006, 5(1): 1-12.
[16] PAPAGIANNI M, MATTEY M, KRISTIANSEN B. Hyphal vacuolation and fragmentation in batch and fed-batch culture ofAspergillusnigerand its relation to citric acid production[J]. Process Biochemistry, 1999, 35(3): 359-366.
[17] MOELLER L, GRÜNBERG M, ZEHNSDORF A, et al. Repeated fed-batch fermentation using biosensor online control for citric acid production byYarrowialipolytica[J]. Journal of Biotechnology, 2011, 153(3-4): 133-137.
[18] GOUGOULI M, KOUTSOUMANIS K P. Modeling germination of fungal spores at constant and fluctuating temperature conditions[J]. International Journal of Food Microbiology, 2012, 152(3): 153-171.
[19] BIZUKOJC M, LEDAKOWICZ S. A kinetic model to predict biomass content forAspergillusnigergerminating spores in the submerged culture[J]. Process Biochemistry, 2006, 41(5): 1 063-1 071.
[20] OSHEROV N, MAY G S. The molecular mechanisms of conidial germination[J]. FEMS Microbiology Letters, 2001, 199(2): 153-160.
[21] PAUL G C, KENT C A, THOMAS C R. Viability testing and characterization of germination of fungal spores by automatic image analysis[J]. Biotechnology and Bioengineering, 1993, 42(1): 11-23.
[22] SVANSTRÖM Å, MELIN P. Intracellular trehalase activity is required for development, germination and heat-stress resistance ofAspergillusnigerconidia[J]. Research in Microbiology, 2013, 164(2): 91-99.
[23] DANTIGNY P, BENSOUSSAN M, VASSEUR V, et al. Standardisation of methods for assessing mould germination: A workshop report[J]. International Journal of Food Microbiology, 2006, 108 (2): 286-291.
[24] 邵帅,戴军,杜馨,等.降解黄曲霉毒素B1菌株的发酵条件优化及降解机制[J].食品科学,2016, 37(5): 138-143.
[25] 赵人俊,严虹,郑幼霞.影响被孢霉产生含γ-亚麻酸油脂的几种因素[J].生物工程学报,1995, 11(4): 361-365.
[26] SETLOW P. Spore germination[J]. Current Opinion in Microbiology, 2003, 6(6): 550-556.
[27] SZYMANOWSKA-POWAOWSKA D, LEWANDOWICZ G, KUBIAK P, et al. Stability of the process of simultaneous saccharification and fermentation of corn flour. The effect of structural changes of starch by stillage recycling and scaling up of the process[J]. Fuel, 2014, 119: 328-334.
High efficient production of citric acid integrated strategies of the ultrasonic pretreated the spores and glucoamylase representing seed-transferring
WANG Bao-shi1, CHEN Jian1,2, SUN Fu-xin3, PANG Hai-qiang4, LI You-ran1,ZHANG Liang1, DING Zhong-yang1, GU Zheng-hua1, SHI Gui-yang1*
1 (National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China) 2 (Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China) 3 (Jiangsu Guoxin Union Energy Co., Ltd., Yixing 214203, China) 4 (Shandong Feixian Inspection and Detection Center, Feixian 273400, China)
As the most mature platform-compound, the demand for citric acid is increasing due to the application in emerging industry and important practical significance of high-efficient production possess. Given the defects of long-term lag phase in the early stage of the seed culture and instable strain activity, the spores were treated with ultrasonic wave for 120 s to induce the cascade reaction and activate the spores, thus the seed culture time shortened by 1.5 h and the fermentation efficiency was improved by 8.13%. Based on the regular changes of the key parameters in the whole life cycle of theAspergillusnigercultured in the fermenter, their own glucoamylase could directly reflect the cell viability and be presented as the seed-transferring index for simultaneous saccharification and fermentation. Pretreatment of spores with ultrasonic was combined with seed-transferring based on glucoamylase activity to obtain high activity seed and high-efficient synthesis of citric acid, thus total fermentation time shortened by 7.9 h and fermentation efficiency was improved by 11.76%. These results were also meaningful for the fermentation processes with the filamentous fungi or similar microbiology as main fermentative strain.
ultrasonic induction;Aspergillusnigerspores; simultaneous saccharification and fermentation; citric acid; glucoamylase
10.13995/j.cnki.11-1802/ts.201612001
博士研究生(石贵阳教授为通讯作者,E-mail: gyshi@jiangnan.edu.cn)。
国家高技术研究发展计划(863计划,No: 2015AA020302);江苏省产学研前瞻性联合研究项目 (No. BY2015019-13)
2016-04-13,改回日期:2016-05-06
