大孔吸附树脂对蜂蜜中拟除虫菊酯脱除的热力学性质研究
2017-01-09刘清清阎怡竹杨海霞程妮曹炜邓建军
刘清清,阎怡竹,杨海霞,程妮,曹炜,邓建军*
1(西北大学,食品科学与工程系,陕西 西安,710069) 2(西安交通大学 医学部公共卫生学院,陕西 西安,710069)
大孔吸附树脂对蜂蜜中拟除虫菊酯脱除的热力学性质研究
刘清清1,阎怡竹1,杨海霞2,程妮1,曹炜1,邓建军1*
1(西北大学,食品科学与工程系,陕西 西安,710069) 2(西安交通大学 医学部公共卫生学院,陕西 西安,710069)
在蜂蜜的采集过程中,蜜源植物中残留的农药容易被带入到蜂蜜中,对蜂蜜的质量安全带来潜在危害。树脂吸附是成熟的食品脱除农药和抗生素残留的有效技术。文中采用静态吸附法比较了3种大孔吸附树脂(LS-803,LS-901和LS-903)对蜂蜜中拟除虫菊酯的脱除效果,结果表明LS-903对拟除虫菊酯的脱除效果最好。同时,着重研究了LS-903树脂对拟除虫菊酯的脱除热力学行为,结果表明,不同温度(25、35、45 ℃)范围内,LS-903树脂对蜂蜜中拟除虫菊酯的吸附等温线均符合Freundlich模型和Langmuir模型,该吸附是一个自发的、吸热的、熵增加的物理吸附过程(ΔH>0,ΔG<0和ΔS>0)。
拟除虫菊酯;蜂蜜;大孔吸附树脂;脱除;热力学
蜂蜜是蜜蜂从植物花蜜中采得经自身酿制而成的天然活性物质,其活性成分达180多种,主要成分中总糖约75%、水分16%~25%、蛋白质约0.16%,此外,还含有维生素、有机酸、酵素、色素、芳香物质、多种酶类、矿物质微量元素等,具有极高的营养价值,颇受广大消费者喜爱[1]。研究表明,蜂蜜在抗炎、护肝、胃病、贫血、润肠抗菌、提高免疫力以及抗癌等方面具有较强的生物活性[2-3]。然而,在蜜蜂养殖和蜂蜜采集过程中由于对抗生素、农药等药品的不合理使用,导致蜂产品中这些有毒有害物质超标,对蜂蜜及副产品的食用安全性造成危害,同时也影响了蜂产品相关的进出口贸易,造成了极大的经济损失。因此,通过合理的方法去除或降低蜂蜜中有毒有害物质,对于蜂蜜的安全消费和食用有一定的研究意义。
拟除虫菊酯是由天然除虫菊酯衍生而来的一类合成杀虫剂。其能防治多种害虫,是继有机磷、有机氯类农药成为使用最广泛的杀虫剂之一[4]。拟除虫菊酯具有高效、低残留、低毒、易于降解等特性[5],被广泛用于果蔬、花卉等农作物上的害虫控制中[6]。然而长期使用致使其在农作物中残留量超标。人体摄入拟除虫菊酯会导致中枢神经系统受损、精子质量和生殖激素异常以及内分泌紊乱[7]。由于蜜源植物的污染,拟除虫菊酯在蜂蜜中农残超标现象普遍存在[8]。有效脱除蜂蜜中拟除虫菊酯残留是亟待解决的关键之所在。传统脱除拟除虫菊酯的方法有液液萃取[9]、加速溶剂萃取[10]、固相萃取[11]、微波辅助萃取[12]和超声波提取。相比之下,大孔吸附树脂具有效率高、成本低、操作简单、再生处理方便等优点[13-14],已经广泛用于果汁的脱色及农药残留的脱除等领域,也有将该技术用于蜂蜜中羟甲基糠醛[15]、对硫磷[16]、毒死蜱[17]等农药残留的脱除或降低中,取得了明显的效果。使用大孔吸附树脂对蜂蜜中含醇类、醛类、酮类、酯类、酸类等挥发性芳香物质的影响有限,不易改变蜂蜜的味道和芳香,对蜂蜜营养成分损失较小,可将其中有害化学物含量降低到欧盟允许范围之内,用这种方法处理后的蜂蜜可以作为饲料添加剂或者生物质能源,甚至可以用作甜味剂再次应用于食品工业中,避免了对其直接销毁,可实现资源的再利用[18]。
本文以拟除虫菊酯为研究对象,采用静态吸附法研究大孔吸附树脂对蜂蜜中拟除虫菊酯的吸附行为及热力学性质。
1 材料与方法
1.1 材料与试剂
蜂蜜购于陕西老蜂农生物科技有限责任公司;拟除虫菊酯标准品(纯度>99.5%),购于国家标准物中心;乙腈、NaCl等常规药品均为国产分析纯试剂,购于天津天利化工试剂有限公司;大孔吸附树脂LS-803,LS-901和LS-903,购于西安蓝深特种树脂有限公司。
1.2 仪器与设备
安捷伦气相色谱仪(Agilent 6890N),带磷滤光片的FPD检测器,SHA-B恒温振荡器,东联电子技术开发有限公司;HH-2数显恒温水浴锅,国华电器有限公司;电子分析天平,北京赛多利斯天平有限公司;SN-D-2000超声波直插式处理仪器,广州市辛诺科超声设备有限公司。
1.3 实验方法
1.3.1 大孔吸附树脂的预处理
在使用前,大孔吸附树脂需进行预处理以除去树脂中含有残留的未聚合单体、致孔剂、分散剂和防腐剂等对人体有害的物质。参考JIA的方法[19]并略作修改。将树脂在体积分数95%乙醇中浸泡24 h后用蒸馏水洗至无醇味。然后分别用体积分数5% HCl和质量分数5% NaOH通过树脂柱浸泡2~4 h,每次浸泡前用蒸馏水洗至中性。
1.3.2 静态吸附实验
准确称取150 g解晶后的蜂蜜于400 mL烧杯中,加入300 mL蒸馏水稀释,然后加入一定量的拟除虫菊酯标准物质,置于40 ℃超声振荡10 min。将混合均匀的样液装入棕色瓶放入冰箱中备用。取出上述蜂蜜水加入蒸馏水并稀释10倍,将稀释过的蜂蜜水分为3组,每组7份,每份30 mL,分别置于50 mL 三角瓶中,分别加入LS-803、LS-901和 LS-903大孔吸附树脂各0、0.5、1.0、2.0、4.0、6.0和8.0 g,然后于25、35和45 ℃的恒温水浴摇床中静置吸附120 min,达到吸附平衡后,用1.3.4中方法测定蜂蜜样品中的拟除虫菊酯的含量,并依据式(1)计算平衡吸附量Qe及绘制吸附等温线:
(1)
式中:ρ0和ρe分别为蜂蜜中的拟除虫菊酯初始浓度和平衡浓度,mg/L;V是蜂蜜溶液的体积,mL;m是树脂的质量,g。
1.3.3 平衡时间与平衡吸附量的确定
从棕色瓶中取25 mL蜂蜜水加入到250 mL容量瓶中,加蒸馏水稀释10倍,准确称取LS-803、LS-901和LS-903树脂各0.15 g于250 mL锥形瓶中,然后加入稀释过的蜂蜜水,在25 ℃恒温水浴摇床中振荡吸附300 min,每间隔10 min取样5 mL,共取30个样,测定蜂蜜样品中的拟除虫菊酯的ρ0和ρe。采用式(1)和式(2) 计算平衡吸附量Qe和吸附率A:
(2)
1.3.4 拟除虫菊酯含量的测定
采用NY/T 761—2004检测方法。取振荡后的溶液20 mL于50 mL萃取瓶中,加入2 g NaCl,再加入30 mL乙腈,剧烈振荡2 min,静置分层,待有机相清晰分层,得到乙腈萃取液,取上层有机相1 mL于试管中,40 ℃下以氮气流吹至近干,加入5 mL丙酮溶解样品,混匀,用0.2 μm滤膜过滤后用于色谱测定。
色谱条件:DB-17弹性石英毛细管(30 m ×53.0 μm,1.0 μm)色谱柱;升温程序:初始温度150 ℃保持2 min,以15 ℃/min升至220 ℃保持2 min,以40 ℃/min升至260 ℃,保持10 min;FPD火焰光度检测器;进样口温度250 ℃;检测器温度250 ℃;载气为氦气(He);柱流量为1 mL/min;进样量为1 μL;不分流进样;定量:外标法定量。
1.3.5 数据分析
采用Origin V8.0软件(美国OriginLab公司)进行数据处理并作图。
2 结果与分析
2.1 树脂筛选
树脂经过长时间的充分吸附,其饱和吸附量与实际应用时的吸附量往往存在差别,实际应用中理想的树脂不仅要具有较快的吸附速率,还要具有较大的吸附量及较高的解吸率。因此,通过吸附动力学曲线来筛选出对蜂蜜中拟除虫菊酯脱除效果最佳的吸附树脂。3种树脂(LS-803,LS-901和LS-903)对蜂蜜中拟除虫菊酯的吸附动力学曲线如图1所示。
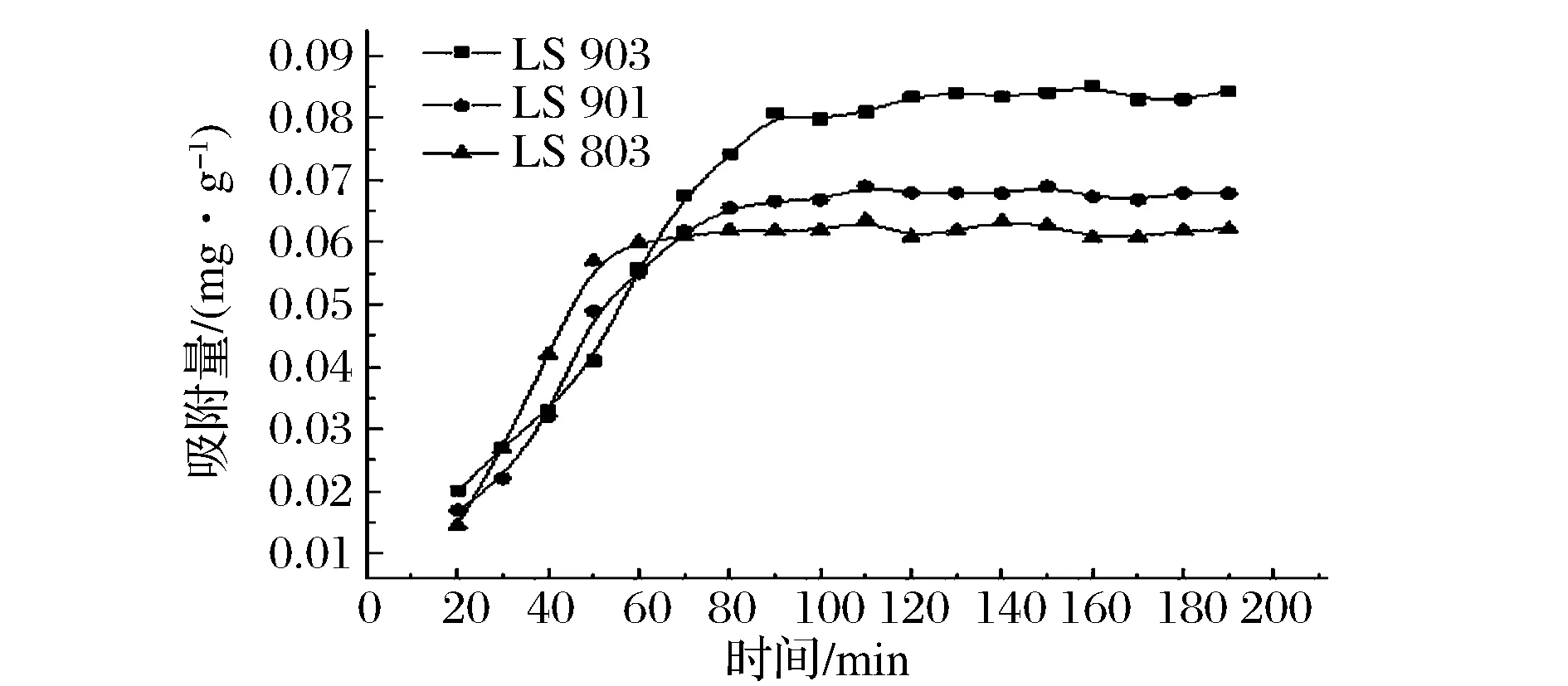
图1 3种树脂(LS-803,LS-901和LS-903) 对蜂蜜中拟除虫菊酯的吸附动力学曲线Fig.1 Adsorption kinetic curve of LS-803, LS-901 and LS-903 to pyrethroid, respectively
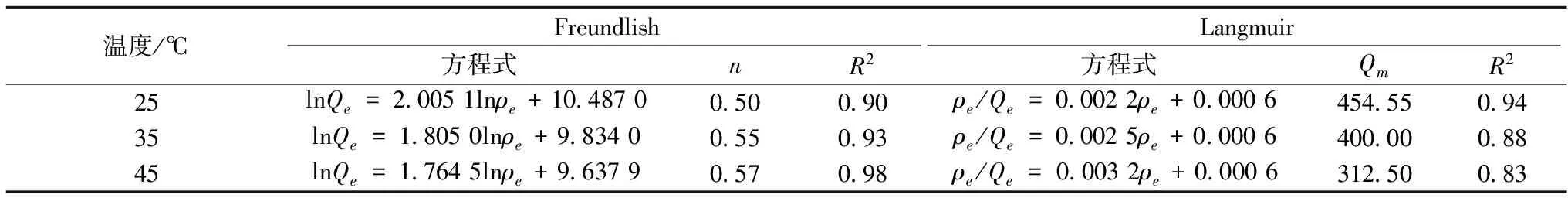
吸附初期(前40 min),3种树脂都能够被快速吸附拟除虫菊酯,吸附量和时间呈线性关系;随着吸附时间的延长,约60 min后3种树脂吸附速度降低最终趋于平衡;对于LS-903树脂而言,起始吸附量较高,但吸附速率低于LS-803树脂,在110 min时达到平衡,平衡吸附量为0.08 mg/g;而LS-803树脂和LS-901树脂,起始吸附量较低,但吸附速率较快,在50 min左右时可达到平衡,平衡吸附量分别为0.06 mg/g和0.065 mg/g,属于快速平衡型。产生这种现象的主要原因可能是在吸附剂表面作用力不强的情况下,在吸附过程中起关键作用的是比表面积且其吸附量随比表面积的增大而增大。LS-803 树脂的比表面积(1 200 m2/g)高于LS-903树脂的比表面积(700 m2/g),因此,起初LS-803树脂的吸附速度高于LS-903树脂,但之后随着活性吸附位点减少,使空置的表面位置难以占领,此时在吸附过程中起关键作用的是吸附剂表面作用力。根据吸附剂与吸附质之间的表面作用力考虑,LS-903属于极性树脂,而 LS-803属于非极性树脂,但拟除虫菊酯属于极性分子,因此,此时二者的极性是影响吸附率的主要原因[20-21]。以上结果表明,3种树脂对蜂蜜中拟除虫菊酯的吸附能力由小到大的顺序为:LS-803 2.2 静态吸附等温线 吸附等温线表示在一定的温度下达到吸附平衡时吸附剂和吸附质浓度之间的关系曲线,能够总括吸附量、吸附状态、吸附强度等吸附现象方面的特征,是评价吸附剂能否成为工业化生产的重要指标[22]。3种温度下(25、35、45 ℃),LS-903树脂对蜂蜜中拟除虫菊酯的吸附均为上凸曲线属于III型等温曲线,表示固体和吸附质的相互吸附作用小于吸附质之间的相互作用,即当平衡浓度低时,平衡吸附量随着平衡浓度的增大而缓慢上升,吸附量较少;当平衡浓度较高时,平衡吸附量随着平衡浓度的增大而快速上升,吸附量较多。 图2 LS-903树脂对蜂蜜中拟除虫菊酯的吸附等温线Fig.2 Adsorption isotherms of pyrethroid on LS-903 resin 2.3 静态吸附等温线模型的拟合 常见的吸附剂对固体中有关组分的吸收应用较广泛的等温吸附方程有2种 一是Freundlich方程: (3) 二是Langmuir方程: (4) 式中:Qe为平衡吸附量,g/g;ρe为平衡浓度,g/mL;Kf为Freundlich系数,L/g;n为表观常数;Qm为最大吸附量,g/g;K为吸附平衡常数,L/g。 利用Freundlich方程和Langmuir方程对不同温度下蜂蜜中拟除虫菊酯的吸附平衡数据进行拟合(表1)。由表1可知,蜂蜜中拟除虫菊酯在LS-903树脂上的吸附行为既符合Langmuir方程也符合 Freundlich方程。单从从R2看,Freundlich方程拟合的结果优于Langmuir方程。随着温度的升高,Kf值也不断升高,n值不断降低,表明温度越高,吸附效果越好,这是吸附剂和溶剂共同驱动作用的结果。另外,特征常数n小于1,表明树脂对拟除虫菊酯的吸附过程是非优惠吸附,即吸附质分子和固体吸附的分子间亲和力随浓度增加而增大的吸附过程。 表1 树脂LS-903 对蜂蜜中拟除虫菊酯吸附的 Freundlich 和 Langmuir 模型参数 2.4 吸附热力学性质 热力学参数自由能变ΔG、吸附焓变ΔH、墒变ΔS可由公式(5)、(6)、(7)计算,结果见表2。 lnρe=-lnK0+ΔH/RT (5) ΔG=-nRT (6) ΔG=ΔH-TΔS (7) 式中:R为气体常数,J/(mol·K);T为吸附的绝对温度,K;K0为常数,n为Freundlich方程中的常数。 由表2可知,蜂蜜中的拟除虫菊酯在LS-903树脂上的等量吸附焓变ΔH>0,表明LS-903树脂对拟除虫菊酯的吸附为吸热过程,其原因是LS-903树脂在蜂蜜溶液中吸附拟除虫菊酯时,原树脂上的水分子要被拟除虫菊酯置换下来,水分子的解析是需要吸热的,而吸附拟除虫菊酯时是放热的,由于拟除虫菊酯分子比水分子大,吸附每分子的拟除虫菊酯需要解析更多的水分子,最终导致吸附需要吸收热量;由于吸附热是区别物理吸附和化学吸附的重要标志,其中物理吸附为分子间力、放出热量小、焓变值一般小于42 kJ/mol[21],LS-903树脂对蜂蜜中拟除虫菊酯吸附的焓变为2.74 kJ/mol,说明该吸附为物理吸附过程。不同温度下,LS-903树脂对蜂蜜中拟除虫菊酯的吸附自由能变ΔG<0,说明该吸附是一个自发的过程,且ΔG值在-20~0 kJ/mol范围内说明是物理吸附[23],进一步说明LS-903型树脂对蜂蜜中拟除虫菊酯吸附的吸附为物理吸附,不会对蜂蜜的质量造成影响。此外,LS-903树脂对蜂蜜中拟除虫菊酯的吸附熵变ΔS>0,其原因可能是由于该吸附过程是溶质被吸附而引起溶剂脱附,溶剂脱附会导致体系熵变增加,而溶质被吸附使得体系熵变减小,整个过程的熵变是两者综合作用的结果。由于菊酯的吸附和水分子的解析是两个相反的熵变过程,对于吸附菊酯这样的分子将引起过多的水分子脱附,从而使总的熵变大于零。 表2 LS-903树脂吸附拟除虫菊酯的热力学参数 本研究结果表明,大孔吸附树脂是脱除蜂蜜中拟除虫菊酯的一种有效方法。所用3种树脂(LS-803,LS-901和LS-903)均可不同程度脱除拟除虫菊酯,LS-903树脂的吸附效率最优。不同温度下,LS-903树脂对蜂蜜中拟除虫菊酯的吸附动力学行为符合Freundlich方程和Langmuir方程模型,且该吸附过程为一个自发的、吸热的物理吸附过程,温度越高越有利于吸附。 [1] CZIPA N, ANDRASI D, KOVACS B. Determination of essential and toxic elements in Hungarian honeys[J]. Food Chemistry, 2015, 175(2):536-542. [2] BRUDZYNSKI K. Effect of hydrogen peroxide on antibacterial activities of Canadian honeys[J]. Canadian Journal of Microbiology, 2006, 52(12):1 228-1 237. [3] 谢文闻, 童越敏, 何微莉, 等. 蜂蜜保健和药理作用研究进展[J]. 中国食物与营养, 2012, 18(10):58-63. [4] HORTON M K, RUNDLE A, CAMANN D E, et al. Impact of prenatal exposure to piperonyl butoxide and permethrin on 36-month neurodevelopment[J]. Pediatrics, 2011, 127(3):e699-706. [6] FORTIN M C, BOUCHARD M, CARRIER G, et al. Biological monitoring of exposure to pyrethrins and pyrethroids in a metropolitan population of the province of Quebec, Canada[J]. Environmental Research, 2008, 107(3):343-350. [7] MEEKER J D, BARR D B, HAUSER R. Pyrethroid insecticide metabolites are associated with serum hormone levels in adult men[J]. Reproductive Toxicology, 2009, 27(2):155-160. [8] MALHAT F M, HAGGAG M N, LOUTFY N M, et al. Residues of organochlorine and synthetic pyrethroid pesticides in honey, an indicator of ambient environment, a pilot study[J]. Chemosphere, 2015, 120: 457-461. [9] FARAJZADEH M A, KHOSHMARAM L, NABIL A A A. Determination of pyrethroid pesticides residues in vegetable oils usin liquid-liquid extraction and dispersive liquid-liquid microextraction followed by gas chromatography-flame ionization detection[J]. Journal of Food Composition & Analysis, 2014, 34(2):128-135. [10] JING You, WANG Dong-li, LYDY M J. Determination of pyrethroid insecticides in sediment by gas chromatography—Ion trap tandem mass spectrometry[J]. Talanta, 2010, 81(s 1-2):136-141. [11] ESTEVE-TURRILLAS F A, PASTOR A, GUARDIA M D L. Microwave-assisted extraction of pyrethroid insecticides from semi permeable membrane devices (SPMDs) used to indoor air monitoring[J]. Analytica Chimica Acta, 2006, 560(s 1-2):118-127. [12] WU Jun, LIN You-jian, LU Jian, et al. Copper clean-up procedure for ultrasonic extraction and analysis of pyrethroid and phenylpyrazole pesticides in sediments by gas chromatography-electron capture detection[J]. Science of the Total Environment, 2011, 409(18):3 482-3 491. [13] SUN Rui, FU Kusng, FU Yu-jie, et al. Preparative separation and enrichment of four taxoids from Taxus chinensis needles extracts by macroporous resin column chromatography[J]. Journal of Separation Science, 2009, 32(9):1 284-1 293. [14] LIU Yong-feng, Liu Jun-xi, Chen Xiao-fen, et al. Preparative separation and purification of lycopene from tomato skins extracts by macroporous adsorption resins[J]. Food Chemistry, 2010, 123(4):1 027-1 034. [15] 卢珂, 曹炜, 陈卫军, 等. 吸附树脂吸附蜂蜜中羟甲基糠醛的热力学研究[J]. 农业工程学报, 2006, 22(11):254-256. [16] 杨海霞, 袁越, 张敬华, 等. 大孔吸附树脂对蜂蜜中对硫磷的脱除热力学研究[J]. 西北大学学报, 2014, 44(4):578-582. [17] 张静, 程妮, 高慧, 等. 树脂吸附蜂蜜中毒死蜱的热力学研究[J]. 西北大学学报, 2010, 40(3):442-446. [18] CHENG Ni, GAO Hui, DENG Jian-jun, et al. Removal of chloramphenicol by macroporous adsorption resins in honey: a novel approach on reutilization of antibiotics contaminated honey[J]. Journal of Food Science, 2012, 77(9):169-172. [19] JIA Qi, YU Shi-feng, CHENG Ni, et al. Stability of nitrofuran residues during honey processing and nitrofuran removal by macroporous adsorption resins[J]. Food Chemistry, 2014, 162(6):110-116. [20] IDRIS S A M. Adsorption, kinetic and thermodynamic studies for manganese extraction from aqueous medium using mesoporous silica[J]. Journal of Colloid & Interface Science, 2015, 440:84-90. [21] 近藤精一. 吸附科学[M]. 第二版. 北京:化学工业出版社, 2006:31-37. [22] AZANOVA V V, HRADIL J. Sorption properties of macroporous and hypercrosslinked copolymers[J]. Reactive & Functional Polymers, 1999, 41(41):163-175. [23] MAHMOODI N M, HAYATI B, ARAMI M, et al. Adsorption of textile dyes on Pine Cone from colored wastewater: kinetic, equilibrium and thermodynamic studies[J]. Desalination, 2011, 268(s 1-3):117-125. The thermodynamic properties in the process of removing pyrethroid residue from honey using macroporous adsorption resins LIU Qing-qing1, YAN Yi-zhu1, YANG Hai-xia2, CHENG Ni1, CAO Wei1, DENG Jian-jun1* 1(Department of Food Science and Engineering, Northwest University, Xi′an 710069, China) 2(Department of Nutrition and Food Safety, College of Public Health, Xi′an Jiaotong University, Xi′an 710061, China) Honey is a natural sweet substance deeply favored by consumers. However, pesticide residuals of nectar plants can be easily collected in honey causing a potential problem on honey safety. Resin absorbance is an effective technique for removing pesticides and antibiotics in honey. In this paper, removal effects of pyrethroid in honey were investigated through comparing of three kinds of macroporous adsorption resins (LS-803, LS-901 and LS-903) with static adsorption method. The result showed that LS-903 is the best to remove pyrethroid in honey by studying its kinetic and thermodynamic properties according with the Freundlich model and Langmuir model at different temperature range (25, 35, 45 ℃). It is a physical adsorption process with spontaneous, endothermic, entropy increase reaction (ΔH>0, ΔG<0 and ΔS>0 ). pyrethroid; honey; macroporous-adsorption-resin; removal thermodynamic 10.13995/j.cnki.11-1802/ts.201612010 硕士研究生(邓建军副教授为通讯作者,E-mail:dengjianjun@nwu.edu.cn)。 西安市科技计划基金资助项目(NC1208(1));陕西省教育厅专项科研计划项目(2013JK0696) 2016-03-20,改回日期:2016-05-23

3 结论