蛋白包覆微晶固定化脂肪酶的制备及催化合成生物柴油的研究
2017-01-07魏佳奥周丽亚赵东磊
马 丽,魏佳奥,周丽亚,冯 凯,赵东磊
(1.河北工业大学 化工学院,天津 300130;2.伯明翰大学 化学院,英国 伯明翰 B152TT;3.河北工业大学 城市学院,天津 300130)
蛋白包覆微晶固定化脂肪酶的制备及催化合成生物柴油的研究
马 丽1,魏佳奥2,周丽亚1,冯 凯1,赵东磊3
(1.河北工业大学 化工学院,天津 300130;2.伯明翰大学 化学院,英国 伯明翰 B152TT;3.河北工业大学 城市学院,天津 300130)
研究了蛋白包覆微晶固定化脂肪酶(PCMC)的制备和性质,并用于催化麻疯树油合成生物柴油.研究表明:以K2SO4为赋形剂、丙酮为脱水剂制备固定化脂肪酶PCMC,在40℃异辛烷中浸泡72 h后,PCMC活性可保持初始活性的70%;在80℃的异辛烷中浸泡4 h后,PCMC活性为初始活性的81%;通过催化月桂酸与正辛醇的酯化反应,考察了脂肪酶PCMC的酯化性能,重复使用9次后,月桂酸转化率可保持在61%以上.并进一步优化了脂肪酶PCMC催化麻疯树油制备生物柴油的反应条件,正己烷为溶剂,麻疯树油与正己烷物质的量之比为1∶2,醇油比为4∶1,酶用量为20%(基于麻疯树油质量),反应温度为50℃,反应时间12 h.在该条件下,生物柴油的最高产率为94%.
蛋白包覆微晶;固定化;脂肪酶;麻疯树油;生物柴油
酶作为一种高效、绿色的生物催化剂受到越来越多的关注,而固定化酶技术可以提高酶的活性和稳定性,增加酶的重复使用稳定性,提高底物和产物的传质效率[1-2].但载体的使用,增加了固定化酶的成本;同时,载体的制备时间长、操作复杂,对实验设备要求较高,这些原因都影响了固定化酶在工业生产中的进一步应用[3-5].因此,研究一种高效、廉价、快速的固定化酶方法至关重要.蛋白包覆微晶技术利用酶分子与可结晶物质脱水析出,得到固定化酶,既保留了酶的高活性,同时制备方法更为简便,展现了巨大的应用前景[6].近年来,越来越多的文献报道了利用蛋白包覆微晶技术制备固定化酶,特别是固定化脂肪酶,并将其用于酯化、转酯等反应,取得了良好的效果[7-10].
本文利用蛋白包覆微晶技术制备固定化脂肪酶(Protein-coatedm icro-crystals technology,PCMC),优化了制备条件,并利用其催化麻疯树油和乙醇的转酯反应合成生物柴油.
1 实验部分
1.1 主要试剂
脂肪酶CALB购于诺维信(中国)生物技术有限公司;月桂酸、四氢呋喃、叔丁醇、正辛醇、硫酸钾、酚酞、丙酮、正丙醇、异丙醇、异辛烷、乙醇(95%)、磷酸氢二钠、磷酸二氢钠等均为分析纯,购于天津市江天化工技术有限公司.所有化学试剂未进行纯化.
1.2 实验方法
1.2.1 PCMC的制备
PCMC的制备参考了Parke课题组[6]的工作,以K2SO4为赋形剂、丙酮为脱水剂,脂肪酶Candidaantarctica lipaseB(CALB)为模型酶,制备固定化酶,具体步骤如下:将1m LCALB酶液(30mg/m L)加入2m L饱和的K2SO4溶液中,振荡混合均匀;磁力搅拌下,将上述混合液逐滴加入到30m L丙酮中;将混合物置于离心管中离心(7500 r/m in)得到白色沉淀,用5m L丙酮洗涤并离心,重复操作3次,得到白色沉淀;空气中干燥,得到固定化脂肪酶,并命名为脂肪酶PCMC.
1.2.2 PCMC活性测定方法
酯化反应:在20 m L密封瓶中,加入0.2 m L正辛醇、100 mg月桂酸、5 m L异辛烷和30 mg PCMC,40℃下反应30m in(磁力搅拌速度为200 r/m in),通过碱滴定法检测剩余的月桂酸的量,并计算转化率.
转化率测定:将上步反应液离心分离,取1 m L上清液,加入到装有50 m L乙醇和1 m L酚酞指示剂(10 g/L)的锥形瓶中,振荡混匀,加热至沸腾,用NaOH(0.05 mol/L)滴定至变色,15 s不褪色时视为终点.通过NaOH消耗的体积,计算出月桂酸的转化率.对照组以反应0 s的体系为空白样本,用上述方法滴定,记录滴定体积.

1.2.3 PCMC制备条件优化
1.2.3.1 脱水剂对酶活的影响
将1m L酶液与2m LK2SO4饱和溶液混合均匀,磁力搅拌下,将混合溶液逐滴加入30m L不同的脱水剂(甲醇、乙醇、丙酮、正丙醇、异丙醇)中.所得混合物离心(7 500 r/m in)分离,得到白色沉淀,用5m L相应的有机溶剂洗涤并离心,重复操作3次.将白色沉淀在空气中干燥,得到不同脱水剂制备的PCMC.用
1.2.2中所述方法测定酶活.
1.2.3.2 赋形剂对酶活的影响
将1m L酶液与2m L不同塑性剂的饱和溶液(K2SO4、Na2SO4、KCl、NaCl、蔗糖)混合均匀.在磁力搅拌下,将混合溶液逐滴加入30 m L丙酮中.将所得混合物置于离心管中离心(7 500 r/m in)分离2 min,得到白色沉淀,用5m L丙酮洗涤并离心,重复操作3次.将沉淀在空气中干燥,得到不同赋形剂制备的PCMC.用1.2.2中所述方法测定酶活.
1.2.4 PCMC的表征
用扫描电镜(SEM)表征PCMC的形貌,样品经过喷金;用激光共聚焦显微镜(CLSM)表征酶分子的固载及PCMC粒径.测试前,将脂肪酶用异硫氰酸荧光素(FITC)进行标记.
1.2.5 PCMC稳定性测定
有机溶剂稳定性:取多组30mg PCMC于具塞试管中,加入到40℃的异辛烷(5m L)中浸泡.不同时间点取出,离心分离,真空干燥,用1.2.2中所述方法测定酶活.
热稳定性:取多组30 mg PCMC于具塞试管中,加入5 m L异辛烷.分别在不同温度(30℃、40℃、50℃、60、70℃、80℃)中浸泡4 h,离心分离,真空干燥,用1.2.2中所述方法测定酶活.
1.2.6 PCMC的重复使用稳定性
向密封瓶中加入30mg PCMC、0.2m L正辛醇、100mg月桂酸、5m L异辛烷和1 g 4型分子筛.40℃下磁力搅拌(200 r/m in)反应2 h,离心分离,取上清液测定转化率.沉淀用异辛烷洗涤多次,干燥后,将沉淀按照上述步骤重复操作,测定重复使用稳定性.
1.2.7 生物柴油合成条件的优化
在以麻疯树油和乙醇为底物的生物柴油合成反应中,为提高生物柴油产率,对影响反应的因素进行研究,包括底物浓度、反应温度、醇油比、酶用量等.具体操作:称取一定量的麻疯树油和乙醇置于20m L密封瓶中,加入不同溶剂、一定量PCMC和4型分子筛,置于恒温水浴下,200 r/m in振荡反应.反应完成后,离心(10 000 r/m in)分离,取上清液,用气相色谱检测生物柴油产率.
合成生物柴油的重复使用稳定性:按照实验所得的最优条件合成生物柴油,加入1g4型分子筛.反应结束后,将反应液离心分离,取上清液测定其生物柴油产率.将沉淀用正己烷洗涤多次,离心干燥,用于下次使用.重复操作多次,测定重复使用稳定性.
气相色谱检测条件:毛细色谱柱选择非极性柱RTX-1(30m×0.25mm),色谱柱初始温度160℃,保留时间2min,以15℃/m in的速率升温至220℃,保留2m in.再以8℃/m in的速率升温至280℃,保留1min.进样器与检测器的温度设置为240℃和280℃,进样量为0.5L.
产率计算:反应样品中生物柴油质量通过保留时间及与内标物的峰面积之比得出.产率的计算公式为

2 结果与讨论
2.1 PCMC制备条件优化
由于疏水性(log P)不同,脱水剂的种类对PCMC的活性有显著的影响.从图1a)中可以看出,以丙酮(log P= 0.21)为脱水剂制备得到的PCMC活性最高为19.3 U/mg.这是因为丙酮合适的疏水性可以使其迅速将酶微环境内的水脱去,同时保留维持酶分子活性结构所必须的结合水[11].因此,选取丙酮作为脱水剂用于后续操作.

图1 脱水剂与赋形剂对PCMC活性的影响Fig.1 Influenceof solventsand excipientson theactivity of PCMC
由于PCMC的活性会受赋形剂种类的影响,选择NaCl、K2SO4、KNO3、Na2SO4、蔗糖等不同晶体进行实验.得到实验结果如图1b)所示,以K2SO4为赋形剂时固定化酶的酯化活性最高,为19.3 U/mg,这是由于K2SO4有合适的溶解度和晶体体积,使PCMC的结构较为稳定,蛋白负载量较大.而以蔗糖为赋形剂时固定化酶活性最低,这与析出的蔗糖晶体粘度较大、PCMC发生粘连有关.在无机盐中,以KNO3为赋形剂时得到的固定化酶活性最低,这可能是因为蛋白分子与NO3存在某种交互作用,影响酶分子的荷电荷性[12].所以,本实验选取K2SO4为赋形剂.
2.2 PCMC的表征
PCMC的形貌由扫描电镜进行表征.图2a)为K2SO4晶体扫描电镜图像,图2b)为PCMC的扫描电镜图像.从图2中可以看出,2种晶体的粒径大小均为2~3m.同时,PCMC晶体表面粗糙,而K2SO4晶体表面光滑,这证明了酶分子的成功负载.

图2 K2SO4和PCMC的扫描电镜图像Fig.2 SEM imagesof K2SO4and PCMC
为进一步确定晶体粒径大小,利用激光共聚焦显微镜对PCMC进行表征(图3).图3中的荧光点即为PCMC晶体,通过图3可以看出,PCMC晶体的粒径为2m,与扫描电镜表征结果相同.图像同时证明脂肪酶成功负载在 K2SO4晶体的表面.

图3 PCMC激光共聚焦图像Fig.3 Confocal imageof PCMC
2.3 PCMC的稳定性研究
对PCMC在有机溶剂中的稳定性进行考察,将PCMC浸泡在40℃异辛烷中,不同时间取出,考察其剩余活性,以未浸泡PCMC的酶活为100%,其结果如图4a)所示.在浸泡8 h后,PCMC催化月桂酸和正辛醇的酯化活性有一定的提高,为初始的120%.这是由于有机溶剂中脂肪酶活性位点会被缓慢激活,同时,浸泡时间短,有机溶剂尚未对酶分子造成不利影响,因此会出现上述现象,这与Pizarro等[13]的研究结果一致.随着浸泡时间的延长,有机溶剂会改变酶分子表面的水化层或荷电荷性,破坏酶分子的三维构象,因此,PCMC的活性缓慢降低.当浸泡72 h后,PCMC的活性降为初始活性的70%.
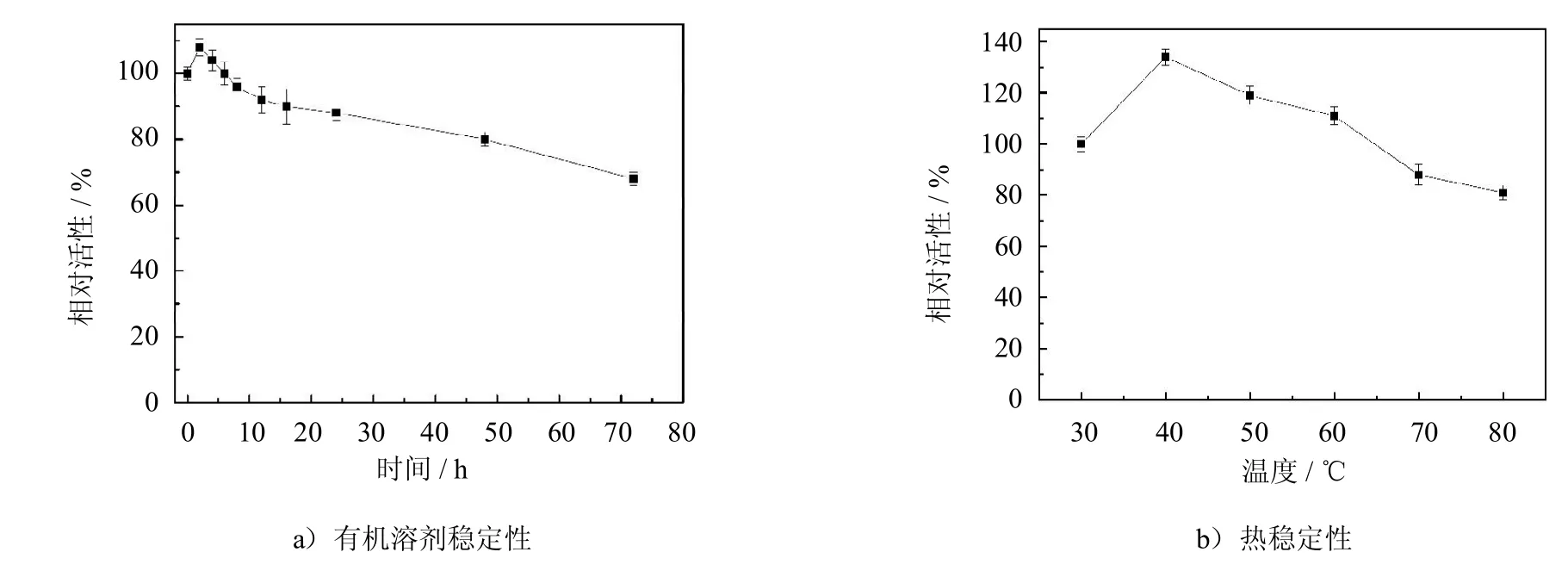
图4 PCMC的有机溶剂稳定性和热稳定性Fig.4 Long-term stabilityin organic solventand thermalstability of PCMC
考察PCMC的热稳定性,将PCMC浸泡于不同温度的异辛烷中,并测定其剩余活性,实验以浸泡在30℃异辛烷中PCMC的活性为100%.结果如图4b)所示,在40℃异辛烷中浸泡4 h后,PCMC的相对活性最高为137%,说明此时的浸泡温度有利于酶展现更好的催化活性.随着温度升高,PCMC的活性下降,在80℃异辛烷中浸泡4 h后,PCMC的相对酶活降低为81%.这是由于温度升高导致酶的活性结构改变,使活性降低[14].
2.4 PCMC酯化反应的重复使用稳定性
PCMC用于催化月桂酸与正辛醇的酯化反应,测定其重复使用稳定性.从图5中可以看出,在前4次反应中,月桂酸的转化率并没有明显下降.重复使用5次后,月桂酸转化率降为90%.随着使用次数的增加,转化率逐渐下降,重复使用9次后,转化率降为61%.这些结果表明,PCMC有着较好的重复使用稳定性,而PCMC重复使用多次后催化月桂酸转化率下降是由两方面原因造成的:一方面,长期处于有机溶剂中,会使酶分子的三维结构发生改变,致使活性降低;另一方面,反应中的搅拌、振荡等操作,会导致酶分子脱落,造成PCMC活性的损失.
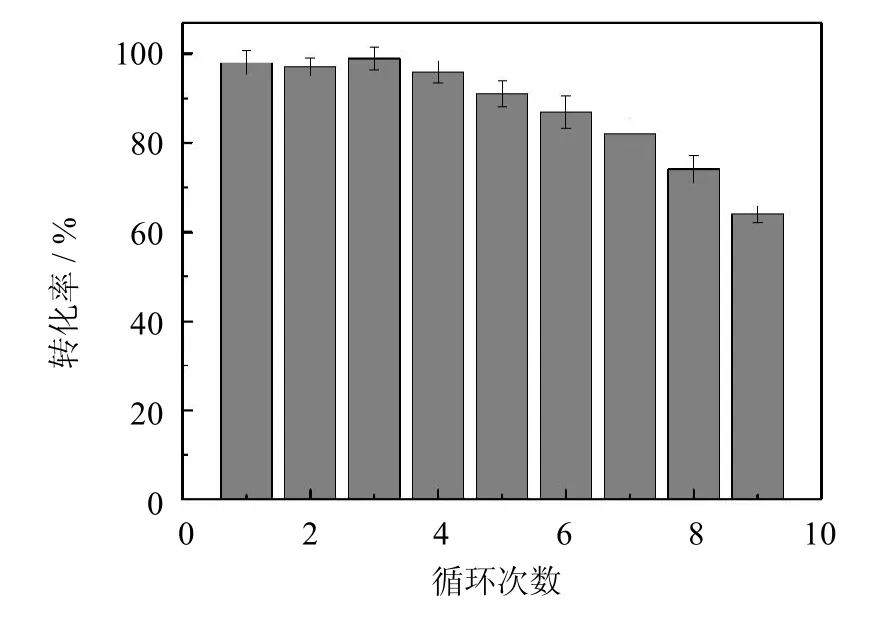
图5 PCMC酯化反应重复使用稳定性Fig.5 Reusability of PCMC in esterification
2.5 PCMC催化合成生物柴油反应条件的优化
PCMC催化合成的生物柴油气相色谱图如图6所示.
图6 PCMC催化合成生物柴油的气相色谱图Fig.6 GC imageof biodieselproduction
2.5.1 溶剂对生物柴油产率的影响
对生物柴油合成反应有机溶剂的种类进行了筛选,其结果如图7所示.从图7中可以看出,以正己烷为溶剂,反应12 h后,生物柴油产率可达87%;以叔丁醇和环己烷为溶剂,产率分别为83%和67%.正己烷为溶剂得到生物柴油的产率较高,是因为正己烷可以使产物和底物溶解得更加均一,同时由于正己烷疏水性较大,反应过程中不会造成维持酶分子活性结构必须水的减少,对酶的伤害更小[15].基于以上结果,实验选取正己烷为溶剂进行后续操作.
2.5.2 反应温度对于生物柴油产率的影响
酶的种类和固定化方式会影响生物柴油合成反应的适宜温度.实验研究了反应温度对生物柴油的产率影响.
实验选取从30℃到70℃等不同温度进行反应,并测定相应温度下生物柴油的产率,得到结果如图8所示.当温度从30℃升高到50℃时,生物柴油的产率由73%提高到87%.这是因为,温度升高可以提高底物的溶解度,同时使底物在溶剂中的微观活动更加剧烈,增加底物与酶分子活性位点的接触几率,进而提高生物柴油的产率[16].随着反应温度继续升高,生物柴油的产率逐渐降低.70℃时,生物柴油的产率仅为71%.这是由于高温使酶分子变性失活,导致产率下降.综上所述,反应温度为50℃用于后续实验.

图7 溶剂对生物柴油产率的影响(反应条件:醇油比5∶1,酶用量20%,反应温度30℃,溶剂与油物质的量之比4∶1)Fig.7 Effectof solventson biodieselyield(The reaction conditions:molar ratio of ethanol/oil5∶1,20%of PCMC dosage to oil content,30℃,molar ratio of oil/n-hexane1∶4
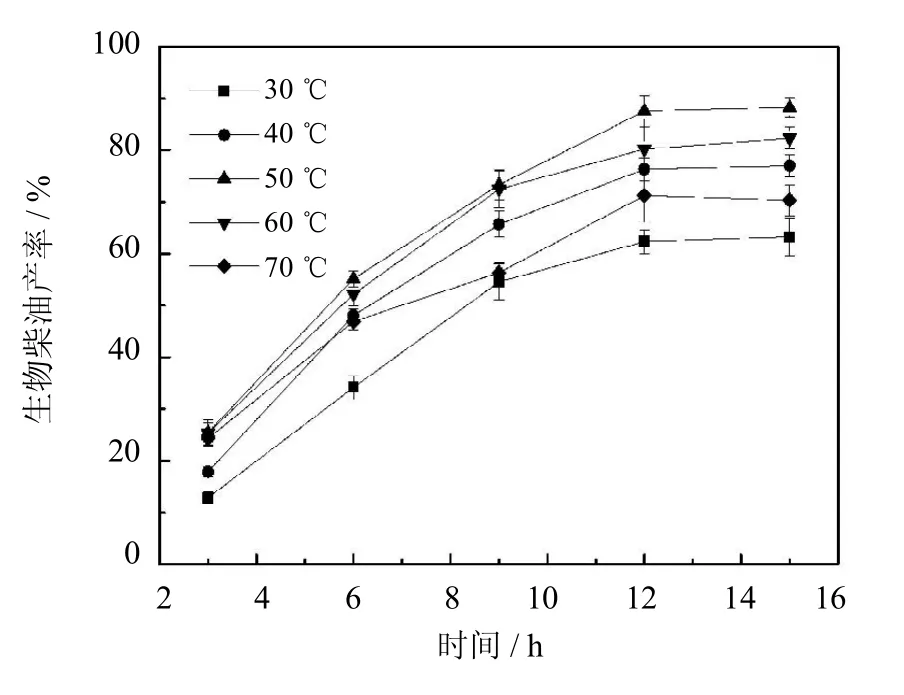
图8 温度对生物柴油产率的影响(反应条件:油与溶剂物质的量之比1∶3,醇油比5∶1,酶用量20%)Fig.8 Effectof temperatureon yield of biodiesel(The reaction conditions:molar ratio of oil/n-hexane1∶3,molar ratio of ethanol/oil5∶1,20%of PCMC dosage to oilcontent)
2.5.3 麻疯树油与正己烷物质的量之比对于生物柴油产率的影响
溶剂的用量对生物柴油合成过程有着重要的影响.从图9中可以看出,当麻疯树油与正己烷的物质的量之比为1∶2时,得到生物柴油的产率最高为91%.增大或降低麻疯树油与正己烷的物质的量之比,生物柴油的产率也随之降低.这是因为,适量的溶剂可以使底物分散性更好,同时加速产物的溶解扩散,减小其抑制效应.溶剂过少会降低底物和产物的溶解,增加传质阻力和底物的抑制效应;而溶剂量过大则会稀释反应体系,造成底物浓度降低,减少底物与活性位点的接触几率.因此,实验最终选取麻疯树油与正己烷的物质的量之比为1∶2.
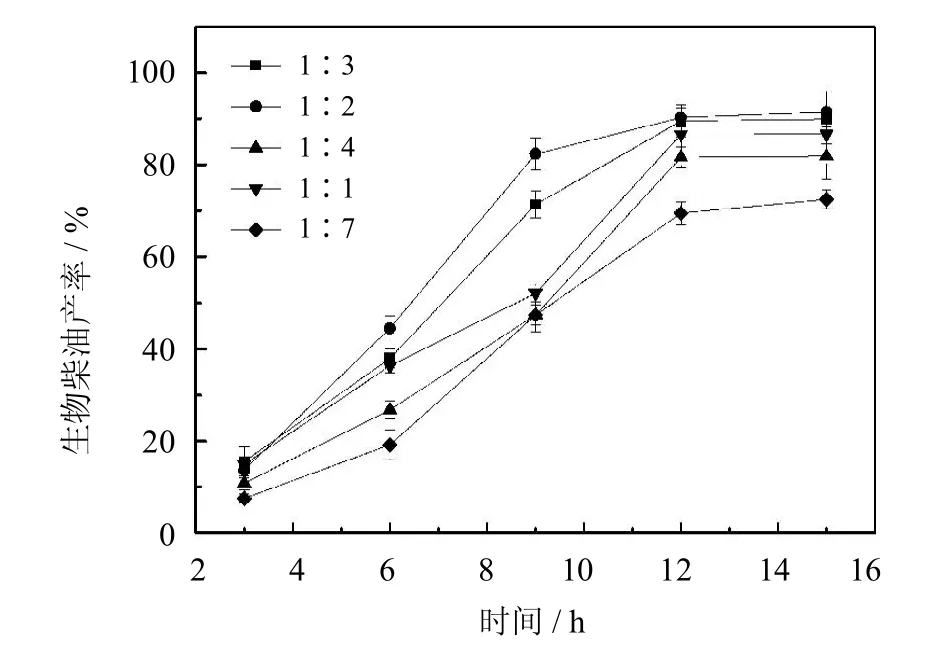
图9 油与溶剂物质的量之比对生物柴油产率的影响(反应条件:醇油比5∶1,酶用量20%,50℃)Fig.9 Effectof themolar ratio of oil/n-hexaneon biodiesel yield(The reaction conditions:molar ratio of ethanol/oil5∶1, 20%of PCMC dosage to oilcontent,50℃)
2.5.4 醇油比对于生物柴油产率的影响
与甲醇相比,以乙醇为亲核试剂进行生物柴油的合成反应可以得到更高的生物柴油产率.这是因为乙醇对酶的钝化失活作用更小,可以形成较温和的催化环境[17-18].醇油物质的量之比是生物柴油合成工艺中一项重要的参数,理论的醇油比为3∶1.但实际反应中适宜的醇油比往往大于理论值[19].实验选取不同的醇油比进行生物柴油的合成反应,以确定最佳的反应条件.从图10中可以看出,当醇油比为4∶1时,生物柴油的产率最高,为94%.增加或降低醇油比,产率均有不同程度的下降.这是因为,当醇油比较低时,由于乙醇蒸发等原因造成底物的不足,减少其与活性位点的接触几率,导致产率过低.当醇油比较高时,高浓度的乙醇对酶分子有较大的毒害作用,致使酶失活,影响产率[20].因此,选取的醇油比为4∶1用于后续实验.
2.5.5 PCMC用量对于生物柴油产率的影响
实验选取PCMC的质量为麻疯树油质量的10%~25%进行催化反应,分别测定生物柴油产率,选择合适的催化剂用量,结果如图11所示.当PCMC用量增加时,生物柴油的产率也随着提高.PCMC用量为10%,反应12 h后,产率为73%,当酶用量为20%时,产率提高到94%.进一步增加PCMC的用量,产率并没有提高.这种现象可以由以下解释:随着 PCMC用量的增加,可以使更多的底物分子接触到酶分子的活性位点,产率也随着提高.当固定化酶用量大于20%时,不会使产率提高.这种随着酶用量增加而产率趋于平衡的现象具有普遍性,与已有研究结果相符[21-22].综合考虑反应产率与反应成本,实验最终选取PCMC用量为20%(基于麻疯树油质量)用于生物柴油的合成反应.
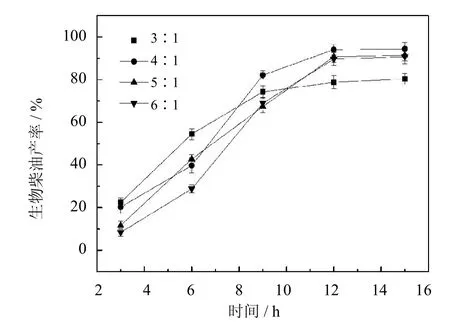
图10 醇油比对于生物柴油产率的影响(反应条件:油与溶剂物质的量之比1∶2,酶用量20%,50℃)Fig.10 Effectof ethanol/oilmolar ratio on the yield of biodiesel (The reaction conditions:molar ratio of oil/n-hexane1∶2, 20%of PCMC dosage to oilcontent,50℃)
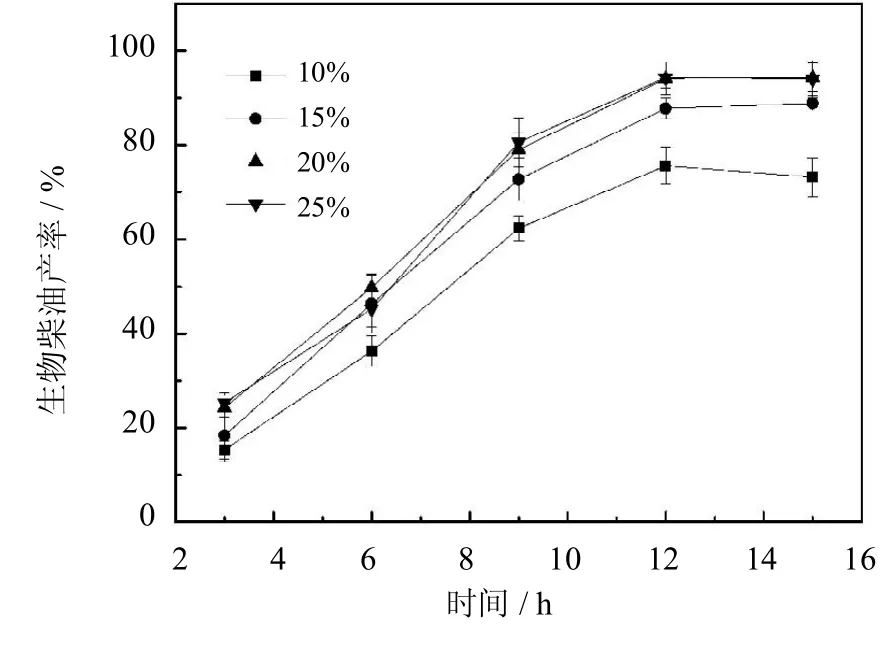
图11 PCMC用量对生物柴油产率的影响(反应条件:醇油比4∶1,油与溶剂物质的量之比1∶2,50℃)Fig.11 Effectof the dosageof PCMC on yield of biodiesel (The reaction conditions:molar ratio of ethanol/oil4∶1, molar ratio of oil/n-hexane1∶2,50℃)
2.5.6 PCMC催化合成生物柴油的重复使用稳定性
将 PCMC在最优条件下催化麻疯树油和乙醇合成生物柴油,并重复使用多次,得到结果如图12所示.首次使用时,生物柴油的产率为94%,重复使用7次后,产率降为34%.产率降低是由于以下原因造成的:1)PCMC酶与晶体之间的结合力较弱,在反应过程中搅拌和底物的共同作用导致酶分子流失[23];2)反应体系中的乙醇使酶钝化失活[12].
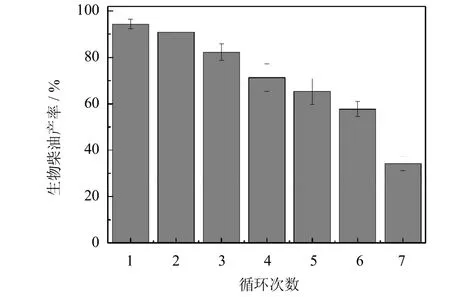
图12 PCMC催化合成生物柴油的重复使用稳定性Fig.12 Reusability of PCMC in biodieselproduction
3 结论
利用 K2SO4为赋形剂,丙酮为脱水剂制备了蛋白包覆微晶固定化酶(PCMC),脂肪酶PCMC具有良好的有机溶剂耐受性、热稳定性和重复使用稳定性.同时将其应用于生物柴油的合成,对反应条件进行了优化.最佳条件下反应12 h,得到生物柴油的最高产率为94%,实验证明了PCMC是一种制备简便、活性较高的固定化酶,在生物柴油的催化制备等应用中展现了巨大的潜力.
参考文献:
[1]Tao J,KazlauskasR J.Biocatalysis forgreen chem istry and chem icalprocessdevelopment[M].Hoboken:USA-Wiley Online Library,2011.
[2]Solano DM,HoyosP,HernáizM,etal.Industrialbiotransformationsin thesynthesisofbuildingblocks leading toenantiopuredrugs[J].Bioresour Technol,2012,115:196-207.
[3]Sheldon RA.Enzyme immobilization:thequest foroptimum performance[J].Adv Synth Catal,2007,349(8-9):1289-1307.
[4]Tran D N,Balkus K J.Perspectiveof recentprogress in immobilization of enzymes[J].Acs Catal,2011,1(8):956-968.
[5]GarciaGalanC,BerenguerMurcia,FernandezLafuenteR,etal.Potentialofdifferentenzyme immobilizationstrategies to improveenzymeperformance [J].Adv Synth Catal,2011,353(16):2885-2904.
[6]KreinerM,ParkerM C,Moore BD.Enzyme-coatedm icro-crystals:a1-stepmethod forhigh activity biocatalystpreparation[J].Chem Comm,2001,12:1096-1097.
[7]KreinerM,Fuglevand G,Moore BD,etal.DNA-coatedm icrocrystals[J].Chem Comm,2005,21:2675-2676.
[8]KreinerM,Amorim Fernandes JF,O'farrell N,etal.Stability of protein-coatedm icrocrystals in organic solvents[J].JMol Catal B:Enzym,2005,33(3):65-72.
[9]Murdan S,Somavarapu S,Ross A C,etal.Immobilisation of vaccinesontom icro-crystals forenhanced thermalstability[J].Int JPharmaceut,2005,296(1-2):117-121.
[10]KreinerM,ParkerM C.High-activitybiocatalystsinorganicmedia:solid-statebuffersas the immobilisationmatrix forprotein-coatedm icrocrystals [J].Biotechnol Bioeng,2004,87(1):24-33.
[11]KreinerM,ParkerM-C.Protein-coatedmicrocrystals foruse in organic solvents:application to oxidoreductases[J].Biotechnol Lett,2015,27 (20):1571-1577.
[12]Zheng J,Xu L,Liu Y,etal.Lipase-coated K2SO4micro-crystals:preparation,characterization,and application in biodieselproduction using variousoil feedstocks[J].Bioresour Technol,2012,110:224-231.
[13]Pizarro C,Bra esM C,MarkovitsA,etal.Influenceofdifferentimmobilization techniques forCandida cylindracea lipaseon itsstability and fish oilhydrolysis[J].JMolCatalB:Enzym,2012,78:111-118.
[14]Liu Y,Zhang X,Tan H,etal.Effectofpretreatmentby differentorganic solventsonesterificationactivity and conformationof immobilized Pseudomonas cepacia lipase[J].Process Biochem,2010,45(7):1176-1180.
[15]FadhilA B,A l-Tikrity ETB,A lbadreeM A.Transesterificationofanovel feedstock,Cyprinuscarpio fishoil:Influenceof co-solventand characterization of biodiesel[J].Fuel,2015,162:215-223.
[16]Jung H,Lee Y,Kim D,etal.Enzymatic production of glycerol carbonate from by-productafter biodieselmanufacturing process[J].Enzyme M icrob Tech,2012,51(3):143-147.
[17]Abigor R D,Uadia PO,Foglia T A,etal.Lipase-catalysed production of biodiesel fuel from some Nigerian lauric oils[J].Biochem Soc T,2000,28(6):979-981.
[18]Hernandez-Martin E,Otero C.Differentenzyme requirements for the synthesisof biodiesel:Novozym 435 and Lipozyme TL IM[J].Bioresour Technol,2008,99(2):277-286.
[19]LiQ,Yan Y.Productionofbiodieselcatalyzed by immobilized Pseudomonascepacia lipase from Sapium sebiferum oilinmicro-aqueousphase[J].ApplEnerg,2010,87(10):3148-3154.
[20]You Q,Yin X,Zhao Y,etal.Biodieselproduction from jatrophaoilcatalyzed by immobilized Burkholderiacepacia lipaseonmodified attapulgite [J].Bioresour Technol,2013,148:202-207.
[21]Gu H,Jiang Y,Zhou L,etal.Reactiveextractionand in situself-catalyzedmethanolysisofgerm inatedoilseed forbiodieselproduction[J].Energ Environ Sci,2011,4(4):1337-1338.
[22]Jiang Y,ShiL,Huang Y,etal.Preparationof robustbiocatalystbased on cross-linked enzymeaggregatesentrapped in three-dimensionally ordered macroporoussilica[J].ACSapplmater inter,2014,6(4):2622-2628.
[23]Yu C Y,Li X F,Lou W Y,et al.Cross-linked enzyme aggregates of Mung bean epoxide hydrolases:a highly active,stable and recyclable biocatalyst forasymmetric hydrolysisof epoxides[J].JBiotechnol,2013,166(1):12-19.
[责任编辑 田 丰]
Preparation of protein coatedm icro-crystalsand its application in biodieselproduction
MA Li1,WEIJiaao2,ZHOU Liya1,FENG Kai1,ZHAO Donglei3
(1.Schoolof Chemical Engineering,HebeiUniversity and Technology,Tianjin 300130,China;2.Schoolof Chem istry,University of Birmingham,Birm inghamB152TT,UK;3.City College,HebeiUniversity and Technology,Tianjin 300130,China)
The PCMCwasused to prepare immobilized lipase.The preparing conditionsand stabilitiesof immobilized lipasewere studied and thebiocatalystswereused forbiodieselproduction from Jatrophaoil.K2SO4wasused asexcipient and acetone aswaterm iscible organic solvent to prepare lipase PCMC.The obtained PCMC exhibited excellentstability and reusability.The PCMC retained 70%of its initialactivity after incubating in iso-octane for72 h,and retained 81%of the initialactivity after incubating in iso-octone at80℃for4 h.The conversion of lauric acid can be retainedmore than 61%after9 successive reaction cycles.The reaction parameterbiodieselproductionwereoptim ized and theoptimum conditionswere as follows:molar ratio of Jatropha oil to n-hexane 1∶2,temperature 50℃,molar ratio of ethanol to oil 4∶1,the dosageof PCMC 20%(w/w PCMC to oil).Under these conditions,themaximum biodieselyield could reach 94%.
protein-coatedm icro-crystals;immobilization;lipase;jatropha oil;biodiesel
Q814.2
A
1007-2373(2016)04-0037-08
10.14081/j.cnki.hgdxb.2016.04.007
2016-06-20
天津市高等学校科技发展基金计划(20140513);河北省自然科学基金(B2016202027)
马丽(1983-),女(汉族),实验师.
赵东磊(1981-),男(满族),讲师,tyzdl@sohu.com.
