肝癌组织中LUZP表达变化及其与患者临床病理特征的关系
2017-01-06AliFaheem李光兵刘军
Ali Faheem,李光兵,刘军
(山东大学附属省立医院,济南250021)
肝癌组织中LUZP表达变化及其与患者临床病理特征的关系
Ali Faheem,李光兵,刘军
(山东大学附属省立医院,济南250021)
目的 探讨亮氨酸拉链蛋白(LUZP)表达与肝癌患者临床病理特征的关系。方法 选择接受手术治疗的77例肝癌患者的肝癌及癌旁肝组织,采用实时定量PCR法检测癌及癌旁肝组织中LUZP mRNA的表达,采用免疫组化法检测癌及癌旁肝组织中LUZP蛋白的表达,半定量计分法对免疫组化结果进行统计分析。以癌旁肝组织LUZP mRNA均值为标准,将肝癌患者分为LUZP 高表达、低表达两个水平,比较不同LUZP表达水平患者的临床病理特征。结果 肝癌与癌旁肝组织LUZP mRNA表达分别为1.87±0.11、0.58±0.05,肝癌组织中LUZP mRNA表达高于癌旁肝组织(P<0.05)。肝癌与癌旁肝组织LUZP蛋白表达分别为(10.0±1.5)、(4.0±0.5)分,肝癌组织中LUZP蛋白表达高于癌旁肝组织(P<0.05)。以癌旁肝组织LUZP mRNA均值为标准,将肝癌患者分为LUZP 高表达49例、低表达28例。LUZP高表达患者侵犯门静脉、TNM 1+2期、复发的发生率均高于低表达患者(P均<0.05)。低表达患者的总生存时间是36个月,高表达患者的总生存时间是12个月,LUZP高表达患者的生存时间低于低表达患者(P<0.05,OR=1.88, 95%CI为1.08~3.30)。结论 LUZP是肝癌患者预后的生物学指标,其高表达提示肝癌患者预后差。
肝细胞癌;亮氨酸拉链蛋白;预后
肝癌是发病率第五位的恶性肿瘤,是世界上第三位的导致癌症相关死亡的疾病[1]。目前手术是治疗肝癌惟一的治愈方法。但是多数肝癌患者就诊时已处于肿瘤晚期,手术治疗后肿瘤的转移和复发易导致手术治疗效果差[2]。降低肝癌术后复发率、提高患者预后是目前肝癌治疗领域的主要难点之一。亮氨酸拉链蛋白(LUZP)是一种含有亮氨酸拉链基序的蛋白质[3],在正常发育中起到重要的调控作用,其表达缺失将导致胚胎出颅神经管的闭合缺损[4]。研究发现,LUZP的异常表达与多种肿瘤的发生密切相关,在乳腺癌、肾癌、宫颈癌和胰腺癌等肿瘤组织中均检测到LUZP的过度表达,且其表达与患者预后相关[5~7]。目前对肝癌组织中LUZP的表达情况尚不明确。我们选择2010年9月~2012年1月行手术治疗的77例肝癌患者,对其癌组织中LUZP的表达情况进行检测,探讨LUZP的表达与患者临床病理特征的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择同期在我院接受手术治疗的77例肝癌患者的肝癌及癌旁肝组织,男67例、女10例,年龄24~73岁、中位年龄48.5岁。均经病理学检查确诊。均无丙型肝炎病毒感染和黄曲霉素接触史。收集患者临床病理特征数据,包括年龄、性别、甲胎蛋白水平、肿瘤大小、门静脉侵犯、淋巴结转移、酒精摄入量、肝癌TNM分期、肝癌家族史、复发、乙肝病毒感染状况、丙肝病毒感染情况、黄曲霉毒素接触史和生存时间。
1.2 LUZP mRNA表达检测 将癌及癌旁肝组织分割后液氮速冻,保存于-80 ℃冰箱。应用Allprep DNA/RNA抽提试剂盒提取组织总RNA,应用去DNA试剂盒去除RNA标本中的基因组DNA。ND-2000超微量分光光度计测定RNA浓度。取1 μg总RNA为模板,应用cDNA逆转录试剂盒合成cDNA。采用实时定量PCR法检测癌及癌旁肝组织中LUZP mRNA的表达。引物序列:LUZP 正向5′-CGGAAGTATTGACGGAAAGC-3′,反向5′-GCTTGTAAATTCG-GCCATGT-3′,产物长度237 bp;β-Actin正向5′-GGACTTCGAGCAAGAGATGG-3′,反向5′-AGCACTGTGTTGGCGTACAG-3′。qPCR反应条件为95 ℃ 10 min,95 ℃ 15 s、60 ℃ 60 s 40个循环。用2%琼脂糖凝胶对扩增的产物进行电泳分离并用EB染色。以2-ΔΔCt法分析结果。
1.3 LUZP蛋白表达检测 采用免疫组化法。取癌及癌旁肝组织制备石蜡切片,脱蜡后梯度酒精水化,0.1 mmol/L枸橼酸钠行抗原修复。利用兔抗人LUZP多克隆抗体一抗孵育切片,应用辣根过氧化物酶偶联的鼠抗兔二抗进行显影。显微镜下计数阳性染色细胞数。半定量法评分法对LUZP阳性率进行分析。染色强度评分为:1分为无阳性染色;2分为无阳性染色;3分为中度阳性染色;4分为强阳性染色。阳性细胞百分比评分:0分为无阳性细胞;1分为阳性细胞数<10%;2分为阳性细胞数10%~50%;3分为阳性细胞数51%~80%;4分为阳性细胞数>80%。以染色强度评分与百分比评分乘积计为半定量评分分数。
1.4 随访方法 所有患者随访至死亡或随访至2016年6月,记录生存时间。
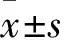
2 结果
2.1 肝癌与癌旁肝组织中LUZPmRNA表达比较 肝癌与癌旁肝组织LUZPmRNA表达分别为1.87±0.11、0.58±0.05,肝癌组织中LUZPmRNA表达高于癌旁肝组织(P<0.05)。以癌旁肝组织LUZPmRNA均值为标准,将肝癌患者分为LUZP高表达49例、低表达28例。
2.2 肝癌与癌旁肝组织中LUZP蛋白表达比较 免疫组化法对肝癌与癌旁肝组织中LUZP蛋白进行检测,半定量法进行统计分析。结果显示,肝癌与癌旁肝组织中LUZP蛋白表达分别为(10.0±1.5)、(4.0±0.5)分,肝癌组织中LUZP蛋白表达高于癌旁肝组织(P<0.05)。
2.3LUZPmRNA表达与临床病理特征的关系LUZP高表达患者侵犯门静脉、TNM1+2期、复发的发生率均高于低表达患者(P均<0.05)。LUZP高表达与低表达患者在年龄、性别、淋巴结转移、乙肝病毒感染、甲胎蛋白水平、肿瘤直径、肿瘤史和酒精摄入量方面无统计学差异。见表1。
2.4LUZPmRNA水平与肝癌患者预后相关性 所有患者均随访至患者死亡或2016年6月,所有死亡患者死亡原因均为肝癌复发。低表达患者的总生存时间是36个月,高表达患者的总生存时间是12个月,LUZP高表达患者的生存时间低于低表达患者(P均<0.05,OR=1.88, 95% CI为1.08~3.30)。

表1 不同LUZP表达水平患者的临床病理特征(例)
3 讨论
肝癌是在慢性肝脏疾病如慢性肝炎、酒精性肝炎等基础上发展而来的[8,9],乙肝病毒、丙肝病毒感染等肝癌发病的危险因素会诱导原癌基因过度活化或抑癌基因失活,从而导致肝癌的发生、发展[10]。肝癌发病隐匿、进展迅速,70%~80%病例发现时已处于中晚期,如合并门静脉癌栓、肝外转移等,若不进行有效干预,患者短期内可能出现死亡。手术是目前治疗肝癌最有效的手段[11]。但手术治疗后肿瘤复发率高,肝癌患者术后的5年生存率低于20%[12]。研究与肝癌复发相关的生物学标志物,有助于制定合理的治疗方案、改善患者预后、提高患者生存时间。
LUZP是一种调节蛋白,含有一个20种氨基酸的片段,富含有氨基酸残基的碱基端拉链基序的侧边区域、包括碱性区域、亮氨酸残基的周期排列被称为“碱性亮氨酸拉链基序”或亚模体(亚超二级结构)[13]。这个碱性区域被认为是通过与带负电荷的磷酸基团的DNA相互作用来促进DNA间的结合,参与基因表达的调控。LUZP过度表达或突变都可能导致恶性肿瘤的发生,在宫颈癌、乳腺癌、胰腺癌等实体肿瘤中均可检测到LUZP的异常表达[5, 7]。本研究发现,肝癌组织中LUZP mRNA及蛋白表达均高于癌旁肝组织,提示LUZP的异常表达可能上调癌基因或下调抑癌基因的表达,诱导肝癌的发生、发展。本研究结果同样发现,LUZP高表达患者的生存时间低于低表达患者,提示LUZP mRNA高表达预示着患者生存时间短。
文献报道,胰腺癌、乳腺癌和宫颈癌患者LUZP的过度表达提示患者预后不良[13]。LUZP表达升高能够抑制胰腺癌细胞的凋亡,降低胰腺癌细胞对放射治疗的敏感性,降低胰腺癌患者5年生存率[14]。Jang等[5]研究显示,LUZP表达升高会促进乳腺癌细胞的侵袭和转移能力,高表达LUZP的乳腺癌患者治疗后容易出现复发和转移,导致患者长期生存率显著下降。Kang等[15]研究发现,LUZP表达升高同样能够促进宫颈癌细胞的侵袭和转移能力,降低患者预后。本研究发现,在门静脉侵犯率、肿瘤分期以及复发率方面,LUZP mRNA高表达组与低表达组患者存在显著差异,高表达组患者在诊断时更多处于肿瘤晚期、合并门静脉侵犯,治疗后复发率显著高于低表达组患者,这与高表达组患者预后比低表达组患者差的结果一致,也提示LUZP的异常高表达能够促进肿瘤的进展。
本研究发现,LUZP mRNA高表达组与低表达组患者在淋巴转移、肿瘤直径以及甲胎蛋白水平方面差异无统计学意义。文献研究显示,甲胎蛋白水平与肝癌患者预后相关,甲胎蛋白水平升高提示患者预后差。而大肝癌或巨大肝癌患者预后比小肝癌患者预后差。本研究结果未能证实LUZP表达与肿瘤大小以及甲胎蛋白水平间的相关性,可能与本研究样本量小有关,因此需扩大样本量进行进一步的研究。
综上所述,LUZP在肝癌组织中的表达显著高于癌旁肝组织,提示其异常高表达会促进肝癌的发生、发展,其表达升高提示肝癌患者预后差。本研究结果为LUZP作为肝癌预后的生物学指标以及作为肝癌治疗靶点蛋白提供了实验依据。
[1] Liu Y, Pan S, Liu L, et al. A genetic variant in long non-coding RNA HULC contributes to risk of HBV-related hepatocellular carcinoma in a Chinese population [J]. PloS One, 2012,7(4):e35145.
[2] Kishi Y, Hasegawa K, Sugawara Y, et al. Hepatocellular carcinoma: current management and future development-improved outcomes with surgical resection [J]. Inter J Hepatol, 2011,2011:728103.
[3] Meissner C S, Suffner S, Schauflinger M, et al. A leucine zipper motif of a tegument protein triggers final envelopment of human cytomegalovirus [J]. J Virol, 2012,86(6):3370-3382.
[4] Chen Y, Zhou Y, Qiu S, et al. Autoantibodies to tumor-associated antigens combined with abnormal alpha-fetoprotein enhance immunodiagnosis of hepatocellular carcinoma[J]. Cancer Letters, 2010,289(1):32-39.
[5] Jang SY, Jang SW, Ko J. Regulation of ADP-ribosylation factor 4 expression by small leucine zipper protein and involvement in breast cancer cell migration [J]. Cancer Letters, 2012,314(2):185-197.
[6] Peng Y, Clark C, Luong R, et al. The leucine zipper putative tumor suppressor 2 protein LZTS2 regulates kidney development [J]. J Bio Chem, 2011,286(46):40331-40342.
[7] Kang H, Jang SW, Ko J. Human leucine zipper protein sLZIP induces migration and invasion of cervical cancer cells via expression of matrix metalloproteinase-9 [J]. J Bio Chem, 2011,286(49):42072-42081.
[8] Venook AP, Papandreou C, Furuse J, et al. The incidence and epidemiology of hepatocellular carcinoma: a global and regional perspective [J]. Oncologist, 2010,15(Suppl 4):5-13.
[9] Staib F, Hussain SP, Hofseth LJ, et al. TP53 and liver carcinogenesis [J]. Human Mut, 2003,21(3):201-216.
[10] Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma [J]. Hepatology, 2008,48(6):2047-2063.
[11] Li GB, Zhang XL, Yuan L, et al. Protein phosphatase magnesium-dependent 1delta (PPM1D) mRNA expression is a prognosis marker for hepatocellular carcinoma [J]. PloS One, 2013,8(3):e60775.
[12] Liu X, Wang S, Xia X, et al. Synergistic role between p53 and JWA: prognostic and predictive biomarkers in gastric cancer [J]. PloS One, 2012,7(12):e52348.
[13] Hussain SP, Schwank J, Staib F, et al. TP53 mutations and hepatocellular carcinoma: insights into the etiology and pathogenesis of liver cancer [J]. Oncogene, 2007,26(15):2166-2176.
[14] Nagasaki K, Schem C, Von Kaisenberg C, et al. Leucine-zipper protein, LDOC1, inhibits NF-kappaB activation and sensitizes pancreatic cancer cells to apoptosis [J]. Inter J Cancer, 2003,105(4):454-458.
[15] Xu H, Dhanasekaran DN, Lee CM, et al. Regulation of neurite outgrowth by interactions between the scaffolding protein, JNK-associated leucine zipper protein, and neuronal growth-associated protein superior cervical ganglia clone 10[J]. J Bio Chem, 2010,285(6):3548-3553.
刘军(E-mail: Dr_liujun1967@126.com)
10.3969/j.issn.1002-266X.2016.46.018
R735.7
B
1002-266X(2016)46-0062-03
2016-05-21)
