糖尿病、高血压及肥胖与肾细胞癌患者肿瘤直径、组织学分级的关系
2017-01-06魏江浩田昊王勇尚芝群牛远杰
魏江浩,田昊,王勇,尚芝群,牛远杰
(1天津医科大学第二医院,天津300211;2天津市泌尿外科研究所)
糖尿病、高血压及肥胖与肾细胞癌患者肿瘤直径、组织学分级的关系
魏江浩1,2,田昊1,2,王勇1,2,尚芝群1,2,牛远杰1,2
(1天津医科大学第二医院,天津300211;2天津市泌尿外科研究所)
目的 探讨代谢综合征(MetS)组分中糖尿病、高血压及肥胖与肾细胞癌(RCC)患者肿瘤直径及组织学分级的关系。方法 回顾性分析362例原发性RCC患者的资料,根据血糖水平及病史,将患者分为糖尿病146例、非糖尿病216例两个水平;根据血压水平,将患者分为高血压202例、非高血压160例两个水平;根据BMI,将患者分为肥胖157例、非肥胖205例两个水平;根据是否同时伴有糖尿病、高血压及肥胖,将患者分为代谢异常者95例、非代谢异常者267例两个水平。对有无糖尿病、高血压、肥胖及代谢异常者与RCC肿瘤直径、组织学分级的关系进行分析。结果 代谢异常者RCC肿瘤直径、Fuhrman分级均高于非代谢异常者(P均<0.01)。合并糖尿病、高血压及肥胖者RCC的肿瘤直径、Fuhrman分级均较不合并各相应MetS组分者高(P均<0.05)。结论 合并代谢异常的RCC患者肿瘤直径较大、组织学分级较高。糖尿病、高血压及肥胖均可增加RCC的肿瘤直径与组织学分级。
糖尿病;高血压;肥胖;代谢综合征;肾细胞癌;病理分级
肾细胞癌(RCC)又称为肾腺癌、肾癌,是来源于肾实质泌尿小管上皮系统的恶性肿瘤,其发病率约占所有恶性肿瘤的2%。RCC的病理组织学分类主要包括透明细胞癌、乳头状腺癌、嫌色细胞癌及未分类肾细胞癌等。截至目前,已有较多研究探讨了RCC发病的危险因素。女性伴有2型糖尿病,男性伴有肥胖、高血压,均是RCC的独立危险因素[1,2]。以上因素均为代谢综合征(MetS)的组成成分之一。研究证实,MetS与多种泌尿系统疾病关系密切[3,4],如MetS可通过降低尿液pH值而增加肾结石发病率;干扰下丘脑腹侧神经元使前列腺包膜及膀胱颈部α受体的活性增加,进而导致下尿路症状频繁出现;降低精子存活率,诱发精索静脉曲张,而使男性不育的发病风险提高3倍。近年研究发现,MetS与多种恶性肿瘤如胆管癌、乳腺癌、结直肠癌、前列腺癌、膀胱癌等的发生发展密切相关,可通过肿瘤代谢、DNA损伤或修复、炎症因子和胰岛素生长因子-1等的变化影响肿瘤进展[5]。但关于MetS与RCC病理特征的关系尚不明确。本研究对2011年1月~2016年1月我院收治的362例原发性RCC患者的病理资料进行回顾性分析,探讨MetS组分中糖尿病、高血压及肥胖与RCC患者肿瘤直径及组织学分级的关系。
1 资料与方法
1.1 临床资料 选择2011年1月~2016年1月我院收治的原发性RCC患者362例,男218例、女144例,年龄22~93岁、中位年龄59岁。均经肾根治性或部分切除术后病理诊断证实。合并高血压202例、糖尿病146例。病理分期:T1a期112例,T1b期94例,T2a期70例,T2b期12例,T3期64例,T4期10例。病理类型:透明细胞型297例,乳头状37例,嫌色细胞型18例,其他类型10例。Fuhrman分级:G1级8例,G2级202例,G3级128例,G4级24例。高血压标准:血压≥130/85 mmHg或有高血压史。糖尿病标准:空腹血糖(FBG)≥6.1 mmol/L或糖负荷后2 h血糖(BG)≥7.8 mmol/L或有糖尿病史。肥胖标准基于我国人口学资料对中国人的BMI标准制定,以BMI≥25 kg/m2为肥胖[6]。将同时满足高血压、糖尿病、肥胖标准的患者定义为代谢异常者。纳入标准:①均行肾根治性或部分切除术;②手术标本符合RCC病理或细胞学诊断标准;③临床病理特征资料完整。排除标准:①来源于其他部位的转移性肾癌;②原位癌;③术前已行其他治疗者,如放疗、化疗、生物治疗等;④就诊时未满18岁。本研究获得我院伦理审查委员会批准。
1.2 MetS组分分层方法 根据血糖水平及病史,将患者分为糖尿病146例、非糖尿病216例两个水平;根据血压水平,将患者分为高血压202例、非高血压160例两个水平;根据BMI,将患者分为肥胖157例、非肥胖205例两个水平;根据是否同时伴有糖尿病、高血压及肥胖,将患者分为代谢异常者95例、非代谢异常者267例两个水平。
1.3 统计学方法 采用SPSS19.0统计软件,使用χ2检验分析不同MetS组分与RCC肿瘤直径、组织学分级的关系。以P<0.05为差异有统计学意义。
2 结果
代谢异常者RCC肿瘤直径、Fuhrman分级均高于非代谢异常者(P均<0.01)。合并糖尿病、高血压及肥胖者RCC的肿瘤直径、Fuhrman分级均较不合并各相应Mets组分者高(P均<0.05)。见表1。
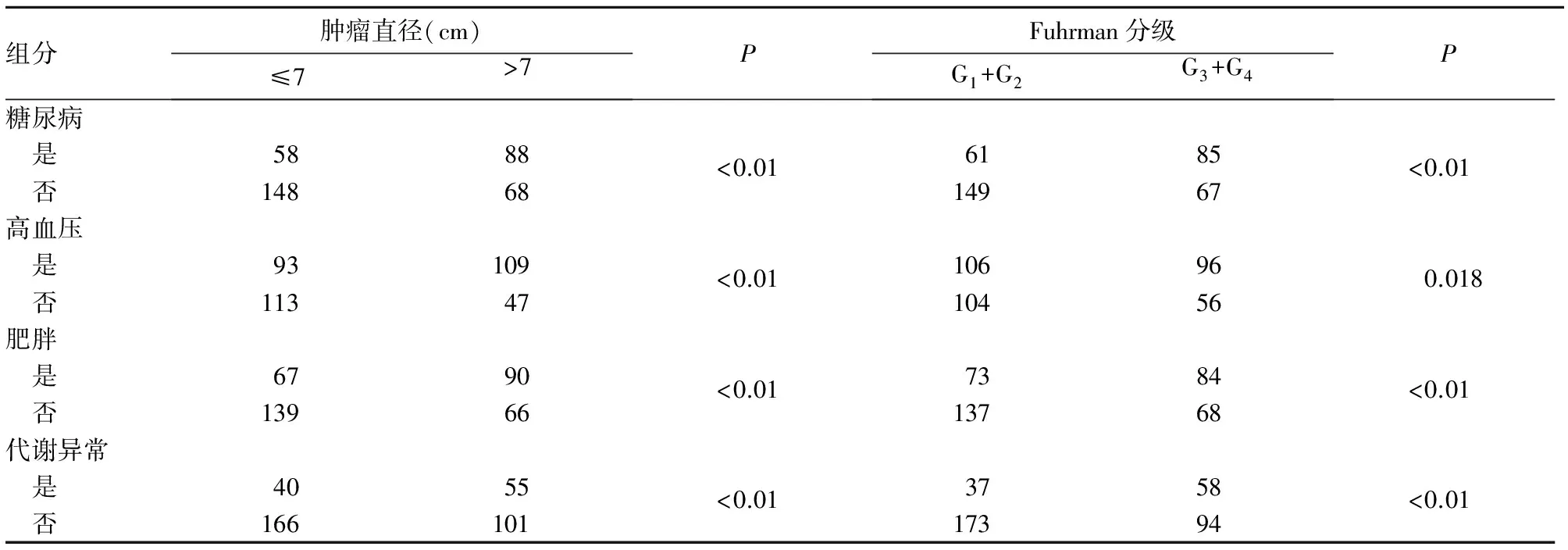
表1 MetS各组分与RCC肿瘤直径、Fuhrman分级的关系
3 讨论
随着研究的深入,人们逐渐认识到RCC是一种与代谢相关的恶性肿瘤。有关RCC的每个已知基因,如希佩尔-林道基因(VHL)、间质上皮转化因子基因(MET)、促卵泡激素基因(FLCN)、结节性硬化症1基因(TSC1)、结节性硬化症2基因(TSC2)、转录因子E3基因(TFE3)、转录因子EB基因(TFEB)、小眼畸形相关转录因子基因(MITF)、家族性高胆固醇血症基因(FH)、琥珀酸脱氢酶B基因(SDHB)、琥珀酸脱氢酶D基因(SDHD)、磷酸酯酶与张力蛋白同源物基因(PTEN)等,均与氧、铁、能量或营养代谢通路直接或间接相关[7,8]。MetS的主要组成成分是糖耐量异常或糖尿病,高血压,以内脏型肥胖为主的肥胖病,以及以高甘油三酯水平和低高密度脂蛋白水平为特点的血脂紊乱。研究发现,高水平的代谢因素会使RCC的发病风险、病理特征显著增加[9]。
目前大量流行病学研究显示,糖尿病尤其是2型糖尿病与肝癌、结直肠癌、口咽癌等恶性肿瘤的发生发展密切相关[10]。Joh等[2]对患者进行长期随访发现,糖尿病会显著增加RCC的发病率与病死率。
尽管目前研究证实糖尿病与RCC密切相关,但其相关机制仍不明确。二者的相关性可能是直接的(如血糖水平高直接影响),也可能是间接的(如通过高胰岛素血症),或可能与其他RCC危险因素协同发挥作用(如肥胖)的共同作用结果[11,12]。胰岛素抵抗是2型糖尿病发病的重要因素,是指机体对正常剂量的胰岛素的反应低于正常。机体常代偿性地增加胰岛素的分泌量,以便维持正常的代谢状态,故高胰岛素血症常伴随出现。高胰岛素水平会抑制胰岛素样生长因子结合蛋白合成,从而使胰岛素样生长因子活性增强,进而刺激肿瘤的形成[13]。我们认为二者的关系可能是因为二者各自的发生机制具有相通处,即某些糖尿病危险因素也可促使肿瘤发生发展。本研究发现,合并糖尿病的RCC患者肿瘤直径、Fuhrman分级均高于非糖尿病患者,提示糖尿病可显著增加RCC的肿瘤直径与组织学分级。
Colt等[14]研究发现,高血压可使RCC患病风险增加近2倍。Neil等对462例RCC患者研究后提出,高血压是MetS中与RCC临床病理特征相关性最高的组分。其原因[15,16]可能为:①异常的脂质过氧化作用导致过多的活性氧产生,氧自由基激活Wnt信号通路而促进肿瘤细胞增殖、分化;②临床高血压出现之前的慢性肾功能改变促使肾脏发生癌变;③高血压状态下,促血管生成因子与缺氧诱导因子上调,如缺氧诱导因子-1α(HIF-1α)上调,激活多种靶基因的转录,使之肿瘤细胞适应缺氧环境而促进肿瘤的发生发展。本研究发现,合并高血压的RCC患者肿瘤直径、Fuhrman分级均高于非高血压患者,提示高血压可显著增加RCC的肿瘤直径与组织学分级。
肥胖作为MetS的组分之一,与多种恶性肿瘤的发生也有密切关系。Bergstrom等[17]报道,高BMI男性的MetS与RCC密切相关,每增加单位BMI,其相对危险将会增加1.07。因肥胖与糖尿病尤其是2型糖尿病明显相关,其在致癌过程中的作用可能与糖尿病一致,2型糖尿病的发病与胰岛素样生长因子-4上调及胰岛素抵抗有关,而胰岛素样生长因子-4能促进细胞增殖同时又抑制细胞凋亡,进而可使细胞发生无限增殖形成恶性肿瘤[5]。本研究发现,合并肥胖的RCC患者肿瘤直径、Fuhrman分级均高于非肥胖患者,提示BMI与RCC的肿瘤直径、组织学分级显著相关,与继往文献报道相一致。
本研究发现,不仅单个MetS组分与RCC的肿瘤直径、组织学分级显著相关,当出现多个MetS组分,表现为明确MetS的代谢异常者时,RCC肿瘤直径、Fuhrman分级均高于非代谢异常者,提示糖尿病、高血压及肥胖的同时存在可显著增加RCC的肿瘤直径与组织学分级。但本研究尚存在不足之处:①回顾性研究,且样本量有限;②未将一些已被明确的RCC危险因素(如吸烟、泌尿道感染、肾结石等)纳入研究;③尽管BMI可代替肥胖,但不能有效显示体内脂肪的分布。
综上所述,RCC合并代谢异常患者的肿瘤直径较大、组织学分级较高。糖尿病、高血压及肥胖均可增加RCC的肿瘤直径与组织学分级。但该研究结果需要进一步、大样本、多中心的研究来证实。
[1] Chow WH, Gridley G, Fraumeni JF, et al. Obesity, hypertension, and the risk of kidney cancer in men[J]. N Engl J Med, 2000,343(18):1305-1311.
[2] Joh HK, Willett WC, Cho E. Type 2 diabetes and the risk of renal cell cancer in women[J]. Diabetes Care, 2011,34(7):1552-1556.
[3] Kupelian V, Mcvary KT, Kaplan SA, et al. Association of lower urinary tract symptoms and the metabolic syndrome: results from the Boston area community health survey[J]. J Urol, 2013,189(1 Suppl):107-114.
[4] Andersen JM, Herning H, Aschim EL, et al. Body mass index is associated with impaired semen characteristics and reduced levels of anti-mullerian hormone across a wide weight range[J]. PLoS One, 2015,10(6):e0130210.
[5] Ozbek E, Otunctemur A, Dursun M, et al. Association between the metabolic syndrome and high tumor grade and stage of primary urothelial cell carcinoma of the bladder[J]. Asian Pac J Cancer Prev, 2014,15(3):1447-1451.
[6] 陈蕾.上海市成人代谢综合征流行调查[J].中华心血管病杂志,2003,31(12):909-912.
[7] Jonasch E, Futreal PA, Davis IJ, et al. State of the science: an update on renal cell carcinoma[J]. Mol Cancer Res, 2012,10(7):859-880.
[8] Linehan WM, Ricketts CJ. The metabolic basis of kidney cancer[J]. Semin Cancer Biol, 2013,23(1):46-55.
[9] Haggstrom C, Rapp K, Stocks T, et al. Metabolic factors associated with risk of renal cell carcinoma[J]. PLoS One, 2013,8(2):e57475.
[10] Tian Y, Tang B, Wang C, et al. Metformin mediates resensitivity to 5-fluorouracil in hepatocellular carcinoma via the suppression of YAP[J]. Oncotarget, 2016,15:10079.
[11] Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer: a consensus report[J]. Diabetes Care, 2010,33(7):1674-1685.
[12] Parr CL, Batty GD, Lam TH, et al. Body-mass index and cancer mortality in the Asia-Pacific Cohort Studies Collaboration: pooled analyses of 424,519 participants[J]. Lancet Oncol, 2010,11(8):741-752.
[13] Dunn SE, Kari FW, French J, et al. Dietary restriction reduces insulin-like growth factor Ⅰ levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice[J]. Cancer Res, 1997,57(21):4667-4672.
[14] Colt JS, Schwartz K, Graubard BI, et al. Hypertension and risk of renal cell carcinoma among white and black Americans[J]. Epidemiology, 2011,22(6):797-804.
[15] Zhang GM, Zhu Y, Ye DW. Metabolic syndrome and renal cell carcinoma[J]. World J Surg Oncol, 2014,12:236.
[16] Liu QJ, Shen HL, Lin J, et al. Synergistic roles of p53 and HIF1alpha in human renal cell carcinoma-cell apoptosis responding to the inhibition of mTOR and MDM2 signaling pathways[J]. Drug Des Devel Ther, 2016,10:745-755.
[17] Bergstrom A, Hsieh CC, Lindblad P, et al. Obesity and renal cell cancer--a quantitative review[J]. Br J Cancer, 2001,85(7):984-990.
牛远杰(E-mail: niuyuanjie9317@163.com)
10.3969/j.issn.1002-266X.2016.46.015
R737.11;R589.1
B
1002-266X(2016)46-0053-03
2016-08-08)
