盐酸吡格列酮对2型糖尿病患者外周血循环祖细胞水平的影响及机制
2017-01-06邹丛胡晓琴刘宏洋刘泽林涂云明胡凤
邹丛,胡晓琴,刘宏洋,刘泽林,涂云明,胡凤
(1南昌大学第四附属医院,南昌330003;2南昌大学附属眼科医院)
盐酸吡格列酮对2型糖尿病患者外周血循环祖细胞水平的影响及机制
邹丛1,胡晓琴2,刘宏洋1,刘泽林1,涂云明1,胡凤1
(1南昌大学第四附属医院,南昌330003;2南昌大学附属眼科医院)
目的 探讨2型糖尿病(T2DM)患者外周血循环祖细胞水平变化及盐酸吡格列酮对循环祖细胞的影响。方法 选择T2DM患者50例,随机分为治疗组30例和对照组20例。对照组采用常规控制血糖治疗,治疗组在常规治疗基础上加用盐酸吡格列酮片口服,两组均治疗12周。采用流式细胞仪检测两组治疗前后外周血白细胞膜上CD34+的表达,计数循环祖细胞;采用酶联免疫吸附法检测两组治疗前后血清内皮素1(ET-1)、超敏C反应蛋白(hs-CRP)水平;采用一氧化氮硝酸还原酶法检测两组治疗前后血清一氧化氮(NO)水平。结果 治疗前,两组外周血循环祖细胞计数差异无统计学意义(P>0.05)。治疗后,治疗组外周血循环祖细胞计数高于对照组(P<0.05)。治疗前,两组血清ET-1、hs-CRP及NO水平差异均无统计学意义(P均>0.05)。治疗后,治疗组血清ET-1、hs-CRP水平低于同组治疗前及对照组,血清NO水平高于同组治疗前及对照组(P均<0.05)。结论 盐酸吡格列酮可升高T2DM患者的外周血循环祖细胞数量,降低血清ET-1、hs-CRP水平,升高血清NO水平。
2型糖尿病;吡格列酮;循环祖细胞;超敏C反应蛋白;内皮素1;一氧化氮
2型糖尿病(T2DM)患者最常见的并发症是大血管和微血管病变,其严重程度与血管内皮损伤和功能障碍的程度密切相关。研究表明,糖尿病时血管内皮细胞受损后的修复细胞主要来源于循环祖细胞[1]。循环祖细胞的主要功能为保护血管内皮的完整性和促进缺血组织的再血管化。研究发现,在高血糖环境下,循环祖细胞数量和功能均降低[3]。CD34被作为循环祖细胞分子的标志物[2]。盐酸吡格列酮是常用的降糖药物,其作用机制为通过激活过氧化物酶体增殖物激活受体-γ(PPAR-γ),影响参与糖代谢的关键酶和蛋白基因的表达,在降低血糖的同时还具有改善血管内膜、延缓动脉粥样硬化的作用[4]。盐酸吡格列酮改善血管内膜的作用是否与调节外周血循环祖细胞的表达有关尚未见相关报道。2015年7月~2016年6月,我们对30例T2DM患者采用盐酸吡格列酮治疗,观察对患者外周血循环祖细胞、超敏C反应蛋白(hs-CRP)、内皮素1(ET-1)、一氧化氮(NO)的影响,探讨盐酸吡格列酮改善T2DM患者血管内皮功能的机制。
1 资料与方法
1.1 临床资料 选择同期在我院治疗的T2DM患者50例,男26例、女24例,年龄40~70(58.5±4.3)岁。均符合1999年WHO制定的T2DM诊断标准。患者均无微血管和大血管病变,病程1~2年。排除标准:1型糖尿病;近期发生过各种炎症性疾病;长期口服降胆固醇药物;妊娠期妇女;大量吸烟(每日吸烟量超过1包);肝肾功能不全;有糖尿病急性并发症及慢性并发症;有冠心病及其他心血管系统疾病,伴或不伴心功能不全。随机分为治疗组30例、对照组20例。两组性别、年龄等差异均无统计学意义。
1.2 治疗方法 对照组给予常规控制血糖治疗,包括调整饮食、适量运动、合理选择口服降糖药(包括磺脲类、非磺脲类促泌剂、α糖苷酶抑制剂、双胍类降糖药物等)。治疗组在常规治疗基础上加用吡格列酮30 mg口服,1次/d。两组均治疗12周。根据血糖水平调整治疗方案,使糖化血红蛋白(HbA1c)稳定在8%以内。
1.3 检测方法
1.3.1 外周血循环祖细胞计数 采用流式细胞仪检测,以外周血白细胞膜上CD34+的表达计数循环足细胞。取两组患者治疗前后静脉全血100 μL,EDTA抗凝,置于FCM测量管中。用三色直接免疫荧光法标记,加入CD34+-FITC荧光单抗,避光孵育20 min,加入溶红细胞液,充分混匀,反应20 min。以1 500 r/min离心5 min,去上清;用PBS洗1遍,收集细胞,上机检测,以CD34+细胞数占白细胞总数的比例计数循环足细胞。
1.3.2 血清ET-1、hs-CRP、NO水平检测 取两组患者治疗前后外周静脉全血100 μL,采用酶联免疫吸附(ELISA)法检测血清ET-1、hs-CRP水平,采用一氧化氮硝酸还原酶法检测血清NO水平。
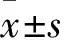
2 结果
2.1 两组外周血循环祖细胞计数比较 治疗前,两组外周血循环祖细胞计数差异无统计学意义(P>0.05)。治疗后,治疗组外周血循环祖细胞计数高于对照组(P<0.05)。见表1。
2.2 两组血清ET-1、hs-CRP及NO水平比较 治疗前,两组患者血清ET-1、hs-CRP及NO水平差异均无统计学意义(P均>0.05)。治疗后,治疗组血清ET-1、hs-CRP水平低于同组治疗前及对照组,血清NO水平高于同组治疗前及对照组(P均<0.05)。见表1。
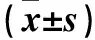
表1 两组外周血CD34+细胞计数、ET-1、hs-CRP及NO水平比较
注:与对照组治疗后比较,*P<0.05;与同组治疗前比较,△P<0.05。
3 讨论
糖尿病血管病变与血管内皮损伤及其功能障碍有密切关系。内皮细胞长期暴露于高血糖的环境中,可引起内皮细胞发生葡萄糖氧化,使活性氧大量生成,导致糖尿病患者内皮细胞的抗氧化贮备明显降低[5]。近年来,循环祖细胞与T2DM血管病变的关系引起了众多学者的关注。
循环祖细胞是指来自骨髓、循环于外周血中、具有祖细胞特征的单个核细胞,是一个混合的祖细胞群体,形态缺乏特征,不易与其他单个核细胞区别。在生理或病理因素刺激下,循环祖细胞可从骨髓动员到外周血参与损伤血管的修复。CD34是高度糖基化的跨膜糖蛋白,可以选择性地表达于各种造血祖细胞膜上,被认为是反映循环祖细胞水平的标志[6]。越是早期的造血祖细胞,CD34+表达越高;随细胞分化、成熟,CD34+表达逐渐减少直至消失。最近研究表明,循环中骨髓来源的CD34+细胞是内皮祖细胞的来源,是与促进血管生成有关的细胞因子的重要来源[7]。研究发现,1型糖尿病及T2DM患者的内皮祖细胞数目均减少,内皮祖细胞的增殖功能受损[8]。Fadini等[5]研究发现,T2DM患者外周血循环祖细胞减少与患者发生血管损伤有关。本课题组前期研究表明,T2DM患者外周血CD34+细胞计数降低,且发生微血管病变的T2DM患者CD34+细胞计数低于单纯T2DM患者,提示T2DM患者发生微血管病变可能与循环祖细胞的数量减少密切相关[9]。因此,作为血管内皮细胞的循环祖细胞,其与T2DM血管病变的关系不容忽视。
盐酸吡格列酮属于噻唑烷二酮类药物,其作用机制为通过调节胰岛素应答基因的转录,增强外周组织和肝脏对胰岛素的敏感性,从而降低血糖水平。盐酸吡咯列酮也可通过激活PPAR-γ,影响参与糖代谢的关键酶和蛋白基因的表达,使引起胰岛素的有关因子如瘦素、肿瘤坏死因子-α(TNF-α)和抵抗素减少[10],从而改善胰岛素抵抗和高胰岛素血症,降低血糖水平。近年研究发现,噻唑烷二酮类药物还具有改善T2DM患者血管内膜的作用,能够延缓动脉粥样硬化的发生[4]。应用吡格列酮后,T2DM患者血糖水平显著降低,与动脉粥样硬化相关的指标如胰岛素抵抗指数、CRP、PAI-1、P-选择素等均显著下降,提示吡格列酮可能具有预防大血管并发症的作用[11]。本研究发现,治疗组治疗后外周血循环祖细胞计数高于对照组,提示吡格列酮对循环祖细胞具有一定保护作用。
循环祖细胞是血管内皮祖细胞和内皮细胞的前体细胞,是干细胞分化成熟过程中的一个阶段。研究发现,存在于外周血中的内皮祖细胞可能参与血管内皮损伤后的修复、血管的新生和损伤血管的再内皮化过程,对维持血管稳定的生物学功能具有重要作用[12]。内皮细胞功能障碍出现在早期糖尿病患者中,内皮细胞功能失调是动脉粥样硬化的早期标志。糖尿病是促进动脉粥样硬化的因素,占糖尿病患者死亡原因的60%~70%[13]。NO、ET-1和hs-CRP等炎症介质是动脉粥样硬化的重要危险因子[14]。动脉粥样硬化时血管内皮细胞受损,产生NO能力下降,ET-1增多,引起血管舒张功能受损、血管痉挛,促进动脉粥样硬化的发展[15]。ET-1和hs-CRP与血管平滑肌细胞增殖、炎症反应关系密切,与动脉粥样硬化的发生及其严重程度有明显的相关性。本研究发现,吡格列酮治疗组治疗前血清ET-1、hs-CRP水平均升高,NO水平降低,治疗后血清ET-1、hs-CRP水平均降低,NO水平升高,提示吡格列酮具有保护血管内皮细胞的作用,能一定程度上改善动脉粥样硬化的相关指标。而吡格列酮保护血管内皮细胞的具体机制有待于进一步阐明,是否通过动员循环祖细胞参与损伤后血管新生与修复,进而改善动脉硬化,需要进一步的探讨。
[1] Hibbert B, Olsen S, O′Brien E. Involvement of progenitor cells in vascular repair[J]. Trends Cardiovasc Med, 2003,13(8):322-326.
[2] McClung JA, Naseer N, Saleem M, et al. Circulating endothelial cells are elevated in patients with type 2 diabetes mellitus independently of HbA(1)c[J]. Diabetologia, 2005,48(2):345-350.
[3] Krnkel N, Adams V, Linke A, et al. Hyperglycemia reduces survival and impairs function of circulating blood-derived progenitor cells[J]. Arterioscler Thromb Vasc Biol, 2005,25(4):698-703.
[4] Patel CB, De Lemos JA, Wyne KL, et al. Thiazolidinediones and risk for atherosclerosis: pleiotropic effects of PPar gamma agonism[J]. Diab Vasc Dis Res, 2006,3(2):65-71.
[5] Fadini GP, Miorin M, Facco M, et al. Circulating endothelial progenitor cells are reduced in peripheral vascular complications of type 2 diabetes mellitus[J]. J Am Coll Cardiol, 2005,45(9):1449-1457.
[6] Gidron A, Singh V, Egan K, et al. Significance of low peripheral blood CD34+cell numbers prior to leukapheresis: what should the threshold required for apheresis be[J]. Bone Marrow Transplant, 2008,42(7):439-442.
[7] Majka M, Janowska-Wieczorek A, Ratajczak J, et al. Numerous growth factors, cytokines, and chemokines are secreted by human CD34(+) cells, myeloblasts, erythroblasts, and megakaryoblasts and regulate normal hematopoiesis in an autocrine/paracrine manner [J]. Blood, 2001,97(10): 3075-3085.
[8] Asai J, Takenaka H, Kusano KF, et al. Topical sonic hedgehog gene therapy accelerates wound healing in diabetes by enhancing endothelial progenitor cell-mediated microvascular remodeling [J]. Circulation, 2006,113(20):2413-2424.
[9] 邹丛,刘建英. 2型糖尿病患者外周血循环祖细胞的变化和临床意义[J]. 江西医学院学报, 2009, 49(7):62-64.
[10] Barbier O, Torra IP, Duguay Y, et al. PLeiotropic actions of peroxisome proliferator-activated receptors in lipid metabolism and atherosclerosis [J]. Arterioscler Thromb Vasc Biol, 2002,22(5):717-726.
[11] 吕小红,杨利波,高云,等.吡格列酮对2型糖尿病患者动脉粥样硬化相关因素的影响[J]. 山东医药, 2010, 50(7):89-90.
[12] 白小涓.内皮祖细胞在动脉粥样硬化易损斑块中的作用[J]. 中国动脉硬化杂志, 2011,19(7):543-546.
[13] Ko GT, Chow CC, Leung G, et al. High rate of increased carotid intima-media thickness and atherosclerotic plaques in Chinese asymptomatic subjects with central obesity[J]. Int J Cardiovasc Imaging, 2011,27(6):833-841.
[14] 蔡久英,翟桂兰,高薇,等.原发性高血压不同时间段左室重构与血管内皮损伤和炎症因子关系的研究[J].中国危重病急救医学, 2008,20(12):743-745.
[15] Shimokawa H. Primary endothelial dysfunction: atherosclerosis[J]. J Mol Cell Cardiol, 1999,31(1):23-37.
江西省卫生和计划生育委员会科技计划项目(20155378)。
10.3969/j.issn.1002-266X.2016.46.011
R587.1
B
1002-266X(2016)46-0041-03
2016-07-27)
