普那菊苣再生体系的优化
2017-01-06张丽君张晓玲
何 真,张丽君,张晓玲
(1.山西省农业科学院,山西太原030031;2.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西太原030031;3.大同市西韩乡农技推广站,山西大同037000)
普那菊苣再生体系的优化
何 真1,张丽君2,张晓玲3
(1.山西省农业科学院,山西太原030031;2.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西太原030031;3.大同市西韩乡农技推广站,山西大同037000)
以普那菊苣叶片、叶柄、茎段为外植体,比较了在含不同激素浓度配比的MS培养基上愈伤组织、芽分化以及根再生的情况,优化普那菊苣组织培养再生体系。结果表明,0.1%HgCl2灭菌8 min时,能有效地去除外植体表面上的微生物,而且对外植体的伤害较轻;叶片、叶柄和茎段均能通过组织培养获得再生植株,其中,叶片外植体诱导效果最佳,茎段外植体诱导效果最差;普那菊苣叶片的极性对愈伤组织的形成以及不定芽的产生没有显著影响;外植体类型是影响愈伤组织、芽分化以及根再生的主要因素。优化的普那菊苣再生体系为:使用叶片外植体,愈伤组织和芽分化诱导培养基为MS+6-BA 1.5 mg/L+IBA 0.2 mg/L+AgNO30.5 mg/L+Vc 0.3 mg/L或MS+KT 1.0mg/L+IAA 0.3mg/L+CH 100mg/L,生根培养基为MS+NAA 0.2mg/L或MS+IBA 0.2mg/L。
普那菊苣;外植体;离体再生;优化
菊苣(Cichorium intybus L.cv.Puna) 为菊科(Asteraceae)菊苣属(Cichorium)多年生宿根双子叶草本植物,为药食两用植物,原产于欧洲。普那菊苣是利用生长在俄罗斯外高加索地区的菊苣株系选育出的饲用品种,1997年全国牧草饲料品种审定委员会登记其为引进牧草新品种[1]。普那菊苣的地下部分可用作制糖原料、咖啡替代品等,地上部分可用作叶类蔬菜或饲料。其主要分布在我国西北、华北等地区。由于干旱、盐碱对普那菊苣的产量造成一定的限制,所以,通过基因工程手段,提高普那菊苣的耐旱、耐盐能力,对改善西北、华北等地区土壤盐碱化具有较大的应用价值。菊苣在美国已被批准为可商业化种植的转基因作物[2-4],目前利用基因工程手段对菊苣的遗传改造已有报道,国外主要采用发根培养及叶盘转化进行遗传转化[5-9],我国主要采用农杆菌介导的外植体进行遗传转化[10-18]。进行遗传转化体研究,首先要建立普那菊苣组织培养植株再生体系。良好的受体系统是普那菊苣遗传转化研究的基础,可显著提高转化效率[19-21]。但普那菊苣在组织培养方面仍存在一些问题,如愈伤组织易玻璃化、褐化,生芽生根率不高。
本研究在前人的工作基础上,以普那菊苣为试验材料,优化普那菊苣的再生体系,提高再生转化率,为下一步提高遗传效率打下坚实的基础。
1 材料和方法
1.1 材料
供试材料为普那菊苣(2n=2x=18),由山西省农业科学院畜牧兽医研究所提供。
1.2 培养基成分及培养条件
1.2.1 培养基 基本培养基为MS培养基,蔗糖浓度为3%(M/V),琼脂用量为0.6%(M/V),附加不同种类和浓度配比的外源激素(表1),pH值为5.4~5.8,于121℃灭菌20min后备用。
1.2.2 培养条件 外植体在温度(28±1)℃,光照强度1300~1500lx,光周期16h(光)/8h(暗)条件下培养。
1.3 方法
1.3.1 外植体的处理 晴天采摘大田里鲜嫩的普那菊苣叶片,流水冲洗30 min,接着在超净工作台上用75%乙醇消毒2 min,0.1%HgCl2中灭菌,再用无菌水冲洗3~5次,并用滤纸吸干叶片表面的水迹。HgCl2浸泡时间设为4,8,12min,每个处理重复3次,每个培养皿接种20个外植体。
1.3.2 愈伤组织诱导、芽的分化及根的诱导 将经过消毒处理后的叶柄、叶片和茎段切成1 cm2或0.5 cm2的小块或段,分别以远轴面(叶背面)和近轴面(叶正面)向上置于愈伤组织诱导培养基中。每个处理重复3次,每个培养皿接种20个外植体,14 d后统计出愈率以及极性对愈伤形成的影响。随后将产生愈伤组织的外植体转移到芽诱导培养基上,进行丛生芽的诱导,14 d继代一次,30 d后统计出芽率。当不定芽长至3cm左右时,将不定芽切下转入生根培养基,进行生根诱导。
出愈率=出现愈伤组织的外植体数/诱导愈伤组织的外植体总数×100%;出芽率=出现不定芽的外植体数/出现愈伤组织的外植体总数× 100%;生根率=生根芽苗数/诱导生根的芽苗总数×100%[22]。
2 结果与分析
2.1 不同消毒时间效果比较
HgCl2浸泡时间为4 min时,叶片消毒不够彻底,不能有效去除外植体表面上的微生物,外植体的污染较高;浸泡时间为8min时,不仅能有效地去除外植体表面上的微生物,而且对外植体的伤害较轻,外植体全部能够形成愈伤组织;浸泡时间为12 min时,外植体表皮的大量细胞死亡,外植体不能形成愈伤组织。因此,HgCl2最佳浸泡时间为8min。2.2 愈伤组织分化
叶柄、叶片和茎段3种外植体均能在含有不同浓度的6-BA+IBA,6-BA+NAA和KT的3种培养基上分化形成愈伤组织(表1)。外植体接种到诱导培养基上3 d后,外植体的边缘或者两端的切口处,开始膨胀形成许多小突起,使外植体发生弯曲,慢慢地突起连成一片,形成墨绿色、绿色或者淡黄色愈伤组织。叶柄外植体在两端切口处形成墨绿色愈伤组织,分化能力强,出芽最早,但出芽率不是很高;叶片外植体形成大面积的深绿色愈伤组织,随着时间的延长愈伤组织布满整个叶片,分化能力强,使叶片外植体成为球状,出芽时间仅次于叶柄,出芽率最高;茎段外植体仅在两端切口处形成浅绿色愈伤组织,但分化能力较差、出芽率低,获得的愈伤组织易褐化。对叶片外植体极性的对比试验结果表明,离体叶片叶背向上和叶正面向上发生不定芽的时间和数量没有显著区别,说明普那菊苣叶片的极性对再生不定芽没有显著影响。6-BA+IBA,6-BA+NAA和KT激素配比的3种培养基,6-BA+IBA形成的愈伤组织容易玻璃化和褐化,添加AgNO3和Vc能明显改善玻璃化和褐化现象,形成的愈伤组织浓绿,质地致密;6-BA+NAA培养基上外植体形成愈伤组织且容易生长不定根,随着时间延长愈伤组织仍然只处于外植体的切口处,不定根不断地长大、长长;KT+IAA培养基上形成较为理想的愈伤组织,颜色浓绿,质地致密,出现芽点的时间较早。
2.3 芽诱导分化
将形成的质地致密、颜色浓绿的愈伤组织外植体转移到新的培养基中,6-BA+IBA,6-BA+NAA和KT的3种培养基均可以诱导芽分化培养。由表1可知,在含有6-BA+IBA的培养基诱导的愈伤组织容易分化出芽,产生的丛生芽个数较多,可以形成放射状生长的不定芽;6-BA+NAA形成的愈伤组织较少,不利于芽分化,产生的丛生芽个数较少;KT+IAA产生的丛生芽个数较多,也可以形成放射状生长的不定芽,虽然诱导的愈伤组织出芽的时间晚于6-BA+IBA,但是KT+IAA培养基中玻璃化现象较少。
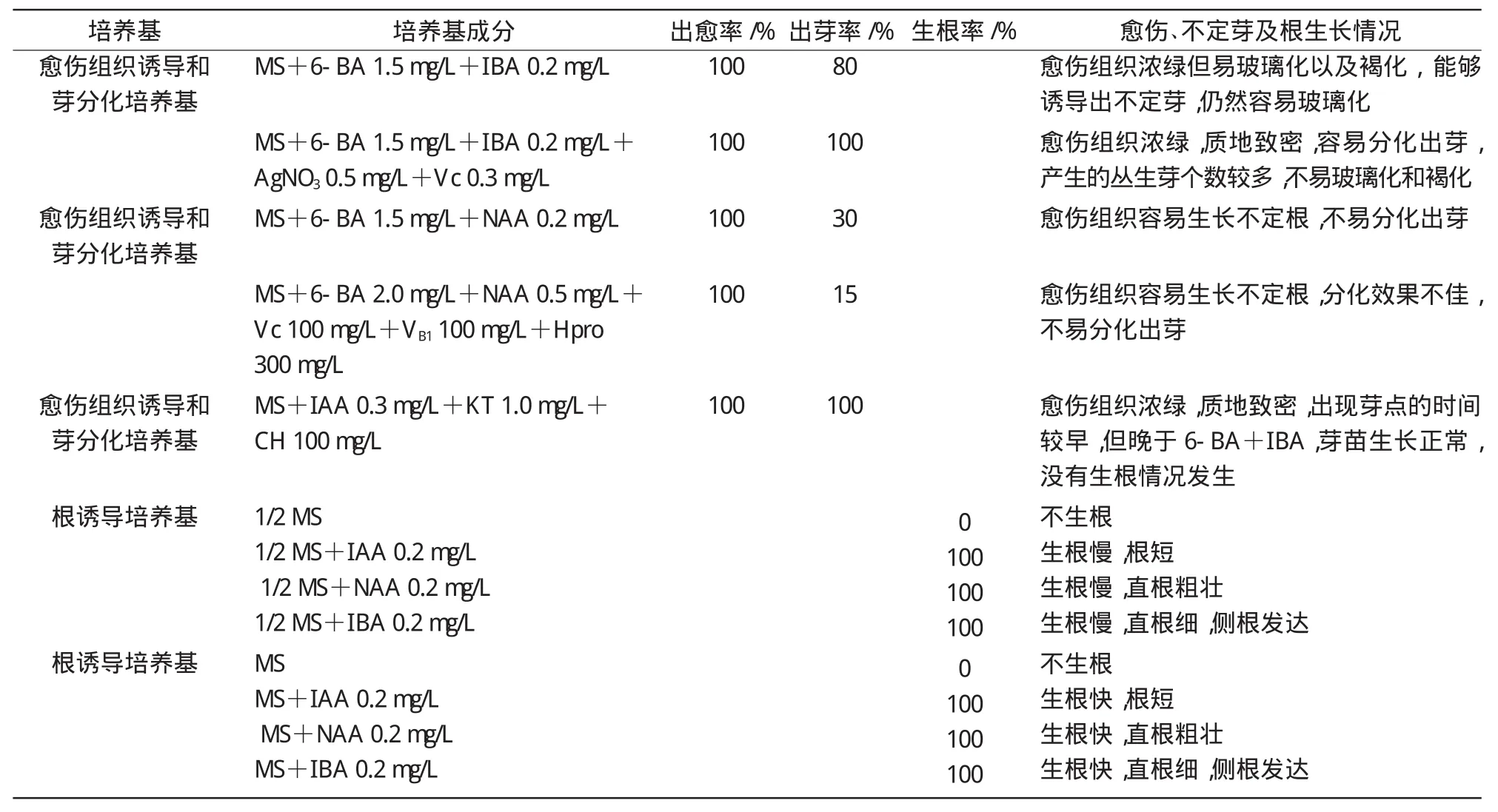
表1 不同激素组合对普那菊苣愈伤组织、不定芽和根形成的影响
2.4 根的诱导分化
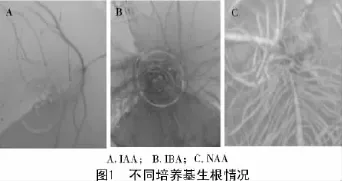
普那菊苣在无激素的MS或1/2 MS根诱导培养基上,诱导率几乎为0。不定芽在含有IAA,NAA,IBA的培养基上均能诱导生根,但是含有激素的1/2 MS和MS培养基相比,MS培养基更适合生根培养。由图1可知,在IAA,NAA,IBA这3种生根培养基中,IAA诱导芽苗生根,但是生根较短,随着时间延长根系生长缓慢甚至停止生长。而MS+NAA,MS+IBA培养基更适合生根,NAA与IBA相比,MS+NAA 0.2mg/L诱导的根系直根更加粗壮,根系长度较短、数量多、密度大;而MS+IBA 0.2 mg/L诱导的直根较细,长势较快,生长后长出许多侧根。
2.5 普那菊苣组织培养再生体系的优化
通过对不同类型外植体的愈伤组织诱导,发现大田直接来源和大田无菌培养来源的材料诱导差异不明显,但各类型外植体之间存在诱导差异,其诱导效果最好的是叶片,叶柄其次,茎段最差。普那菊苣愈伤组织诱导试验结果表明,外植体类型是影响诱导效果的主要因素。普那菊苣再生培养的最佳体系是采用叶片作为外植体,愈伤组织和芽分化诱导培养基为:MS+6-BA 1.5 mg/L+IBA 0.2 mg/L+AgNO30.5mg/L+Vc 0.3mg/L或MS+KT 1.0mg/L+IAA 0.3 mg/L+CH 100 mg/L;生根培养基为:MS+NAA 0.2mg/L或MS+IBA 0.2mg/L。通过该体系可以得到质地致密的愈伤组织、较多的丛生芽以及根系粗壮发达的幼苗。
3 讨论
保存植物种质资源的一个有效途径就是采用组织培养技术快速繁殖亲本材料。外植体的选取、植物激素的配比和适当的繁殖方式是实现高效快速繁殖的重要因素。本研究选用不同激素配比的培养基对普那菊苣外植体进行了再生研究,普那菊苣的叶片、叶柄和茎段均能通过组织培养获得再生植株,其出愈率、出芽率和生根率在适当培养基中均能接近100%。
本研究选用6-BA+IBA,6-BA+NAA和KT的3种培养基进行愈伤组织和芽分化诱导,其中,6-BA具有高效、稳定、廉价和易于使用等特点[23],因此,愈伤组织和芽分化诱导培养基选择MS+6-BA 1.5 mg/L+IBA 0.2 mg/L+AgNO30.5 mg/L+Vc 0.3 mg/L或MS+KT 1.0 mg/L+IAA 0.3 mg/L+CH 100 mg/L。普那菊苣生根是组织培养的一个关键环节,只有根系发达,才能长出健壮的分化苗。
不定芽在含有IAA,NAA或IBA的培养基诱导根的生成,植株表现出较大的差异,IAA诱导的根较短;NAA诱导的根系直根比较粗壮,根长度较短、数量多、密度大;而IBA诱导的直根较细,长势较快、生长后长出许多侧根。因此,应根据不同的试验目的,选择不同激素的生根培养基。
[1]杨亚丽.普那菊苣引种栽培试验 [J].河北农业科学,2008,12(10):21-22.
[2]王佺珍,崔健.牧草菊苣及其利用潜力Ⅰ品种及生产性能[J].草业科学,2010,27(1):144-150.
[3]赵龙,陈丹丹,梁明祥,等.2种菊苣再生体系及遗传转化效率的比较[J].西北植物学报,2012,32(11):2169-2176.
[4]张丽君,程林梅,李贵全,等.影响普那菊苣高效再生相关因素的研究[J].山西农业科学,2008,36(2):69-72.
[5]Frulleux F,Weyens G,Jacob M.Agrobacteriumtumefaciens-mediated transformation of shoot-buds of chicory[J].Plant Cell Tissue andOrganCulture,1997,50(2):107-112.
[6]GeorgeJ,Bais H,Ravishank A R A.Production of escul in by hairy culturesofchicory(Cichorium intybus L.cv.Lucknowlocal)[J].IndianJournal ofExperimental Biology,1999,37(3):269-273.
[7]Bais H P,Venkatese R T,Chandrashekara A,et al.Agrobacterium rhizogenes-mediated transformation of witloof chicory-in vitroshoot regeneration and induction of flowering [J].Current Science,2001,80(1):83-87.
[8]Matvieieva N A,KishchenkoE M,Potrochov A O,et al.Regeneration of transgenic plants from Cichorium intybus L.var. foliosum Hegi hairyroots[J].CytologyandGenetics,2011,45(5):11-16.
[9]MatvieievaNA,VasylenkoMY,ShahovskyA M,etal.EffectiveA-grobacterium-mediated transformation of chicory(Cichorium intybus L.)withMycobacterium tuberculosis antigeneESAT6[J].CytologyandGenetics,2011,45(1):7-12.
[10]程林梅,高洪文,赵茂林.菊苣组织培养与植株再生的研究[J].草业学报,2002,11(4):105-107.
[11]韩晓玲,王玉华.菊苣高效不定芽直接发生及其植株再生[J].核农学报,2006,20(6):482-485.
[12]宋书锋,曹凤.普那菊苣高效再生体系建立和遗传转化研究[J].分子植物育种,2006,4(4):565-570.
[13]程林梅,孙毅,王亦学,等.菊苣农杆菌介导转化受体系统的研究(简报)[J].草业学报,2008,17(1):130-134.
[14]赵宇玮.atnhxl和hvbadhl基因的克隆及对二种植物的转化研究[D].西安:西北大学,2007.
[15]程林梅,孙毅,张丽君,等.转抗坏血酸过氧化物酶基因(APX)菊苣抗旱相关生理特性 [J].西北农业学报,2013,22(5):124-130.
[16]张丽君,程林梅,杜建中,等.导入TaNHX2基因提高了转基因普那菊苣的耐盐性[J].生态学报,2011,31(18):5264-5272.
[17]张丽君,程林梅,杜建中,等.导入APX基因提高了普那菊苣植株的抗逆性[J].草地学报,2012,20(1):152-158.
[18]张丽君,程林梅,杜建中,等.农杆菌介导普那菊苣遗传转化体系的建立[J].草地学报,2011,19(6):1042-1050.
[19]张丽君,刘龙龙,马名川,等.燕麦成熟胚组织培养体系的优化及其影响因素[J].山西农业科学,2015,43(3):269-272.
[20]马建华,张瑾华,胡变芳,等.不同基因型对小麦基因枪转化的再生[J].山西农业科学,2014,42(12):1245-1247.
[21]王奕,范俊山,尚丽霞,等.玉米幼胚再生体系的建立[J].华北农学报,2015,30(5):130-134.
[22]宋莉,赵德刚.百脉根离体再生体系的优化[J].分子植物育种,2015,13(4):910-914.
[23]杜兆伟,郑唐春,李爽,等.小黑杨快繁与再生体系的优化[J].植物研究,2015,35(6):904-907.
Study on Optimization of Regeneration System of Puna Chicory
HE Zhen1,ZHANG Lijun2,ZHANG Xiaoling3
(1.Shanxi AcademyofAgricultural Sciences,Taiyuan030031,China;2.KeyLaboratoryofCropGeneResourcesandGermplasm EnhancementonLoessPlateau,MinistryofAgriculture,Shanxi KeyLaboratoryofGenetic ResourcesandGenetic Improvement ofMinorCrops,InstituteofCropGermplasmResources,Shanxi AcademyofAgricultural Sciences,Taiyuan030031,China;3.DatongXihanTownshipAgricultural TechnologyExtensionStation,Datong037000,China)
Optimization of Puna chicory regeneration system improves the Puna chicory regeneration efficiency.Chicory leaf segments,petiolesegments,stemsegments wereused as experimental materials.Theexplants wereinoculated ontotheMS mediumwith various phytohormone combinations to induce callus formation,and bud and root regeneration.The paper analyzed the effects of phytohormone concentrations and combinations on the induction of callus,buds and roots.The result showed that the most appropriate sterilizedtimewas8 minwith0.1%HgCl2andunderthesecircumstancesinjury onexplantscouldbelessenandmicrobesonthesurface of plant could be eliminated effectively.Callus and adventitious buds could be easily and efficiently induced fromPuna chicory leave, petiole.Leavesegments hadthebest inducingeffect,whilestemsegments hadtheworst.Explants typewas themajor factor affecting the callus,adventitious bud and root induction.Optimummediums for the induction of callus,adventitious bud and root was MS+6-BA 1.5mg/L+IBA 0.2mg/L+AgNO30.5mg/L+Vc 0.3mg/L orMS+KT 1.0mg/L+IAA 0.3mg/L+CH 100mg/L andMS+NAA 0.2 mg/L orMS+IBA 0.2mg/L,basedonusingleaveexplants.
Punachicory;explants; in vitro regeneration;optimization
S548
A
1002-2481(2016)07-0910-04
10.3969/j.issn.1002-2481.2016.07.05
2016-04-19
山西省自然基金项目(2014011030-1);山西省国际合作项目(2014081032-1)
何 真(1972-),女,重庆涪陵人,助理研究员,主要从事作物栽培研究工作。张丽君为通信作者。
