MSCT对缺血性肠病的诊断价值
2017-01-06蔡红法杨骁驰赵文娟钮恩斌
蔡红法,杨骁驰,赵文娟,钮恩斌
1.南京医科大学附属苏州医院(苏州市立医院东区) 放射科,江苏 苏州215001;2.苏州市中医医院 放射科,江苏 苏州 215000
MSCT对缺血性肠病的诊断价值
蔡红法1,杨骁驰2,赵文娟2,钮恩斌1
1.南京医科大学附属苏州医院(苏州市立医院东区) 放射科,江苏 苏州215001;2.苏州市中医医院 放射科,江苏 苏州 215000
目的分析缺血性肠病的多层螺旋CT(MSCT)表现,探讨MSCT对该病的诊断价值。方法回顾性分析30例经病理证实为缺血性肠病患者的临床资料和MSCT表现。结果在30例患者中,MSCT表现为肠壁增厚19例(其中表现为可逆性缺血17例,表现为不可逆性缺血2例),肠壁变薄8例(均表现为不可逆性缺血),肠壁无明显增厚或变薄1例,肠壁增厚与变薄并存2例。在可逆性肠缺血患者中,肠壁出现分层强化呈“靶征”11例,肠壁强化正常或增加3例,肠腔扩张、积液10例;在不可逆性肠缺血患者中,强化减弱或无强化7例,肠腔扩张、积液2例。在30例患者中,肠系膜水肿、浑浊22例,4例合并腹水;肠壁和/或门脉积气9例。结论肠系膜动脉狭窄或闭塞易导致肠系膜不可逆性缺血,通常可引起肠壁变薄;而可逆性肠系膜缺血多表现为肠壁不同程度的增厚。MSCT能快速、准确地诊断缺血性肠病,并能对其发病原因、病变范围、病情程度等作出准确评估。
缺血性肠病;多层螺旋CT;肠壁增厚;肠腔积液
缺血性肠病是由多种原因所致的支配肠道的血运产生障碍而引发的肠缺血性疾病,在临床上可分为急性肠系膜缺血(Acute Mesenteric Ischemia,AMI)、慢性肠系膜缺血(Chronic Mesenteric Ischemia,CMI)。患者临床症状及体征不典型、并发症多、易误诊、死亡率极高,是临床上严重的急腹症之一,占所有胃肠道疾病的2%左右[1]。近年来,随着饮食结构的改变及人口老龄化的加速,缺血性肠病的发病率不断上升。多层螺旋CT(Multi-slice Spiral CT,MSCT)是缺血性肠病的一种无创性检查手段,随着多种扫描技术及后处理技术的应用,MSCT已经能够清楚显示肠管及肠系膜血管病变。本研究旨在探讨应用MSCT在诊断缺血性肠病并寻求其潜在病因方面的临床价值。
1 材料与方法
1.1 一般资料
回顾性分析本院2009年1月~2015年1月经临床诊断或手术病理证实的30例缺血性肠病患者的临床资料。所有患者均接受CT检查,其中6例患者进行了手术;男19例,女11例;年龄31~81岁,平均66.7岁;可逆性缺血20例,不可逆性缺血10例。所有患者均以腹痛为首发表现,且以脐周和中下腹痛为主,恶心、呕吐、腹胀12例,腹泻10例,肛门停止排便、排气3例,出现腹膜炎体征9例,发热及感染中毒性休克1例;5例有高血压病史(2例伴有房颤),2例有腹部外伤史,1例有肝炎合并肝硬化。所有患者病程为1 d~2月。
1.2 检查方法
采用飞利浦Brilliance 64排128层纳米螺旋CT,扫描参数为:管电压120 kV,管电流250 mAs,层厚5 mm,螺距0.625,扫描范围从膈顶至耻骨联合,7例行常规平扫,23例行平扫加增强扫描,造影剂选用300 mg/mL优维显80~100 mL,跟注无菌生理盐水30~40 mL,采用高压注射器,经前臂肘静脉团注,流速3~4 mL/s,行动脉期(25~30 s)、静脉期(55~60 s)双期扫描。原始图像经薄层重建后传至工作站,重建层厚为1 mm,重建间隔为1 mm。通过平面重组(MPR)、最大密度投影(MIP)、容积再现(VR)、曲面重建(CPR)及血管三维重建(CTA)等方法进行图像后处理。所有图像均经两位影像诊断主任医师进行评价,得出一致意见。
2 结果
2.1 MSCT诊断结果
30例患者中,MSCT诊断肠系膜上动脉(Superior Mesenteric Artery,SMA)栓塞或血栓形成8例(26.7%);肠系膜上静脉(Superior Mesenterie Vein,SMV)及属支血栓形成10例(33.3%),其中4例经手术证实为SMV血栓;肠系膜下动脉(Inferior Mesenteric Artery,IMA)栓塞或血栓形成2例(6.7%);SMA夹层2例(6.7%);SMA主干和/或分支硬化性狭窄4例(13.3%)。MSCT诊断肠梗阻2例(6.7%),后经手术证实为腹内疝;非阻塞原因(心功能不全)2例(6.7%),未明确病因,后经临床证实。
2.2 缺血性肠病的主要CT征象
(1)肠壁增厚(图1、2)19例,厚度为5.5~16.2 mm,平均(8.85±2.91)mm,其中可逆性缺血17例,不可逆性缺血两例。肠壁变薄(图3、4)8例,均为不可逆性缺血,厚度为2~3.6 mm,平均(2.93±0.55)mm。肠壁无明显增厚或变薄1例。肠壁增厚与变薄并存2例(图5)。
(2)肠壁密度改变。20例可逆性缺血病例中,15例平扫肠壁密度减低,2例密度正常,3例密度增高或增高与减低并存;10例不可逆性缺血病例中,9例平扫肠壁密度无特异性改变,1例表现为肠壁密度增高。
(3)肠壁异常强化。23例增强扫描病例中,16例为可逆性肠缺血,其中有11例出现肠壁分层强化呈“靶征”(图1、图9),3例肠壁强化正常或增加,2例非阻塞性原因(心功能不全)病例肠壁密度无明显改变,增强后肠壁出现部分强化(图7);7例为不可逆性肠缺血,均表现为肠壁强化减弱或无强化。
(4)肠系膜改变。30例患者中,出血肠系膜充血水肿浑浊22例,表现为肠系膜血管增粗、充血,系膜脂肪密度增高,呈“云雾状”、“缆绳征”(图9),其中4例合并腹水。
(5)肠腔扩张12例,其中可逆性缺血10例,不可逆性缺血2例,表现为节段性肠管管腔扩大,管腔内出现积气、积液(图1)。
(6)肠壁积气9例(图1),其中合并门静脉积气1例。
(7)CTA结果。所有增强扫描患者行肠系膜动、静脉重建,血管异常者阳性率为100%(23/23)。其中,肠系膜血管栓塞或血栓形成在CTA上表现为相应血管的充盈缺损(图2、图4);SMA/IMA夹层表现为病变血管增粗,血管内可见内膜瓣、内膜破口和双腔征(图8);SMA/IMA粥样硬化性狭窄在CT平扫上表现为动脉主干及属支钙化斑块,CTA上表现为相应血管狭窄或闭塞(图6)。
(8)其他:腹内疝2例(图9),表现为闭襻性肠梗阻,梗阻近端肠腔扩张、积液,肠壁增厚、水肿。缺血性肠病患者的MSCT表现,见表1。
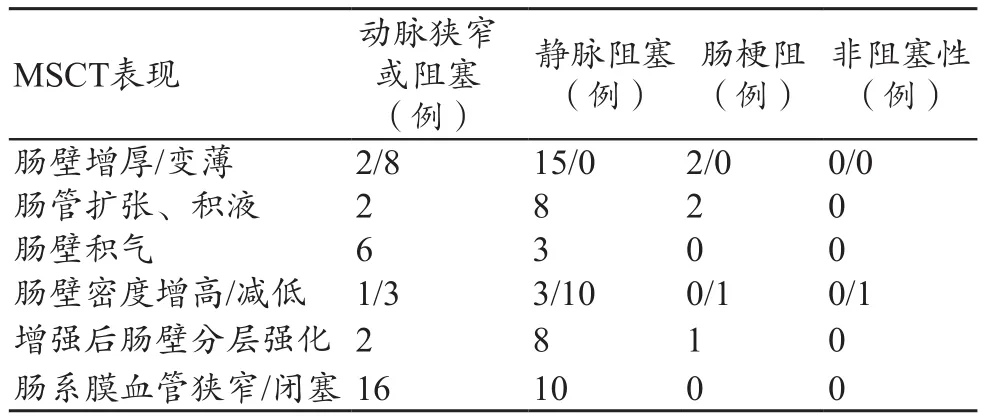
表1 缺血性肠病患者的MSCT表现(例)
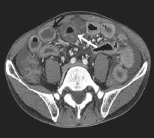
图1 患者男,49岁,SMV血栓,轴位增强扫描示肠管扩张,小肠壁广泛增厚、水肿,肠壁分层强化呈“靶征”(白箭),肠壁间可见积气(黑箭),并见腹水。

图2 与图1为同一患者,冠状位MPR示SMV管径增粗,内见条状血栓形成(白箭)。
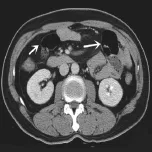
图3 患者男,45岁,SMA血栓,轴位增强扫描示小肠壁明显变薄呈纸样(白箭)。
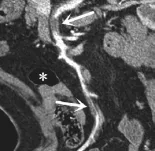
图4 与图3为同一患者,CPR示SMA多发血栓形成(白箭),肠壁变薄(*)。
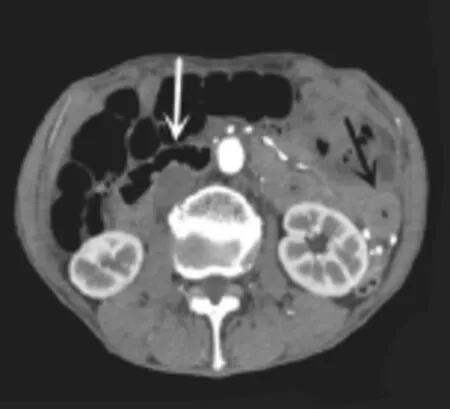
图5 患者男,80岁,SMA粥样硬化性狭窄,轴位增强扫描示肠壁增厚(黑箭)与变薄(白箭)并存。
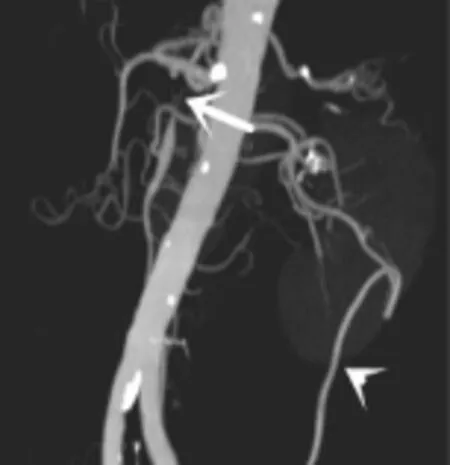
图6 与图5为同一患者,矢状位MIP示SMA起始部重度狭窄(白箭),腹主动脉壁多发钙化,并见riolan血管弓(白箭头)形成。
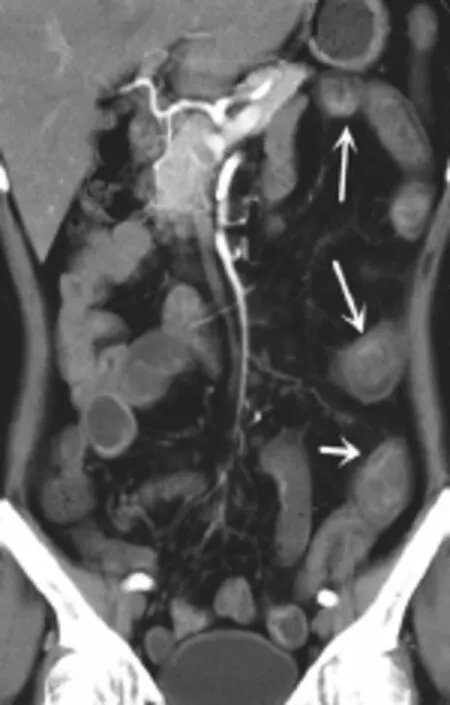
图7 患者女,54岁,心功能不全,冠状位MPR示SMA及分支稀疏,管腔变细,肠壁的肠系膜对侧缘强化程度低于肠系膜侧,表现为部分强化(白箭)。
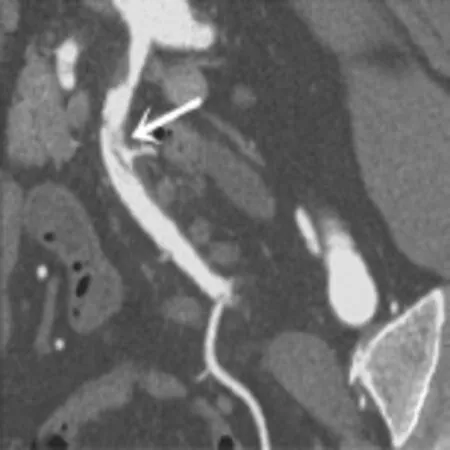
图8 男,50岁,SMA主干夹层动脉瘤,CPR示SMA主干管径增粗,血管内可见内膜瓣、内膜破口和“双腔征”(白箭),并见附壁血栓。

图9 女,35岁,腹内疝,疝颈位于降结肠(△)和左侧腰大肌(*)之间,肠壁增厚,可见“靶征”(白箭),肠系膜浑浊。
3 讨论
3.1 缺血性肠病病因
缺血性肠病主要病因包括:肠系膜动脉阻塞(60%~70%)、静脉阻塞(5%~10%)、肠梗阻(10%)及非阻塞性低灌注状态(20%),上述病因所致缺血性肠病在本组的发病率分别为53.3%、33.3%、6.7%、6.7%,与报道[2]并不一致,考虑与样本较小有关。
肠系膜动、静脉阻塞的病因包括栓塞或血栓形成、动脉粥样硬化、血管炎、主动脉或肠系膜动脉夹层等[3];非阻塞性病因包括门静脉高压导致肠系膜静脉血流缓慢、心力衰竭或休克引起血容量急剧降低或血压下降等;肠道肿瘤、肠扭转或内疝或肠套叠等肠梗阻导致肠系膜血管受压绞窄亦可造成缺血[4-5]。缺血性肠病可累及整个消化道。
3.2 临床表现
急性肠系膜缺血因肠壁缺血、痉挛收缩可导致剧烈腹痛,患者可表现为绞痛,随着病情进展,可逐步出现肠坏死及腹膜炎表现,如腹部反跳痛、肌紧张等[6]。慢性肠系膜缺血患者主要表现为腹部钝痛或隐痛,始于上腹部并逐渐放射至全腹部,进食后加剧,由于肠道缺血导致肠功能紊乱,也可以出现恶心、呕吐、嗳气、腹胀、腹泻等症状。同时,肠黏膜及黏膜下层因缺血、缺氧可导致糜烂、溃疡、水肿、出血等,临床上患者可出现便血。以上临床症状及体征缺乏特异性,容易延诊、漏诊、误诊,有报道该病死亡率高达50%~90%[7]。
3.3 CT表现及病理基础
3.3.1 肠壁厚度改变
正常肠壁厚约3~5 mm,小肠肠壁厚度>4 mm,结肠壁厚度>5 mm即被认定为增厚。缺血时肠壁可增厚或变薄,其中,可逆性肠缺血患者肠壁增厚更为常见,肠壁变薄则多见于不可逆性缺血患者。动脉狭窄或闭塞导致的肠系膜缺血,在急性期通常可引起肠壁变薄,其原因主要是动脉狭窄或闭塞后,肠系膜因供血动脉受阻而引流静脉通畅,肠壁及肠粘膜既无水肿也无出血;在病理上,肠壁内组织细胞因缺血体积减小,粘膜和肌层内血管闭塞,肌紧张减弱或消失,表现为肠壁菲薄[8],本组10例不可逆性肠缺血患者中,有8例CT表现为肠壁变薄。而在非闭塞性肠系膜动脉缺血以及缺血慢性期,由于侧枝循环的建立及再灌注,粘膜出现水肿、出血,本组17例可逆性肠缺血、2例慢性肠系膜动脉缺血患者CT表现为肠壁不同程度增厚。
3.3.2 肠壁密度改变
肠系膜缺血时,肠壁密度可高可低。粘膜水肿可导致肠壁密度减低,而粘膜充血或出血则可导致肠壁密度增高。通常,静脉回流障碍引起的肠缺血容易引起肠壁密度改变;而动脉阻塞引起的缺血仅在接受再灌注后才可能导致上述改变[9]。
3.3.3 增强后肠壁强化改变
肠系膜缺血时肠壁可表现出多种异常强化现象[10]:肠壁强化衰减是肠壁缺血的重要特征之一[11],主要见于肠系膜动脉缺血,表现为肠壁强化程度明显下降或持续无强化,本组有7例,均为肠系膜动脉性缺血。肠壁过度或提前强化可见于静脉阻塞、肠梗阻引起的缺血以及动脉阻塞再灌注后,肠壁充血、灌注增加[10],本组有3例,其强化方式分粘膜层强化、粘膜下层强化和全层强化。非阻塞性原因引起的肠缺血肠壁常呈现不均匀强化,典型者表现为肠壁肠系膜对侧缘强化程度低于肠系膜侧[9],本组有两例低血压休克病人的肠壁强化方式符合上述表现。
肠系膜静脉缺血因静脉回流受阻,粘膜充血、肿胀甚至出血,并可累及粘膜下层和肌层,CT主要表现为粘膜水肿、肠壁增厚,可出现“靶征”,其病理机制为:粘膜水肿、糜烂,CT增强后强化减弱或无强化呈低密度(内环),粘膜下血管过度充血、出血、溃疡形成,增强后相对强化呈稍高密度(中环),以及增厚的肌层强化相对增加呈高密度(外环)[12],本组共有11例肠系膜静脉狭窄或闭塞患者的CT影像出现“靶征”。
3.3.4 肠壁的其他影像学改变
随着肠系膜缺血病程的进展,肠肌因贫血、缺氧、炎症致张力减低而肠腔扩张;静脉回流受阻引起静脉压增高,导致血浆向血管外渗漏,肠腔内及腹腔大量渗血渗液,肠蠕动减弱或消失。本组病例中出现肠腔扩张积液12例,其中合并腹腔内游离积液4例。肠壁积气来源于肠腔,气体经坏死、糜烂的黏膜进入黏膜下、肌层,CT表现为沿肠壁周边分布的囊状、线状或弧线状气体,可表现为孤立气泡或呈广泛的带状气体应。有时气体会穿过肠壁进入肠系膜静脉或肝门静脉分支产生相应静脉积气,这些征象通常提示透壁性梗死,要立即进行手术。本组共有9例患者出现肠壁和/或门脉积气。
3.4 病因判断
通过多平面重组(MPR)、最大密度投影(MIP)、容积再现(VR)、曲面重建(CPR) 及CTA重建等方法对MSCT图像进行三维重建[12],其最大优势在于可多视角、多模式观察,不仅能够观察血管的管腔,还能够提供肠管管壁的病理表现及相邻血管与组织结构的情况等信息,可揭示缺血性肠病的病因及病情发展程度[13-15]。CTA对于闭塞性肠系膜缺血诊断的灵敏度可达到96%,特异性可达到94%,对非闭塞性肠系膜缺血,既往观点认为CT灵敏度较差,但有学者认为,应用MSCT观察血管管腔的形态及内径,可对非闭塞性肠系膜缺血作出早期诊断[16]。对于肠梗阻病例,MSCT能显示其肠梗阻范围及程度,并揭示肠梗阻病因,本组有两例患者乃腹内疝所致肠缺血,MSCT能清晰显示其疝环、疝口以及绞窄的肠系膜血管。
总之,MSCT能敏感、快速而准确地诊断急性缺血性肠病,并能揭示病因、病变范围及病情程度等,能及时为临床治疗提供可靠的信息依据。急腹症患者尤其是怀疑急性缺血性肠病患者应首选MSCT检查。
[1] Mazzei MA,Mazzei FG,Marrelli D,et al.Computed tomographic evaluation of mesentery: diagnostic value in acute mesenteric ischemia[J].J Comput Assist Tomogr,2012,36(1):1-7.
[2] Furukawa A,Kanasaki S,Kono N,et al.CT diagnosis of acute mesenteric ischemia from various causes[J].AJR Am J Roentgenol,2009,192(2):408-416.
[3] Wiesner W,Khurana B,Ji H,et al.CT of acute bowel ischemia[J].Radiology,2003,226(3):635-650.
[4] Segatto E,Mortele KJ,Ji H,et al.Acute small bowel ischemia: CT imaging findings[J].Semin Ultrasound CT MR,2003,24(5):364-376.
[5] Furukawa A,Kanasaki S,Kono N,et al.CT diagnosis of acute mesenteric ischemia from various causes[J].AJR Am J Roentgenol,2009,192(2):408-416.
[6] 秦耿,赵洪川.缺血性肠病的诊治现状及进展[J].中日友好医院学报,2012,26(2):112-114.
[7] Elder K,Lashner BA,Al SF.Clinical approach to colonic ischemia[J].Cleve Clin J Med,2009,76(7):401-409.
[8] Horton KM,Fishman EK.Multidetector CT angiography in the diagnosis of mesenteric ischemia[J].Radiol Clin North Am,2007,45(2):275-288.
[9] Chou CK.CT manifestations of bowel ischemia[J].AJR Am JRoentgenol,2002,178(1):87-91.
[10] 王豪杰,朱希松.16层螺旋CT诊断缺血性结肠炎的临床价值[J].医学影像学杂志,2013,23(4):558-562.
[11] Geffroy Y,Boulay-Coletta I,Julles MC,et al.Increased unenhanced bowel-wall attenuation at multidetector CT is highly specific of ischemia complicating small-bowel obstruction[J].Radiology,2014,270(1):159-167.
[12] 胡明成,包权,邢健,等.MSCT对粘连带型腹内疝所致肠梗阻的临床诊断价值[J].中国医疗设备,2014,29(7):172-173.
[13] Saba L,Mallarini G.Computed tomographic imaging findings of bowel ischemia[J].J Comput Assist Tomogr,2008,32(3):329-340.
[14] Kirkpatrick ID,Kroeker MA,Greenberg HM.Biphasic CT with mesenteric CT angiography in the evaluation of acute mesenteric ischemia: initial experience[J].Radiology,2003,229(1):91-98.
[15] 叶泳松,刘波.螺旋CT三维重建技术在肠系膜缺血性肠病中的应用[J].广州医学院学报,2011,39(1):29-31.
[16] Woodhams R,Nishimaki H,Fujii K,et al.Usefulness of multidetector-row CT (MDCT) for the diagnosis of nonocclusive mesenteric ischemia (NOMI):assessment of morphology and diameter of the superior mesenteric artery (SMA) on multi-planar reconstructed (MPR) images[J].Eur J Radiol,2010,76(1):96-102.
Effectiveness of Application of MSCT in Diagnosis of Intestinal Ischemia
CAI Hong-fa1, YANG Xiao-chi2, ZHAO Wen-juan2, NIU En-bin1
1. Department of Radiology, Suzhou Hospital Affiliated to Nanjing Medical University (Suzhou Municipal Hospital East District), Nanjing Medical University, Suzhou Jiangsu 215001, China; 2. Department of Radiology, Suzhou Traditional Chinese Medical Hospital, Suzhou Jiangsu 215000, China
ObjectiveTo investigate the clinical effectiveness of application of multi-slice spiral CT (MSCT) in diagnosis of intestinal ischemia.MethodsThe MSCT fndings in 30 patients with intestinal ischemia confrmed by clinic or pathology were retrospectively analyzed.ResultsAmong 30 cases, 19 cases showed bowel wall thickening, of which 17 cases were reversible mesenteric ischemic and 2 cases were irreversible ones. 8 cases with thinner bowel wall were irreversible mesenteric ischemia exclusively, 1 case showed no obviously bowel wall thickening or thinner, 2 cases showed bowel wall thickening and thinner simultaneously. On contrast-enhanced CT, 11 cases showed target appearance; 3 cases showed enhanced or normal and 10 cases showed luminal dilation in reversible mesenteric ischemic. The bowel walls were no or diminished enhanced in 7 cases, and 2 cases showed luminal dilation in irreversible mesenteric ischemia. 22 cases were revealed with mesenteric edema and 4 cases with ascites and 9 cases with pneumatosis. The etiology was confrmed in all of the 30 cases.ConclusionThe bowel wall usually became thinner in irreversible mesenteric ischemia cases caused by stenosis or occlusion of SMA/IMA, while thicker in reversible mesenteric ischemic cases. Intestinal ischemia can be diagnosed accurately by MSCT in most cases, and it is of great value to determine the extent and etiology of intestinal ischemia.
mesenteric ischemic; multi-slice spiral computed tomography; intestinal wall thickening; intestinal effusion
TH774
B
10.3969/j.issn.1674-1633.2016.06.015
1674-1633(2016)06-0065-05
2015-09-15
2016-04-06
赵文娟,主治技师。
通讯作者邮箱:769604269@qq.com
