常压室温等离子体诱变(ARTP)及高通量筛选高产蛋白酶米曲霉的初探
2017-01-06舒冬梅王德良宋绪磊尚柯
舒冬梅,王德良,宋绪磊,尚柯
(1.新疆农业大学 食品科学与药学学院,乌鲁木齐 830052;2.中国食品发酵工业研究院,北京 100015)
常压室温等离子体诱变(ARTP)及高通量筛选高产蛋白酶米曲霉的初探
舒冬梅1,王德良2*,宋绪磊2,尚柯1
(1.新疆农业大学 食品科学与药学学院,乌鲁木齐 830052;2.中国食品发酵工业研究院,北京 100015)
为提高酱油发酵菌种米曲霉的蛋白酶活力,采用实验室保藏菌种H0米曲霉为诱变出发菌株,对H0菌株进行常压室温等离子体诱变(ARTP),诱变条件:功率120 W;气流量10 L/min;10个时间梯度处理。结果表明:当诱变时间为140 s时,致死率接近90%,此时为最佳诱变时间。利用大豆球蛋白作为选择培养基关键因子进行初筛和96孔板高通量复筛,选出3株高蛋白酶活力菌株H5,H12,H15,并且经过福林酚法验证。最终筛选出米曲霉菌株H15具有高蛋白酶活力:酸性、中性、碱性蛋白酶活力分别为192.35,1816.31,3774.82 U/g,比出发菌株H0分别提高17.49%,19.08%,10.66%。
常压室温等离子体诱变(ARTP);高通量筛选;蛋白酶活力
酱油的酿造是以微生物为动力,将原料中的蛋白质、糖类、脂类等经过复杂的生物化学反应,生成多糖、单糖、氨基酸、多肽、酯类、风味物质等的一系列过程。目前酱油微生物中研究较多的微生物是米曲霉,主要是因为米曲霉产生的酶系丰富并且各种酶系综合作用对酱油风味的形成起重要作用,其中起关键作用的是蛋白酶,米曲霉分泌的蛋白酶使原料中的蛋白质降解生成氨基酸,提高酱油氨基酸含量[1]。目前我国大多数酱油厂采用沪酿3.042以及经过诱变后选育的新菌株,但是其蛋白酶活力依然不够高,导致我国酱油原料蛋白利用率在80%左右,而日式酱油这个指标已经达到90%[2]。
米曲霉菌种的诱变方法包括物理、化学方法,前人对于米曲霉菌种诱变方法有多种[3-7]。袁艳玲等人以米曲霉Y0为出发菌株,通过紫外线与DES复合诱变,0.4%干酪素培养基初步筛选,获得1株高产中性蛋白酶菌株H2-5,其中性酶活力为2158 U/g,经10代培养,菌株中性蛋白酶活力具有良好的遗传稳定性[8]。另外,近几年ARTP(常压室温等离子体)诱变方法应用的兴起为微生物诱变选育提供了新的方法和思路。由于ARTP诱变产生等离子体均匀,射流温度低,需氦气装置,操作简便,对细胞与生物大分子作用明显等优势[9,10],此方法应用广泛,如化学净化剂、热敏感性医疗仪器消毒以及生物方面[11]。研究已报道其应用于酵母、大肠杆菌、刺糖多孢菌、米曲霉等微生物诱变并取得良好效果[12-15]。本试验在参考各种文献的基础上结合生产实践创新试验方法,利用新型ARTP诱变育种方法诱变米曲霉,采用透明圈法和96孔板法建立高通量筛选突变菌株的方法,并获得高产蛋白酶的米曲霉突变株,提高米曲霉分解蛋白的能力,从而提高酱油中氨基酸含量,提高酱油质量和国际竞争力。
1 材料和方法
1.1 菌株
米曲霉(Aspergillusoryzae)H0菌株为本实验室保藏。
1.2 试剂与仪器
大豆球蛋白 百灵威公司;实验室制麦汁、茚三酮、果糖、磷酸氢二钾、磷酸二氢钠、碘酸钾、福林酚试剂(均为分析纯) Bitopped 公司。
恒温生化培养箱,水浴锅(控温精度±0.1 ℃) 北京天林恒泰科技有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;ARTP-II型ARTP诱变育种机 无锡源清天木生物科技有限公司;涡旋仪MVS-1 北京东方开物科学器材有限公司;立式电热压力蒸汽灭菌器 上海申安医疗器械厂;UV-1700可见分光光度计 岛津公司;PHS-3C pH计 雷磁有限公司;恒温电子天平AL204 梅特勒-托利多仪器(上海)有限公司。
1.3 培养基的配制和灭菌
菌种保藏培养基:马铃薯培养基。
大豆球蛋白筛选培养基[16]:大豆球蛋白1 g,磷酸二氢钠1.07 g,磷酸氢二钠1 g,硫酸镁0.5 g,硫酸亚铁0.01 g,琼脂20 g,蒸馏水1000 mL,121 ℃灭菌30 min。
0.1%干酪素培养基:干酪素1 g,磷酸二氢钠1.07 g,磷酸氢二钾0.36 g,硫酸镁0.5 g,硫酸亚铁0.002 g,蒸馏水1000 mL,121 ℃灭菌 30 min。
麸曲培养基:250 mL的三角瓶,装料量为麸皮15 g,水15 mL,自然pH,121 ℃灭菌30 min。
1.4 氨基氮测量试剂盒溶液
显色剂:称取磷酸氢二钠(Na2HPO4·12H2O)20 g,磷酸二氢钾(KH2PO4)12 g,超声溶解,加入茚三酮1.0 g和果糖0.6 g(精确至0.01 g),混匀,用水溶解并定容至200 mL。将溶液贮藏在棕色瓶中,放置4 ℃冰箱保存,1周内使用有效。
稀释溶液:称取碘酸钾(KIO3)2 g(精确至0.01 g)溶于620 mL水中,超声溶解,加入99.7%乙醇380 mL,混匀,于4 ℃贮存。
甘氨酸标准储备液(1.072 g/L):称取甘氨酸0.1072 g,用水溶解并定容至100 mL,于0~5 ℃贮存。
甘氨酸标准使用液:吸取甘氨酸标准贮备液1 mL,用水稀释至100 mL。该标准使用液含游离氨基氮2 mg/L,使用时现配制。
1.5 生长曲线绘制
将米曲霉从试管斜面转接到PDA平板上,28 ℃培养72 h。将活化好的米曲霉用接种环接3环到装有已灭菌12°麦汁的三角瓶中,自保藏斜面中挑取3环米曲霉孢子接入装有10 mL无菌麦汁培养基的试管中,摇匀,制成孢子悬液,于28 ℃培养箱中培养活化24 h。将10 mL菌悬液倒入装有300 mL无菌麦汁培养基的三角瓶中,摇匀,制成孢子悬液,于28 ℃培养箱中摇床培养。
取14个2 mL的离心管,称重并分别记录离心管的重量,精确到0.0001 g。吸取1 mL的12°麦汁和200 μL的1.5×105的活化菌液,置于28 ℃摇床培养。于培养后的第0,4,8,12,16,20,24,28,32,36,40,48,52,56 h取出相应标号的离心管,置于4 ℃冰箱保存。待全部离心管取出,统一8000 r/min,离心15 min。60 ℃烘干3 h,称量重量,精确到0.0001 g。

1.6 ARTP诱变
1.6.1 菌悬液制作
将活化好的米曲霉菌种接种于PDA培养基上,培养温度28 ℃,培养18~24 h是对数期,本试验采用对数期36 h时的米曲霉,将对数期的米曲霉用0.8%生理盐水调其浓度,在光学显微镜下计数,将菌浓度调至1×106~1×108cfu/mL。本试验最终米曲霉菌孢子浓度为2×106cfu/mL。将配制的2×106cfu/mL孢子悬浮液取95 μL,取50%甘油5 μL,两者均匀混合,以保护米曲霉孢子。
1.6.2 ARTP照射剂量的确定
采用氦气为工作气体,使载片与等离子体发生器射流出口间距约为2 mm,功率为120 W,气流量10 L/min,对10 μL孢子(106cfu/mL)悬液进行诱变,处理时间设置为0,20,60,80,100,120,150,180,210,240 cfu/mL,稀释孢子悬液为2×104,2×103,2×102cfu/mL,取 100 μL各稀释倍数孢子悬浮液涂布选择培养皿,28 ℃培养3天计数,计算致死率(3个重复的平均值)。

1.7 初筛方法
挑选ARTP诱变140 s的平板上的菌落点种于大豆球蛋白初筛选培养基,28 ℃培养72 h观察记录透明圈和菌落大小,计算出K值。挑取K值较大并且孢子数较多的菌落接种于马铃薯试管斜面培养基,于30 ℃培养72 h,试管内布满淡绿色米曲霉菌丝停止,然后于4 ℃冰箱保存备用。
1.8 高通量复筛菌种
1.8.1 高通量复筛菌种的培养
将初选的15个于菌株PDA平板上培养72 h,制备每个菌株的菌悬液,菌浓度为2.5×106cfu/mL。采用18 cm×18 mm的试管加入1~15号诱变菌株菌悬液1 mL和1 mL 0.1%干酪素培养基,以试管中加入2 mL为对照试验,每个处理重复3次。
于28 ℃恒温生化培养箱摇床培养36 h后,从每个试管中取出40 μL液体置于96孔板中,加入10 μL发色剂,100 ℃水浴准确加热16 min,在(20±0.1) ℃水浴中冷却20 min。再各加入稀释溶液50 μL,充分混匀。用空白试管水调节仪器零点,于波长570 nm下测量吸光度,测量应在30 min内完成。
样品中的α-氨基氮含量按下式计算:
式中:X为麦芽汁的α-氨基氮含量,mg/L;A1为样液的平均吸光度;A2为甘氨酸标准使用液的平均吸光度;2为甘氨酸标准使用液中α-氨基氮的含量,mg/L;n为样液的稀释倍数。
1.8.2 高通量复筛方法的验证
采用福林酚法对高通量复筛出的H5,H12,H15 3个菌株进行蛋白酶活力测定[17]。
1.9 突变菌株遗传稳定性实验
将总酶活力高的突变菌株在麸曲培养基中连续传代培养9次,培养条件为30 ℃,60 h。依次称取一定质量的第1,3,5,7,9代种曲的酸性、中性、碱性蛋白酶活力进行测定,检测突变菌株的遗传稳定性。
2 结果与分析
2.1 米曲霉生长曲线绘制

图1 米曲霉菌丝Fig.1 Aspergillus oryzae hypha

图2 米曲霉菌株的生长曲线Fig.2 Growth curve of Aspergillus oryzae
由图2可知,0~12 h米曲霉生长处于迟缓期(停滞期);16~48 h菌体生长迅速,处于对数生长期;52~60 h 处于平衡期。
微生物生长曲线是以微生物数量(活细菌个数或细菌重量)为纵坐标,培养时间为横坐标绘制的曲线。典型的微生物生长曲线包括四个时期:迟缓期、对数期、稳定期、衰亡期。一般来说,大多数细菌的繁殖速度都很快,它的生长曲线是以细菌数目为纵坐标,以时间为横坐标。然而霉菌在液体培养时(150 r/min)大量菌丝生长会相互交织成球或块状,从而统计微生物个数或测定OD值不能反映霉菌的各个生长时期,因此,霉菌的生长曲线制作采用其生长量为纵坐标,时间为横坐标。
2.2 致死率曲线
采用平板活菌计数法绘制米曲霉菌株的ARTP诱变致死率曲线,ARTP诱变时间与致死率的关系曲线见图3。
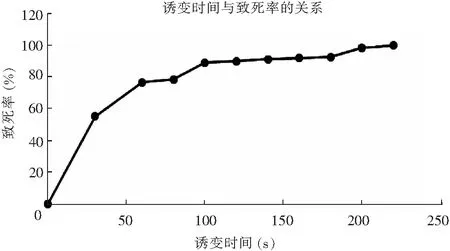
图3 ARTP诱变时间与致死率的关系曲线Fig.3 Relation between ARTP mutation time and lethality
由图3可知,等离子体对米曲霉菌株的致死率有明显剂量效应关系,随时间延长,在1~100 s范围内致死率迅速增加;诱变时间为100 s时,致死率达到89.12%;140 s时致死率达到91.22%;200 s时其接近100%。为获取较高的正突变率、较高蛋白酶活力菌株,本试验将致死率设定为90%以上[18],因此,选取140 s为ARTP诱变时间。
2.3 初筛结果
诱变前后米曲霉在初选培养基上生长见图4和图5。

图4 诱变前米曲霉在初选培养基上生长 Fig.4 Growth of Aspergillus oryzae on initial screening culture medium before mutation

图5 诱变后米曲霉在初选培养基上生长Fig.5 Growth of Aspergillus oryzae on initial screening culture medium after mutation

测量值D(cm)d(cm)K对照0.90.81.13H11.21.11.09H20.60.51.20H30.80.71.14H41.10.91.22H51.40.72.00H60.60.51.20H710.91.11H80.90.81.13H91.40.81.75H101.50.91.67H111.30.81.63H121.50.81.88H131.10.61.83H141.20.91.33H151.50.72.14
ARTP诱变后菌种有正突变,菌落长势好并且K值比对照值大;有负突变,菌落生长速度慢且K值比对照值小,将负突变的菌株舍弃,正突变菌株测量其菌落直径和透明圈直径并且计算K值。由表1可知,突变菌株H5,H12,H15 3个菌株的K值较大,分别为2.00,1.88,2.14,其中菌株H15的K值为2.14,最大。仅仅依据初筛培养基的K值不能最终确定米曲霉蛋白酶活的高低,还需进一步采用蛋白酶活测定方法验证,确定蛋白酶活力高的菌种。
2.4 甘氨酸标准曲线

图6 甘氨酸标准曲线Fig.6 Standard curve of glycine
甘氨酸标准曲线是甘氨酸不同浓度标准物质的仪器与试剂体系响应之间的函数关系。建立甘氨酸标准曲线是为了推导待测物的浓度。在分析食品化学实验中,常用标准曲线法进行物质定量分析,一般情况下标准工作曲线呈直线分布。只有标准曲线与校正曲线重合度越好的条件下,测量结果越准确,这样才可以用标准曲线来代替校正曲线。由图6可知,甘氨酸标准曲线为y=0.1677x+0.0643,R2=0.992,甘氨酸含量与吸光值的关系几乎呈线性关系,并且相关性较好,可以用此标准曲线来测定待测物的α-氨基酸含量。
2.5 复筛结果
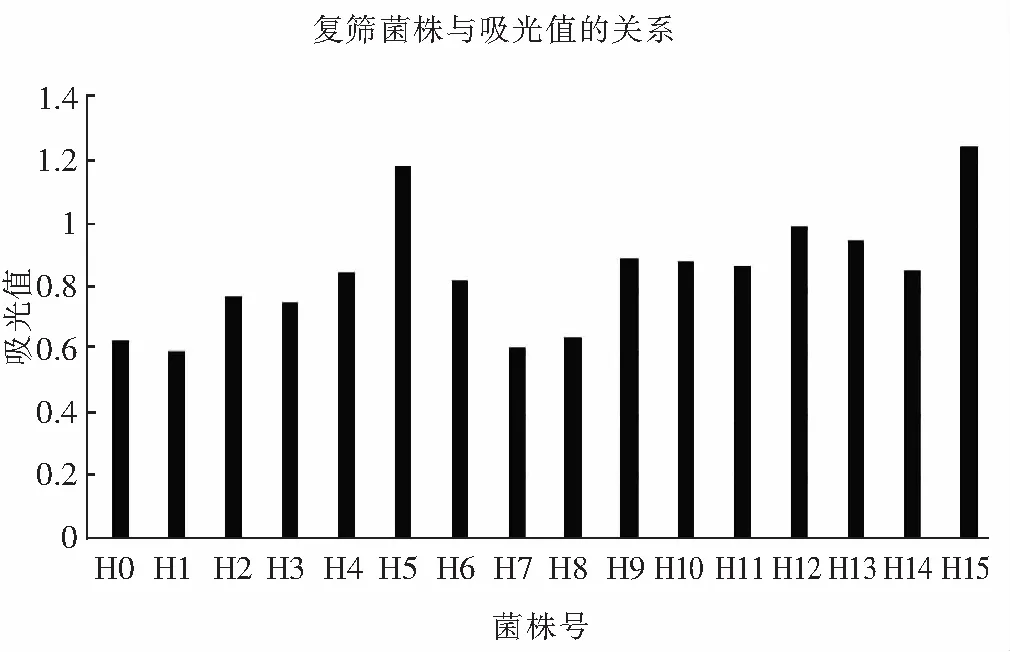
图7 菌株高通量复筛Fig.7 High-throughput for secondary screening of strain

菌株酸性蛋白酶活中性蛋白酶活碱性蛋白酶活H0163.721525.283411.19H5197.481536.943486.25H12169.421603.593724.56H15208.431792.793825.36
由图7可知,采用吸光度法测定α-氨基氮含量,根据甘氨酸标准曲线得到α-氨基氮含量在0~10 mg/L的范围内,吸光值在0~1.6范围内,吸光度随其浓度增大而增大,并且遵循y=0.1677x+0.0643(R2=0.992)直线关系。米曲霉蛋白酶活越高,分解酪蛋白变成α-氨基酸的含量就越高,α-氨基酸与茚三酮反应。所以,可以依据米曲霉与酪蛋白反应后测得的吸光值来判断米曲霉的综合蛋白酶活力。由表2可知,ARTP诱变后菌H5,H12,H15菌株总蛋白酶活力明显高于出发菌株H0菌株。菌株H5的酸性、中性和碱性蛋白酶活力分别为197.48,1536.94,3486.25 U/g;H12的三种蛋白酶活分别为169.42,1603.59,3724.56 U/g;H15的3种蛋白酶活分别为208.43,1792.79,3825.36 U/g。根据米曲霉酶活力测定,最终3个菌株的蛋白酶活与采用96孔板筛选结果一致,即H5,H12,H15菌株总蛋白酶活力明显高于出发菌株H0并且高于其他菌株。
2.6 米曲霉遗传稳定性检测
经过1~9代传代培养,种曲制备和福林酚法测定蛋白酶活力等步骤来考察菌株的遗传稳定性。

图8 H5菌株遗传稳定性Fig.8 Genetic stability of strain H5
由图8可知,菌株H5的酸性蛋白酶活力从197.48 U/g降至185.12 U/g;中性蛋白酶活力从1536.94 U/g降至1247.52 U/g;碱性蛋白酶活力从3486.25 U/g降至3317.22 U/g。

图9 H12菌株的遗传稳定性Fig.9 Genetic stability of strain H12
由图9可知,菌株H12的酸性蛋白酶活力从169.42 U/g升至175.89 U/g;中性蛋白酶活力从1603.59 U/g降至1580.42 U/g;碱性蛋白酶活力从3524.56 U/g降至3527.98 U/g。

图10 H15菌株的遗传稳定性Fig.10 Genetic stability of strain H15
由图10可知,菌株H15的酸性蛋白酶活力从208.43 U/g升至192.35 U/g;中性蛋白酶活力从1792.79 U/g升至1816.31 U/g;碱性蛋白酶活力从3825.36 U/g升至3774.82 U/g。
综合3个菌株的3种蛋白酶活的变化趋势可知,H5菌株的3种蛋白酶活力都有下降的趋势,并且中性和碱性蛋白酶力下降大,分别下降289.42,169.03 U/g;H12菌株的3种蛋白酶活力相对较稳定,酸性和碱性蛋白酶活力下降,中性蛋白酶活下降,但数值变化都不大(<40 U/g);H15菌株的3种蛋白酶活都比较高,并且传代培养后,蛋白酶活力稳定性较好,波动范围在51 U/g之内,并且H15菌株的酸性蛋白酶活力最终为192.35 U/g,增长率为17.49%;中性蛋白酶活力1816.31 U/g,增长率为19.08%;碱性蛋白酶活力3774.82 U/g,增长率为10.66%。3种蛋白酶活力遗传稳定性较好,波动范围较小且综合蛋白酶活力高于菌株H5和H12,所以,最终筛选出菌株H15为实验室出发菌株发酵酱油,进一步探索菌株的其他特性。
3 结论
采用96孔板高通量筛选蛋白酶活力较高菌株的方法与国家标准采用的福林酚法测定蛋白酶活力结果一致,96孔板高通量筛选蛋白酶活力可作为一种复筛方法,为高蛋白酶活力米曲霉筛选提供了一种简便、快速、相对准确的方法。
ARTP诱变米曲霉菌株H0具有良好效果,时间为140 s时其致死率接近90%。
通过初筛和复筛,选育出米曲霉菌种H15,其酸性蛋白酶活力最终为192.35 U/g,中性蛋白酶活力为1816.31 U/g,碱性蛋白酶活力为3774.82 U/g,分别比出发菌株H0增长17.49%,19.08%,10.66%,为后续酱油生产提供了较高蛋白酶活力米曲霉菌种。本试验为米曲霉菌种诱变选育提供了新方法的理论参考,并且构建了高蛋白酶活力菌株高通量筛选方法,为酱油酿造提供具有高蛋白酶活力的菌种。
[1]陈红梅,潘力.米曲霉3.042种曲蛋白酶特性研究[J].中国调味品,2009,34(3):63-71.
[2]徐德峰,赵谋明.中国酱油菌株 AS 3.951的改良现状与思考[J].中国调味品,2009,34(5):32-38.
[3]Yasuhara A, Ogawa A,Tanaka T,et al.Production of neutral protease fromAspergillusoryzaeby a novel cultivation method on a microporous membrane[J].Biotechnology Techniques, 1994,8(4):249-254.
[4]邓静,吴华昌,吴明霞,等.米曲霉产蛋白酶条件的优化[J].中国酿造,2008,27(12):51-53.
[5]孙春华.米曲霉菌株的诱变选育及其制剂的应用研究[D].泰安:山东农业大学,2008.
[6]唐洁.利用原生质体融合技术进行米曲霉新菌株的选育[D].成都:西华大学,2007.
[7]韩志双,刘军,郇阿梅,等.应用基因组改组技术选育米曲霉酸性蛋白酶高产菌株[J].中国调味品,2015,40(1):18-22.
[8]袁艳玲,杨生玉,钱深,等.米曲霉中性蛋白酶高产菌株的复合诱变选育[J].科技信息,2013,15(1):69-58.
[9]Li H P, Li G, Sun W T. Radio-frequency,atmospheric-pressure glow discharges:producing methods,characteristics and applicationsin bio-medical fields[C].Complex Systems: 5th International Workshop on Complex Systems. AIP Conference Proceedings, 2008,98(2):584-591.
[10]Li G, Li H P, Wang L Y, et al. Genetic effects ofradio-atmospheric pressure glow discharges with helium[J].Appl Phys Lett, 2008, 92(22):221504.
[11]Laroussi M. Nonthermal decontamination of biological media by atmospheric-pressure plasmas: review,analysis, and prospects[J].IEEE Transactions on Plasma Science, 2002, 30(4): 1409-1415.
[12]王方方,孙沛勇,银会娟,等.常压室温等离子体快速诱变酒精酵母及其突变株的特性研究[J].中国酿造,2013,10(8):117-119
[13]Liu Rongming, Liang Liya, Ma Jiangfeng, et al. An engineeringEscherichiacoli mutant with high succinic acid production in the defined medium obtained by the atmospheric and room temperature plasma[J].ProcessBiochemistry, 2013, 48(11): 1603-1609.
[14]万青,曹伟佳,张常青,等.常压室温等离子体诱变高效利用木糖产丁二酸菌株[J].生物工程学报,2013,29(11):1692-1695.
[15]陈锡剑,陈建华.常压室温等离子体诱变选育高产曲酸米曲霉[J].化学与生物工程,2015,32(5):52-60.
[16]高献礼,赵斯薇,孙鹏飞,等.酱油渣蛋白质的分离、鉴定和氨基酸组成特征研究[J].现代食品科技,2013,29(10):2512-2516.
[17]SB/T 10317-1999,蛋白酶活力测定法[S].
[18]范新蕾,肖成建,顾秋亚,等.ARTP诱变选育葡萄糖氧化酶高产菌株及发酵条件优化[J].工业微生物,2015,45(1):15-19.
Initial Study on High Proteinase-producing Aspergillus oryzae with ARTP Mutation and High-throughput Screening
SHU Dong-mei1, WANG De-liang2*, SONG Xu-lei2, SHANG Ke1
(1.College of Food Science and Medicine, Xinjiang Agricultural University, Urumqi 830052, China; 2.China National Research Institute of Food and Fermentation Industries, Beijing 100015, China)
To increase the proteinase activity ofAspergillusoryzaeduring the brewing of sauce, takeAspergillusoryzaestrain H0 from laboratory as the starting strain, and then ARTP mutation of strain H0 is carried out. The process conditions are as follows: power is 120 W, air flow volume is 10 L/min, 10 time gradient. The results show that the lethality is about 90% as the mutation time is 140 s, and it is the best time. Three strains such as H5, H12, H15 are selected by initial screening(take glycinin as the key factor in the selectivity culture medium) and high-throughput secondary screening (by 96 hole plate), and checked by Folin-phenol method. Eventually,Aspergillusoryzaestrain H15 with high proteinase activity is selected; its acidic, neutral and alkaline proteinase activity is 192.35, 1816.31,3774.82 U/g respectively, which is increased by 17.49%, 19.08%,10.66% respectively compared with the starting strain H0.
ARTP; high-throughput screening; proteinase activity
2016-06-08 *通讯作者
科技部科研院所基金项目(2014EG111217)
舒冬梅(1988-),女,硕士,研究方向:食品生物技术。
TS201.25
A
10.3969/j.issn.1000-9973.2016.12.014
1000-9973(2016)12-0067-07
