超快速液相色谱法同时测定车前子中京尼平苷酸和毛蕊花糖苷的含量
2017-01-06朱鹤云郝乘仪
关 皎 , 朱鹤云 , 冯 春 , 张 颖 , 郝乘仪 , 冯 波
(吉林医药学院药学院 , 吉林吉林132013)
超快速液相色谱法同时测定车前子中京尼平苷酸和毛蕊花糖苷的含量
关 皎 , 朱鹤云 , 冯 春 , 张 颖 , 郝乘仪 , 冯 波
(吉林医药学院药学院 , 吉林吉林132013)
建立超快速液相色谱法同时测定车前子中京尼平苷酸和毛蕊花糖苷的含量, 为车前子药材的质量控制提供参考。 采用Shim-Pack XR-ODS柱(75 mm×3.0 mm, 2.2 μm);流动相为0.1%甲酸水(A)-甲醇(B), 梯度洗脱(0~11 min, 20%~65%B), 平衡时间为3 min; 流速为0.4 mL/min; 检测波长为254 nm; 柱温为35℃。 结果: 京尼平苷酸和毛蕊花糖苷分别在16-160 μg/mL(R=0.9996)、 8-80 μg/mL(R=0.9995)浓度范围内与峰面积呈良好的线性关系; 平均回收率(n=9)分别为99.0%和99.4%。 结论:该方法结果准确、 操作简便、 具有良好的重现性和稳定性, 可用于车前子药材的质量控制, 同时为新兽药开发利用提供参考。
车前子 ; 京尼平苷酸 ; 毛蕊花糖苷 ; 超快速液相色谱法
车前子为车前科植物车前(L.Plantagoasiatica)或平车前(PlantagodepressaWilld).的干燥成熟种子。性寒、味甘、归肾、膀胱、肝、肺经,具有利水通淋、渗湿止泻、清肝明目、清热化痰的功效[1]。主要分布于江西、黑龙江、辽宁、河北等省。车前子主要含有环烯醚萜类、苯乙醇苷类、黄酮类、多糖等化合物[2-3]。现代药理研究表明,车前子具有利尿、降血脂、降血糖、祛痰、镇咳、抗炎、明目、抗肿瘤等药理作用[4-5]。目前,文献报道的车前子质量控制方法包括紫外法[6]、薄层色谱法[7-8]和高效液相色谱法[9]。然而,这些方法存在专属性差、分析时间长、检测指标少、样品处理复杂等缺点。近年来,超快速液相色谱(Ultra-fast liquid chromatography, UFLC)技术由于在峰容量、分析效率、灵敏度和分辨率方面均优于常规 HPLC,并可在极短的时间内达到柱平衡或重新平衡,显著减少分析时间,同时相应会减少溶剂消耗,已越来越多的应用于中药成分分析研究[10-11]。本研究首次采用超快速液相色谱法测定车前子中京尼平苷酸和毛蕊花糖苷的含量,所建立的定量分析方法分析时间短,分析效率明显提高,可为车前子的质量评价提供科学依据,有利于将车前子的药用价值充分应用于兽药行业,为天然药物应用于兽药领域提供参考。
1 仪器与试药
Prominence UFLC型超高快速液相色谱仪(配备Prominence SIL-20AHT自动进样器,LC-20AD二元泵,CTO-20A柱温箱,SPD-20A紫外检测器,LC solution色谱工作站,日本岛津公司);KQ-250DE型数控声波清洗器(昆山市超声仪器有限公司);CPA 225D型电子天平(德国赛多利斯仪器有限公司)。
甲醇为色谱纯(美国Fisher科技),所用水为经过Milli-Q型超纯水仪净化后的超纯水,其他试剂均为分析纯。对照品京尼平苷酸(批号:110753-201415)和毛蕊花糖苷(批号:111530-201512),购自中国食品药品检定研究院,纯度均大于98%。
车前子药材,分别购自吉林市吉林大药房和吉林市同仁堂大药房,产地均为江西省,经吉林医药学院生药教研室李景华副教授鉴定为车前科植物,样本留存于吉林医药学院药学院中药样品室。
2 方法与结果
2.1 对照品溶液的配制 分别精密称取对照品京尼平苷酸、毛蕊花糖苷对照品适量,置于5 mL容量瓶中,用60%甲醇稀释并定容至刻度,制成含京尼平苷酸0.8 mg/mL、毛蕊花糖苷0.4 mg/mL的混合对照品溶液。
2.2 供试品溶液的制备 取车前子药材粉末(过40目筛)约0.5 g,精密称定,置50 mL锥形瓶中,加入60%甲醇50 mL,称定重量,回流提取2 h,放冷后再称重,用60%甲醇补足减失的重量,摇匀,滤过。取续滤液经0.22 μm微孔滤膜过滤后作为供试品溶液。
2.3 色谱条件 采用Shim-Pack XR-ODS色谱柱(75mm×3.0 mm, i.d. 2.2 μm),预柱为C18保护柱(4 mm×3.0 mm, i.d. 2.2 μm),流动相为0.1%甲酸水溶液(A)-甲醇(B),梯度洗脱(0~11 min,20%~65%B,11~14 min,65%~20%B),平衡时间3 min,流速0.4 mL/min,检测波长254 nm,柱温35 ℃,进样量5 μL。色谱图见图1。
2.4 线性关系考察 分别精密吸取“2.1”项下混合对照品溶液0.1,0.2,0.4,0.6,0.8,1.0 mL,置于5 mL量瓶中,用甲醇-水(60∶40)定容至刻度,依次注入液相色谱仪,测定色谱峰面积,以进样量X(μg)为横坐标,色谱峰面积积分值(Y)为纵坐标,进行线性回归,京尼平苷酸、毛蕊花糖苷的回归方程分别为:
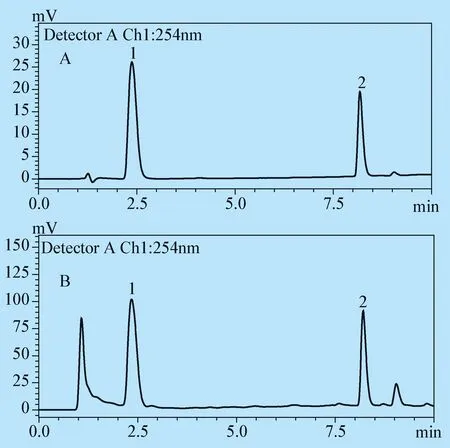
图1 混合对照品(A)、样品(B)色谱图
1:京尼平苷酸(geniposidic acid); 2:毛蕊花糖苷(acteoside)
Y= 2.000×106X+ 1.00636×105R= 0.9996;Y= 2.000×106X+ 3.370×104R = 0.9995
结果表明,京尼平苷酸、毛蕊花糖苷浓度分别在16-160 μg/mL、8-80 μg/mL范围内与峰面积呈良好的线性关系。
2.5 精密度试验 分别精密吸取“2.4”项下制备的第3混合对照品溶液5 μL, 按上述色谱条件连续进样6次,记录峰面积。结果京尼平苷酸、毛蕊花糖苷峰面积的RSD(n=6)分别为1.5%和0.8%,表明仪器精密度良好。
2.6 稳定性试验 取同一批次的供试品溶液,放置于室温,分别于0,2,4,8,12,24 h进样测定,记录峰面积。结果京尼平苷酸、毛蕊花糖苷峰面积的RSD分别为2.5%,1.3%,表明供试品溶液在24 h内稳定。
2.7 重复性试验 取同一批车前子样品6份,精密称定,按“2.2”项下方法制备供试品溶液,进样5 μL,计算京尼平苷酸、毛蕊花糖苷的含量,结果上述2种成分的含量的平均值(n=6)分别为1.96%和0.99%;RSD分别为1.5%和0.9%,表明该方法重复性良好。
2.8 回收率试验 精密称取已知含量(京尼平苷酸和毛蕊花糖苷含量分别为1.97%和0.99%)的车前子样品粉末9份,每份0.25g,精密称定,分别加入相当于样品中京尼平苷酸和毛蕊花糖苷含量的80%,100%,120%的对照品溶液适量,各3份。按“2.2”项下的方法制备供试品溶液,进样5 μL测定,计算京尼平苷酸和毛蕊花糖苷的回收率和RSD,结果见表1。
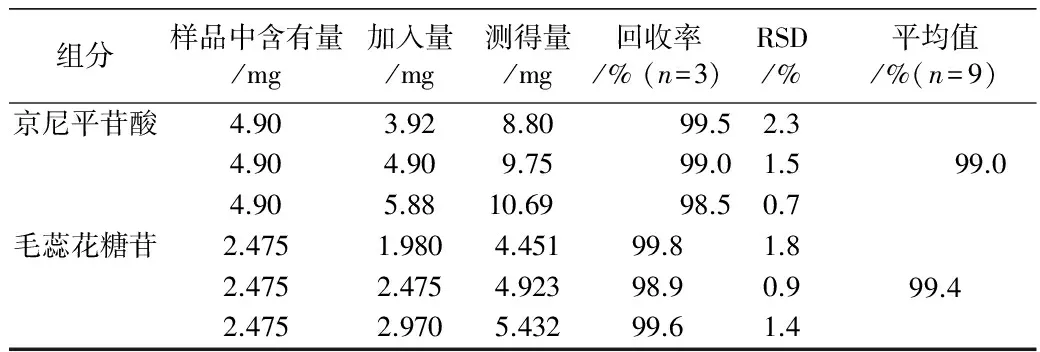
表1 车前子样品中京尼平苷酸和毛蕊花糖苷的回收率
2.9 样品含量测定 精密称取6批车前子样品粉末(1-3批购自吉林市吉林大药房,生车前子,4-6批购自吉林市同仁堂大药房,盐车前子),按“2.2”项下方法制备供试品溶液,进样5 μL,每个溶液进样3次,计算京尼平苷酸、毛蕊花糖苷的含量。6批样品测定结果见表2。
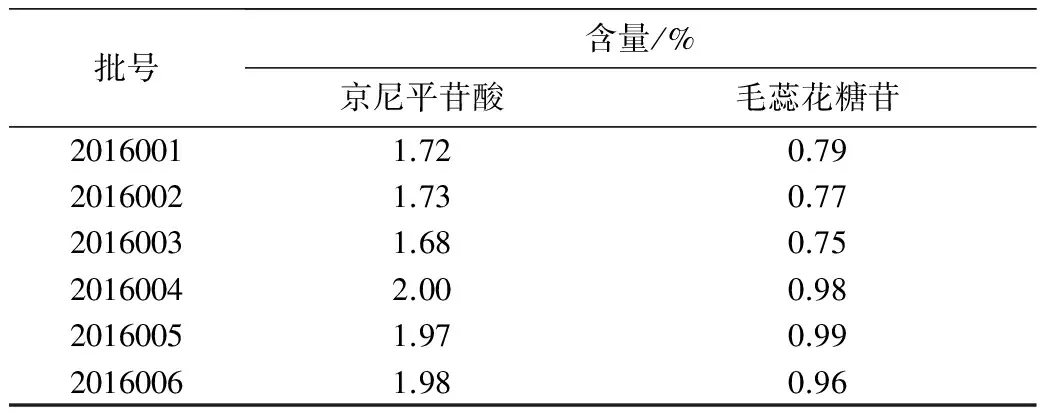
表2 车前子样品中京尼平苷酸、毛蕊花糖苷的含量 (%,n =6)
3 讨论
3.1 流动相的优化 分别考察了的甲醇-0.5%醋酸、甲醇-0.1%甲酸、乙腈-0.5%醋酸、乙腈-0.1% 甲酸共4种流动相体系,结果表明,甲醇-0.1% 甲酸作为流动相时能够获得较好的分离效果,分析时间为10 min,与文献[12-14]中采用常规HPLC相比分析时间明显缩短,且药材中其他色谱峰不干扰样品的测定。
3.2 检测波长的选择 采用二极管阵列检测器(DAD)进行全波长扫描,结果显示,京尼平苷酸在235 nm,485 nm,693 nm处有最大吸收波长,毛蕊花糖苷在274 nm,334 nm处有最大吸收。综合考虑杂峰影响,基线平稳,色谱峰峰形,最大吸收等因素,本试验选择254 nm作为检测波长。
3.3 提取方法及提取溶剂的选择 本试验对比了回流法和超声法提取车前子中京尼平苷酸、毛蕊花糖苷的提取效果。结果表明,回流提取2 h所得供试品中上述两种活性成分的含量明显高于超声提取法。本试验对比了60%、80%、100%乙醇溶液和60%、80%、100%甲醇溶液对车前子中2种活性成分的提取效率,结果显示,60%甲醇的综合提取效率最高,故本试验采用60%甲醇作为提取溶剂。
3.4 本研究建立UFLC法同时测定车前子中京尼平苷酸、毛蕊花糖苷的含量,并应用该方法测定了6批河北产车前子中2种活性成分的含量。购自吉林大药房的3批车前子和购自吉林市同仁堂大药房的3批车前子均符合药典要求(药典规定车前子中京尼平苷酸含量不低于0.50%,毛蕊花糖苷含量不低于0.40%;盐车前子中京尼平苷酸含量不低于 0.40%,毛蕊花糖苷含量不低于0.30%)。但炮制后车前子中2种活性成分含量明显升高,与文献报道结果一致[15],由此可见车前子经盐制入药有一定的科学性。本研究建立的分析方法简单、快速、可靠,可用于车前子药材的质量控制。
[1] 国家药典委员会. 中华人民共和国药典: 2015 年版一部[S]. 北京: 中国医药科技出版社,2015: 301-302.
[2] 郑秀棉,杨莉,王峥涛. 车前子的化学成分与药理活性研究进展[J]. 中药材,2013, 36(7): 1190-1196.
[3] 张晓方. 车前子化学成分与药理活性研究[J]. 亚太传统医药,2014, 10(12): 33-34.
[4] 谢明,杨爽爽,王亮亮,等. 中药车前子的研究进展[J]. 黑龙江医药,2015, 28(3): 474-476.
[5] 王劭华,罗光明,曾金祥,等. 中药车前子的化学成分及药理学研究进展[J]. 亚太传统医药,2008, 4(9): 133-135.
[6] 林慧霞,聂少平,谢明勇,等. 大粒车前子多糖的分离纯化及理化性质测定[J]. 热带农业工程,2015, 39(02): 5-10.
[7] 康帅,周超,魏爱华,等. 车前子与其伪品-柴胡果实的生药学鉴别[J]. 中国实验方剂学杂志,2013,19(2): 5-10.
[8] 俞作仁,陈立德,周印锁. 车前子及其混伪品的鉴别研究[J]. 中医药学报,2000, 19(18): 36-37.
[9] 钟瑞建,俞燕,丁剑虹,等. 车前子中车前素的TLC鉴别及HPLC含量测定[J]. 药物分析杂志,2015, 35(4): 715-718.
[10] 李国俊. 高效液相色谱法快速检测中药复方炮制液中芍药苷含量[J]. 河北省科学院报,2013, 30(3):59-62.
[11] 李启艳,王荣梅. 快速溶剂萃取-超高效液相色谱法测定稳心颗粒中皂苷类成分[J]. 药物分析杂志,2015, 35(3): 528-531.
[12] 万茵,谢明勇,何彦林. 反相高效液相色谱法同时测定车前子中的毛蕊花苷和异毛蕊花苷[J].天然产物研究与开发,2008, 20(3): 474-476.
[13] 邱倬星,熊学敏,胡晓艳,等. 车前子超微速溶饮片中京尼平苷酸与毛蕊花糖苷的测定[J]. 中国医药科学,2013,3(05): 41-43.
[14] 王隶书,王友联,李明洋,等. HPLC测定市售车前子中毛蕊花糖苷的含量[J].中国药师,2011,14(11): 1581-1582.
[15] 王俞燕,钟瑞建,丁剑虹,等. HPLC法同时测定不同产地车前子生品及盐炙品中3个主要活性成分的含量[J]. 药物分析杂志,2015, 35(5): 889-892.
Simultaneous determination of geniposidic acid and acteoside inPlantaginisSemenby UFLC
GUAN Jiao , ZHU He-yun , FENG Chun , ZHANG Ying , HAO Cheng-yi , FENG Bo
(College of Pharmacy , Jilin Medical University , Jilin 132013 , China)
To establish an ultra-fast liquid chromatography (UFLC) method for the determination of geniposidic acid and acteoside inPlantaginisSemen. Chromatographic separation was performed on Shim-Pack XR-ODS column(75 mm×3.0 mm, 2.2 μm); The mobile phase was 0.1% formic acid (A)-acetonitrile (B) with gradient elution(0~11 min, 20%~65%B)at a flow rate of 0.4 mL·min-1and the equilibration time was 3 min; The detecting wavelength was set at 254 nm and column temperature was maintained at 35 °C. The linear ranges were 16-160 μg·mL-1(r=0.9996) for geniposidic acid and 8.0-80 μg·mL-1(r=0.9995) for acteoside; The average recovery (n=9) of geniposidic acid and acteoside were 99.0% and 99.4%. The developed method is simple, and accurate with high repeatability and stability, which is suitable for the quality control ofPlantaginisSemenand can provide references for the development and utilization of new veterinary drugs.
PlantaginisSemen; Geniposidic acid; Acteoside; UFLC
FENG Bo
2016-07-07
吉林省卫生厅科研课题(2013Z008);吉林省科技厅科研课题(200905113)
关皎(1983-),女,讲师,博士,研究方向为中药质量控制及药代动力学,E-mail: rainbowguanjiao@sina.com
冯波, E-mail:fengbo2@sina.com
R 917
A
0529-6005(2016)00-0104-03
