毛蕊花糖苷对缺氧/复氧诱导心肌细胞损伤的影响
2022-11-08冯雪梅
平 勇,张 倩,冯雪梅
缺血性心脏病发病率与死亡率逐年增加,严重影响病人生活质量,再灌注是目前治疗缺血性心脏病的有效方案,但缺血组织恢复灌注后造成代谢功能障碍与结构损伤(心肌缺血再灌注损伤),心肌缺血再灌注损伤可增加心脏猝死等并发症风险。线粒体氧化损伤、心肌细胞氧化应激和凋亡等可加重心肌缺血再灌注损伤,因而,减轻心肌细胞损伤是改善心肌缺血再灌注损伤的重要途径[1]。近年来,从植物中提取的活性成分具有抗炎、抗氧化等作用,并可预防心血管疾病发生,具体作用机制尚未明确[2-4]。毛蕊花糖苷属于苯乙醇苷类化合物,而苯乙醇苷类化合物是一种天然糖苷类化合物,有研究表明,毛蕊花糖苷通过抑制炎性因子分泌,减轻内毒素诱导的急性肺组织损伤[5]。微小RNA-455-5p(microRNA-455-5p,miR-455-5p)在高糖诱导的视网膜色素内皮细胞损伤中低表达,上调其表达可抑制高糖诱导细胞凋亡、氧化应激及炎症反应[6]。毛蕊花糖苷对心肌缺血再灌注损伤的影响及其对miR-455-5p的调控作用尚未明确。本研究采用缺氧/复氧(hypoxia/reoxygenation,H/R)诱导大鼠心肌细胞H9C2建立心肌缺血再灌注损伤模型,探讨毛蕊花糖苷是否通过调控miR-455-5p表达影响H/R诱导的心肌细胞损伤。
1 材料与方法
1.1 实验材料与试剂 毛蕊花糖苷购自上海源叶生物(纯度≥98%);大鼠心肌细胞H9C2购自上海研谨生物;DMEM培养基购自美国Hyclone;胎牛血清购自美国Gibco;Lipofectamine2000购自美国Invitrogen;Trizol试剂购自广州国奥生物;逆转录试剂与荧光定量聚合酶链式反应(RT-qPCR)试剂购自北京天根生化;miR-455-5p寡核苷酸模拟物(miR-455-5p mimics)及阴性对照mimics NC序列(miR-NC)、miR-455-5p特异性寡核苷酸抑制剂(anti-miR-455-5p)及其阴性对照序列(anti-miR-NC)购自广州锐博生物;丙二醛(malondialedhyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒购自南京建成生物工程研究所;凋亡检测试剂盒购自北京索莱宝;兔抗鼠活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate-specific protease-3,Cleaved-Caspase 3)、活化的含半胱氨酸的天冬氨酸蛋白水解酶9(cleaved cysteinyl aspartate-specific protease-9,Cleaved-Caspase 9)单克隆抗体与二抗购自美国Santa Cruz。
1.2 方法
1.2.1 构建H/R模型 采用不含血清的低糖DMEM培养基置于37 ℃缺氧密闭培养箱中培养,通入体积分数95%N2与体积分数5%CO2的混合气体3 h,将培养基更换为高糖DMEM培养基后将其置于低氧装置中缺氧培养3 h,之后将培养液更换为含有10%胎牛血清的高糖DMEM培养基于37 ℃、体积分数5%CO2培养箱复氧培养4 h[7]。
1.2.2 实验分组 将心肌细胞随机分为正常对照组(Con组)、缺氧/复氧组(H/R组,按照1.2.1步骤构建模型)、H/R+毛蕊花糖苷低剂量组(缺氧前48 h,于培养基中加入20 μg/L[8]的毛蕊花糖苷后构建模型)、H/R+毛蕊花糖苷中剂量组(缺氧前48 h,于培养基中加入40 μg/L的毛蕊花糖苷后构建模型)、H/R+毛蕊花糖苷高剂量组(缺氧前48 h,于培养基中加入80 μg/L的毛蕊花糖苷后构建模型)、H/R+miR-NC组(缺氧前48 h,利用脂质体转染技术将miR-NC转染至心肌细胞后构建模型)、H/R+miR-455-5p组(缺氧前48 h,利用脂质体转染技术将miR-455-5p mimics转染至心肌细胞后构建模型)、H/R+毛蕊花糖苷+anti-miR-NC组(缺氧前48 h,anti-miR-NC转染至心肌细胞后加入含有80 μg/L毛蕊花糖苷的培养基,之后构建模型)、H/R+毛蕊花糖苷+anti-miR-455-5p组(anti-miR-455-5p转染至心肌细胞后加入含有80 μg/L毛蕊花糖苷的培养基,之后构建模型)。
1.2.3 检测氧化应激指标MDA水平与SOD、GSH-Px活性 将各组心肌细胞(1×105个/mL)接种于96孔板(每孔100 μL),将细胞机械匀浆后离心,取各组细胞上清液,参照试剂盒说明书分别检测MDA水平与SOD、GSH-Px活性。
1.2.4 流式细胞术检测细胞凋亡率 收集各组心肌细胞后加入预冷的磷酸缓冲盐溶液(PBS)清洗,弃上清液,向细胞沉淀中加入500 μL Binding Buffer悬浮细胞,分别加入膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)各5 μL,充分混匀后室温避光孵育10 min,应用流式细胞仪检测细胞凋亡率。
1.2.5 RT-qPCR检测miR-455-5p表达水平 应用Trizol试剂提取各组心肌细胞总RNA,应用紫外分光光度计测定RNA浓度。反转录体系:5×gDNA Buffer 2 μL,10×King RT Buffer 2 μL,FastKing RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNA(2 μg),RNase-Free ddH2O补足体系至20 μL;反应条件:42 ℃ 15 min,95 ℃ 3 min。反应体系:SYBR Green Master Mix每孔10 μL,正反向引物每孔0.8 μL,cDNA每孔1 μL,ddH2O补足体系至20 μL;反应条件:95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s;循环40次。应用ABI StepOnePlus荧光定量PCR仪检测miR-455-5p相对表达量。
1.2.6 免疫印迹法(Western Blot)检测Cleaved-Caspase 3、Cleaved-Caspase 9蛋白表达 应用蛋白裂解液提取各组心肌细胞总蛋白,采用二喹啉甲酸(BCA)法检测蛋白浓度,将5×SDS上样缓冲液加入蛋白样品后100 ℃沸水孵育10 min(蛋白变性),取30 μg蛋白进行十二烷基酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜、封闭2 h,分别孵育Cleaved-Caspase 3(1∶1 000)、Cleaved-Caspase 9(1∶1 000)、GAPDH(1∶3 000)抗体稀释液,4 ℃孵育24 h,加入二抗稀释液(1∶5 000),室温孵育1 h,滴加电化学发光法(ECL)显影;应用Image J软件分析各条带灰度值。

2 结 果
2.1 毛蕊花糖苷对H/R诱导的心肌细胞氧化应激的影响 与Con组比较,H/R组MDA水平升高(P<0.05),SOD、GSH-Px活性降低(P<0.05);与H/R组比较,H/R+毛蕊花糖苷低剂量组、H/R+毛蕊花糖苷中剂量组、H/R+毛蕊花糖苷高剂量组MDA水平降低(P<0.05),SOD、GSH-Px活性升高(P<0.05),且不同剂量组间比较差异有统计学意义(P<0.05)。详见表1。
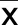
表1 毛蕊花糖苷对H/R诱导的心肌细胞氧化应激的影响(±s,n=9)
2.2 毛蕊花糖苷对H/R诱导的心肌细胞凋亡的影响 与Con组比较,H/R组凋亡率和Cleaved-Caspase 3、Cleaved-Caspase 9蛋白水平升高(P<0.05);与H/R组比较,H/R+毛蕊花糖苷低剂量组、H/R+毛蕊花糖苷中剂量组、H/R+毛蕊花糖苷高剂量组凋亡率和Cleaved-Caspase 3、Cleaved-Caspase 9蛋白水平降低(P<0.05),且不同剂量组间比较差异有统计学意义(P<0.05)。详见图1、表2。
图1 毛蕊花糖苷对H/R诱导的心肌细胞凋亡的影响
表2 毛蕊花糖苷对H/R诱导的心肌细胞凋亡的影响(±s,n=9)
2.3 毛蕊花糖苷对H/R诱导的心肌细胞miR-455-5p表达的影响 与Con组比较,H/R组miR-455-5p表达降低(P<0.05);与H/R组比较,H/R+毛蕊花糖苷低剂量组、H/R+毛蕊花糖苷中剂量组、H/R+毛蕊花糖苷高剂量组miR-455-5p表达升高(P<0.05),且不同剂量组间比较差异有统计学意义(P<0.05)。详见表3。
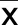
表3 毛蕊花糖苷对H/R诱导的心肌细胞miR-455-5p表达的影响(±s,n=9)
2.4 miR-455-5p过表达对H/R诱导的心肌细胞氧化应激和细胞凋亡的影响 与H/R+miR-NC组比较,H/R+miR-455-5p组MDA水平降低(P<0.001),SOD、GSH-Px活性升高(P<0.001),凋亡率和Cleaved-Caspase 3、Cleaved-Caspase 9蛋白水平降低(P<0.001)。详见图2、表4。
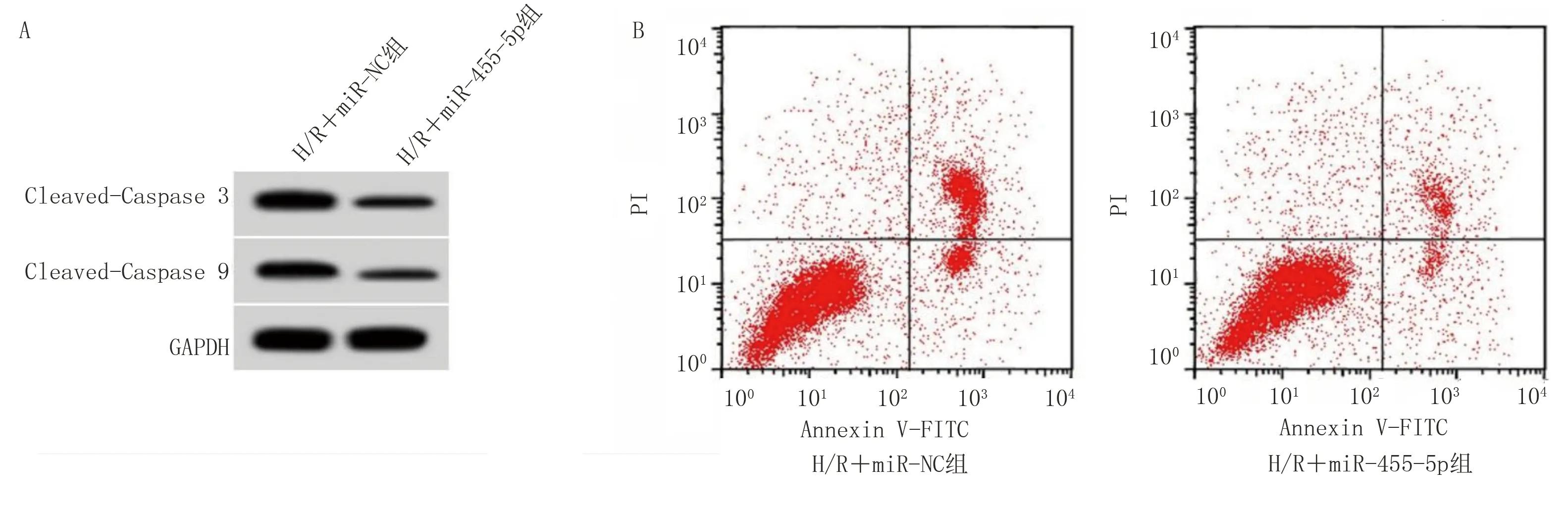
图2 miR-455-5p过表达对H/R诱导的心肌细胞凋亡的影响
表4 miR-455-5p过表达对H/R诱导的心肌细胞氧化应激和细胞凋亡的影响(±s,n=9)
2.5 干扰miR-455-5p表达对H/R诱导的心肌细胞氧化应激和凋亡的作用 与H/R+毛蕊花糖苷+anti-miR-NC组比较,H/R+毛蕊花糖苷+anti-miR-455-5p组MDA水平升高(P<0.001),SOD、GSH-Px活性降低(P<0.001),凋亡率和Cleaved-Caspase 3、Cleaved-Caspase 9蛋白水平升高(P<0.001)。表明干扰miR-455-5p表达逆转了毛蕊花糖苷(80 μg/L)对H/R诱导的心肌细胞氧化应激和凋亡的作用。详见图3、表5。

图3 干扰miR-455-5p表达逆转了毛蕊花糖苷对H/R诱导的心肌细胞凋亡的作用
表5 干扰miR-455-5p表达逆转了毛蕊花糖苷对H/R导的心肌细胞氧化应激和凋亡的作用(±s,n=9)
3 讨 论
缺血性心脏病病人接受再灌注治疗后引起心肌细胞凋亡、氧化应激等,进而加重心肌细胞损伤。相关研究表明,心肌纤维能量代谢障碍、炎症反应、氧自由基增多等均可能造成心肌缺血再灌注损伤,黄酮类化合物等植物活性成分在心血管疾病治疗过程中发挥着重要作用[9-10]。miRNA在心血管疾病中表达异常,尤其在H/R诱导的心肌细胞中表达失调,并可能作为红景天苷等植物活性成分治疗心血管疾病的潜在靶点[11]。
毛蕊花糖苷具有抗炎、抗菌与保护神经等作用,可抑制氧化应激及炎症反应,从而减轻大鼠脑缺血再灌注损伤[12]。有研究表明,毛蕊花糖苷可抑制神经细胞炎症反应与细胞凋亡,从而减轻内毒素性大鼠脑组织损伤[13]。关于毛蕊花糖苷与心血管疾病的相关研究报道较少。本研究结果显示,H/R诱导的心肌细胞MDA水平升高,SOD、GSH-Px活性降低,与既往研究报道结果[14]相似,提示成功构建心肌缺血再灌注损伤模型。SOD、GSH-Px属于抗氧化酶类,其活性高低可反映细胞氧化损伤程度;MDA是一种脂质过氧化物,其水平升高可加重细胞氧化应激损伤[15]。本研究结果显示,毛蕊花糖苷以剂量依赖性方式降低H/R诱导的心肌细胞MDA水平,SOD、GSH-Px活性升高,提示毛蕊花糖苷可增强H/R诱导的心肌细胞抗氧化能力,从而减轻细胞氧化损伤。本研究结果显示,H/R诱导的心肌细胞凋亡率和Cleaved-Caspase 3、Cleaved-Caspase 9蛋白水平升高,与既往研究报道结果[16]相似。随着毛蕊花糖苷剂量增加,H/R诱导的心肌细胞凋亡率和Cleaved-Caspase 3、Cleaved-Caspase 9蛋白水平降低,提示毛蕊花糖苷可抑制H/R诱导的心肌细胞凋亡,从而减轻细胞损伤。
为进一步探讨毛蕊花糖苷减轻H/R诱导的心肌细胞损伤的分子机制,本研究结果显示,H/R诱导的心肌细胞miR-455-5p表达降低,毛蕊花糖苷以剂量依赖方式提高H/R诱导的心肌细胞miR-455-5p表达,提示毛蕊花糖苷可能通过上调miR-455-5p表达减轻H/R诱导的心肌细胞损伤。有研究表明,miR-455-5p在糖氧剥夺诱导的神经细胞损伤和脑缺血再灌注损伤中表达下调,上调其表达可抑制神经细胞凋亡,减轻脑缺血再灌注损伤[17]。miR-455-5p在缺氧诱导的心肌细胞中表达下调,上调其表达可减轻缺氧诱导的心肌细胞损伤[18]。本研究结果显示,miR-455-5p过表达后H/R诱导的心肌细胞MDA水平降低,SOD、GSH-Px活性升高,凋亡率降低,抑制miR-455-5p表达可拮抗毛蕊花糖苷对H/R诱导的心肌细胞损伤的作用。提示毛蕊花糖苷通过上调miR-455-5p表达,减轻H/R诱导的心肌细胞损伤。
综上所述,毛蕊花糖苷通过上调miR-455-5p表达抑制H/R诱导的心肌细胞氧化应激及细胞凋亡,从而减轻细胞损伤。本研究初步证实毛蕊花糖苷可减轻心肌缺血再灌注损伤,且对心脏有保护作用,可能作为治疗缺血性心脏病的有效药物之一,为进一步研发治疗缺血性心脏病的药物提供新思路。毛蕊花糖苷是否通过调控其他miRNA或非编码RNA表达而减轻心肌缺血再灌注损伤,具体作用机制均需进一步深入研究。
