多药及毒素外排转运蛋白遗传药理学研究进展
2017-01-06熊宗萍黄师琼
熊宗萍,朱 鹏,黄师琼,李 清
(1.中南大学湘雅医院临床药理研究所,湖南 长沙 410008;2.中南大学临床药理研究所遗传药理湖南省重点实验室,湖南 长沙 410078)
多药及毒素外排转运蛋白遗传药理学研究进展
熊宗萍1,2,朱 鹏1,2,黄师琼1,2,李 清1,2
(1.中南大学湘雅医院临床药理研究所,湖南 长沙 410008;2.中南大学临床药理研究所遗传药理湖南省重点实验室,湖南 长沙 410078)
人体的肝脏、肾脏和肠道上广泛分布着多种转运蛋白, 其中多药及毒物外排转运蛋白(MATEs)主要表达在肾脏近端小管的刷状缘膜及肝细胞胆小管面,其功能主要是调节有机阳离子的外排。该文主要讨论的是MATEs 家族的成员MATE1和MATE2-K的分型、结构、遗传多态性以及其功能意义,同时也就MATEs的遗传多态性对铂类化合物及二甲双胍药物代谢动力学以及药效学的影响进行阐述。
多药及毒物外排蛋白;单核苷酸多态性 ;二甲双胍;顺铂;糖尿病;副作用
药物在体内的过程包括吸收、分布、代谢、排泄,多种药物及外源性分子通过细胞膜主要是由药物转运体来控制。药物转运体在体内分布广泛,如小肠、肝、肾,及人体的生理屏障血脑屏障、胎盘屏障。根据对底物的转运方向,主要将转运体分为摄入转运体和外排转运体,摄入转运体负责将内源性或外源性物质摄入细胞内,包括有机阴离子转运多肽家族(OATP)、有机阴离子转运体家族(OAT)、有机阳离子转运体家族(OCT);外排型转运体主要是多药耐药蛋白(MDR)、多药耐药相关蛋白(MRP)、乳腺癌耐药相关蛋白(BCRP)以及胆盐分泌蛋白(BSEP)等。 根据转运体的结构不同,将转运体分为两类:三磷腺苷结合盒式转运体家族(ABC 转运蛋白超家族)及溶质转运蛋白家族(SLC家族)。
多药及毒物外排蛋白(MATEs)属于溶质转运体家族,在真核生物、植物、哺乳动物中分布广泛[1]。大部分SLC家族转运体是摄入转运体,主要转运细胞生长必需的物质,例如糖、多肽、氨基酸、核苷及无机离子,只有SLC47A(MATE)是外排转运体。人类MATEs转运体主要表达在肾脏近端小管的刷状缘膜及肝细胞胆小管面,其功能主要是调节有机阳离子的外排,在多种阳离子药物的代谢过程中起重要作用,对某些疾病的治疗具有潜在的价值。
1 MATEs的结构和生理功能
人类MATE有两种亚型MATE1、MATE2。其中MATE2包括3种亚型,MATE2-K,MATE2及MATE2-B,MATE2-K、MATE2-B是MATE2的剪切突变体[2]。MATE2、MATE2-K、MATE2-B分别包含602、566、291个氨基酸,MATE2-K是MATE2的功能转运体,MATE2、MATE2-B的功能还未知,在肾脏中,hMATE2,hMATE2-K都是功能型亚型[3],hMATE2-B在多种器官中均有表达,如肾上腺、大脑、心脏,但在肾脏中不表达。hMATE2-K与hMATE2相比,hMATE2-K缺少36aa蛋白[1],556aa蛋白较短。MATE1由可溶性载体47A1(SLC47A1)基因编码,MATE2由SLC47A2基因编码。人类SLC47A1、SLC47A2基因定位于染色体17p11.2,由17个外显子和16个内含子组成。Otsuka等[4]通过电脑模拟分析显示,MATE1及MATE2-K可能有12或13个α-螺旋跨膜域(TMDs)。
人类的MATE1主要分布在肾脏和肝脏,肾上腺、骨骼肌、睾丸、第一孕期胎盘中也有分布。MATE2、MATE2-K主要分布于肾脏,MATE2在胎盘中也有分布。MATEs与OCTs(SLC22A)共同调节底物的运动,作用在肾脏和肝脏最为明显,OCTs位于肾脏近端小管的基底膜外侧及肝细胞微管膜,底物通过OCTs摄入细胞。MATEs位于极化细胞的顶膜,将底物排出细胞。在肝脏及肾脏中,OCTs-MATEs介导结构不同的阳离子型化合物的吸收及排泄过程。MATEs主要转运阳离子化合物,例如典型阳离子TEA+、MPP+,或是在生理pH下正电性的物质,如二甲双胍、西咪替丁、DAPI、普鲁卡因。少数阴离子化合物如硫酸雌醇、阿昔洛韦、更昔洛韦也为MATE1、MATE2-K底物[5]。约有40种临床使用药物已被证实为MATEs的底物,如二甲双胍、西咪替丁、奥沙利铂、阿昔洛韦、非索那定、头孢氨苄。Yamazaki等[6]的研究表明,新型抗真菌药艾康拉唑是MATE1的弱抑制剂。MATEs也转运内源性物质维生素B1、肌氨酸酐、胍、E3S(Tab 1),Kajiwara等[7]发现Mate1(-/-)小鼠及服用MATEs抑制剂伊马替尼的小鼠液体潴留,尿液中多巴胺下降,说明MATEs转运体调节内源性物质多巴胺的排泄。
大部分由MATEs转运的药物对MATE1及MATE2-K的亲和力相同,如MPP+、胍、普利卡因。少数底物对hMATE1的亲和力高于hMATE2-K,如阿昔洛韦。抗肿瘤药物奥沙利铂对hMATE2-K的亲和力高于hMATE1[5]。左氧氟沙星、头孢氨苄、头孢拉定仅为hMATE1的底物。
体外研究发现,MATE1 和MATE2-K 与OCTs具有相似的抑制剂和底物[8],OCT2典型底物西咪替丁研究较多,西咪替丁与MATE1、MATE2-K亲和力高于OCTs,其与有机阳离子化合物如二甲双胍[9]、普鲁卡因[9]、氨苯喋呤[10]之间的药物相互作用也有相关研究,多个研究表明西咪替丁抑制MATE1、MATE2-K的活性,减少阳离子化合物在肾小管的分泌。
2 MATEs的遗传多态性
药物在体内的代谢过程受多种因素的影响,主要包括内因(生理、遗传多态性)和外因(环境)。遗传多态性是影响药物代谢动力学的一个重要因素,MATEs的遗传多态性能影响底物在体内的排出过程,从而影响底物的药效及副反应。MATEs转运体主要分布在肝脏及肾脏,转运体的遗传多态性可解释一些由肝肾代谢的药物药代动力学的变化。目前研究最多的,较为常见的突变位点是SLC47A1上10号内含子上的rs2289669,体内和体外实验均证实rs2289669的突变能降低MATE1转运体的功能[11-12]。
目前已在体内试验和体外实验中证实MATEs的遗传多态性能影响MATEs转运体的功能,在SLC47A1和SLC47A2中分别发现16个突变位点及4个突变位点对转运体功能有影响。在启动子区、内含子区、3侧翼端等非编码区的突变会影响基因的表达及功能,在此区域的两个突变c.-118G>A[13](rs72466470)及c.-66T>C[14](rs2252281),降低启动子的活性,c.-66C 等位基因降低肾脏中MATE1 mRNA的表达,而肝脏中的mRNA不受影响,c.-118G>A突变与MATE1的组织特异性关系还未见相关研究。
非编码区基因多态性对MATEs功能有影响,编码区突变对MATEs影响更明显。p.L125F、 p.T159M、p.A310V、p.D328A能使MATE1功能降低,p.G64D 及p.V480M能使MATE1完全失活。Nishimura等[15]通过药动学分析发现,MATE2-K中P103R突变型Vmax大于野生型,Y293C突变型Vmax小于野生型,通过免疫组化分析发现,P103R定位于细胞膜,Y293C定位于细胞质。MATEs常见基因突变位点见Tab 2。
3 MATEs遗传多态性的临床药理学研究
3.1 MATEs与铂类化合物的相互作用 铂类化合物是常用的抗肿瘤药物,应用于肺癌、大肠癌、卵巢癌、乳腺癌等多种恶性肿瘤的治疗,具有良好的效果。此类化合物通过和DNA发生反应,形成DNA内两点或者两链的交叉连接,从而抑制DNA的复制和转录,抗癌谱广,作用强而持久。顺铂是第1个临床批准使用的铂类化合物,目前仍应用广泛,对多种实体肿瘤治疗效果明显,睾丸癌患者使用顺铂的生存率能提高至90%~95%[16],然而顺铂的副作用强,其肾毒性、耳毒性、肠胃毒性、神经毒性限制了它的临床使用,毒性较低的铂类化合物卡铂、奥沙利铂相继进入临床。
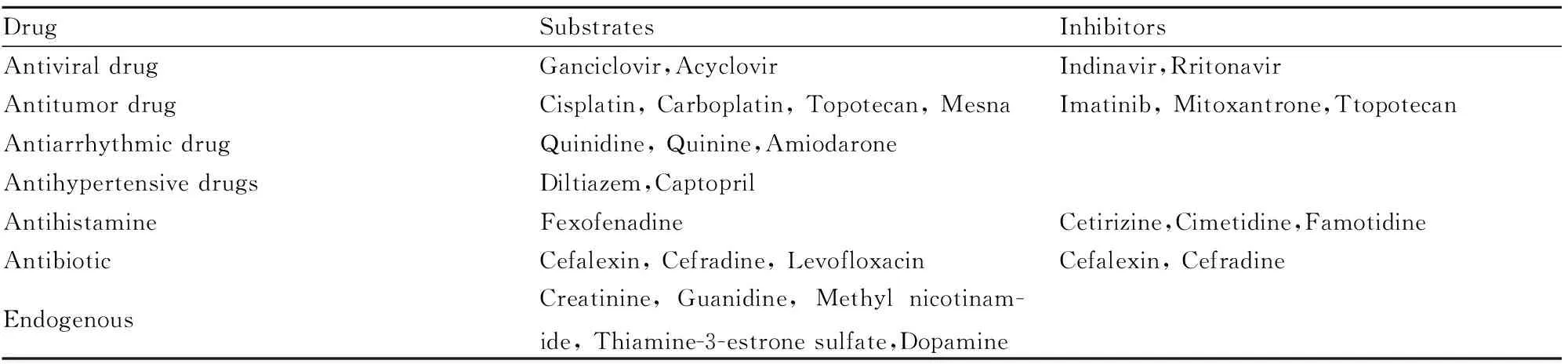
Tab 1 Substrates and inhibitors of MATEs

Tab 2 Polymorphisms in human MATEs
铂类化合物转运至细胞内主要由铜离子转运蛋白1(CTR1)[17],有机阳离子转运体2(OCT2)介导,排出细胞主要由ABC转运蛋白超家族的ABCC2和ABCB1,以及多药及毒素外排转运蛋白MATEs介导。顺铂、奥沙利铂是MATE1、MATE2-K的底物,卡铂与MATE1、MATE2-K无亲和力[5],顺铂主要由hMATE1转运。在小鼠体内,MATE转运体的选择性抑制剂乙胺嘧啶、昂丹司琼[18]及Mate1基因敲除均能增加顺铂的肾毒性。Nakamura等[19]的用Mate1(-/-)小鼠腹腔注射顺铂,与野生对照组相比,基因敲除组小鼠顺铂在体内肾毒性增加,研究显示MATE1调节顺铂从肾上皮细胞外排的过程及MATE1与顺铂肾毒性有关。Sauzay等[20]研究抗肿瘤药物帕唑帕尼与顺铂的合用,离体实验结果显示帕唑帕尼是OCT2、MATE1、MATE2-K的抑制剂,与顺铂合用时,降低顺铂的摄入增加顺铂的毒性。大量研究显示,单核苷酸的突变能够改变MATE的结构及功能,在以往对MATE1的遗传多态性与顺铂造成的毒性反应之间的关系的研究中,Iwata等[21]在53名服用顺铂患者的肾毒性研究证实rs2289669 G>A MATE1的突变与顺铂的副反应无关。
顺铂主要由hMATE1转运,奥沙利铂主要由hMATE2-K转运[5],奥沙利铂比顺铂肾毒性小的原因可能是,MATE2-K转运奥沙利铂速度快于顺铂,奥沙利铂在肾脏中停留的时间较短,但无动物实验及临床试验证实这个想法。许多关于MATE2-K的遗传多态性的研究是以降糖药物二甲双胍为底物,关于MATE2-K的遗传多态性改变铂类化合物在体内过程的研究较少,而且并未见相关非同义突变SNP的报道。
3.2 MATEs与二甲双胍的相互作用 二甲双胍是目前应用广泛的治疗2型糖尿病的药物,其降糖效果稳定,不良反应少,是治疗糖尿病的一线药物。二甲双胍主要是通过增加肝脏对胰岛素的敏感性,抑制肝糖原的产生,降低肝脏对葡萄糖的吸收和抑制肝糖原的分解,从而达到降低血糖的效果。
二甲双胍由OCT1转运体摄入肝细胞中,由OCT2转运体摄入至肾脏上皮细胞,OCT1转运体与二甲双胍的降糖作用关系密切,Shu等[22-23]在健康受试者中发现,R61C、 G401S、 M420del及G465R这4个位点的突变与二甲双胍血药浓度有关。二甲双胍是MATE1和MATE2-K的底物,MATE1位于肾近端小管和肝细胞的管腔侧刷状缘膜,可介导二甲双胍肾小管上皮细胞的外排和从胆小管排泄到胆汁,MATE2-K位于肾上皮细胞刷状缘膜,在二甲双胍的排泄中也起着重要作用。He等[24]通过动物实验发现,睾酮和雌激素通过调节Mates和Octs转运体,影响尿液中二甲双胍的排泄,且两激素作用相反。
MATEs的遗传多态性对二甲双胍影响的研究,在体内试验和体外实验均有报道。Becker等[11]在rotterdam研究中对基因多态性与二甲双胍的疗效进行研究,发现具有MATE1 rs2289669 G>A SNP的病人与对照组相比,服用二甲双胍后血糖水平明显降低,Rui等[25]在220名汉族2型糖尿病患者中发现, rs2289669 G>A通过减少二甲双胍的排泄而提高二甲双胍的降糖效果,而Tzvetkov等[12]在103名白种人身上一项前瞻性研究显示rs2289669 G>A突变与二甲双胍的肾脏清除无联系,由于3项实验设计不同,年龄、性别、基础HbA1c水平,联合用药等多种因素会影响二甲双胍的降糖效果,rs2289669 G>A对二甲双胍的降糖效果的影响需要今后进一步研究。Cho等[26]研究基因多态性对二甲双胍合并用药的影响,证明rs2289669 G>A在二甲双胍与其他药物的相互作用中具有重要意义,在与雷尼替丁合用后,MATE1 GG组受试者二甲双胍肾脏清除率明显上升。
Stocker等[27]研究MATE1、MATE2启动子区的基因多态性对二甲双胍疗效的影响,在57名健康受试者及糖尿病人中发现MATE1(g.—66T>C, rs2252281)及MATE2 (g.—130G>A, rs12943590)对二甲双胍在体内的分布及应答有重要意义,MATE1(g.—66T>C, rs2252281)虽对健康受试者体内药动学参数无影响,但健康人及糖尿病患者突变型对二甲双胍应答更好,MATE2(g.—130G>A, rs12943590)的突变使二甲双胍在肾脏中清除率升高,在健康受试者中,二甲双胍的应答降低。 Choi等[28]在体外实验研究MATE2-K启动子区的SNP对二甲双胍的影响,在HEK293细胞中发现,c.485C>T及c.1177G>A突变降低二甲双胍的摄入及降低MATE2-K蛋白表达。Toyamadeg等[29]研究MATE1的转运体与糖尿病并发症乳酸血症的关系,在动物实验中用Mate1(-/-)小鼠、野生型小鼠、杂合子型小鼠灌胃二甲双胍后对比,结果发现基因敲除组小鼠二甲双胍浓度、血液中乳酸浓度均高于杂合子型及野生型小鼠,在糖尿病病人中发现在MATE1-L125F、MATE1-G64D、MATE2-K-G211V这几种突变病人乳酸水平无明显差异。
4 结语
随着药物基因组学的不断发展,药物转运体的遗传多态性对药物的药动学和药效学等的研究,受到更广泛的关注。基于MATEs的遗传多态性对药物的药物代谢动力学及药物代谢效应学的影响的研究,能够为患者提供个体化治疗,为患者制定安全、合理、有效、经济的药物治疗方案。
目前对MATEs转运体遗传药理的研究主要集中在铂类化合物和降糖药物二甲双胍,今后关于MATEs转运体的SNP研究应关注更多其他MATEs转运体的底物。在部分关于MATEs的遗传多态性对二甲双胍影响的研究中,因样本案例过少,并未发现突变纯合子,研究结果存在争议,还需扩大样本做多中心、大样本的临床试验。
[1] Omote H, Hiasa M, Matsumoto T,et al.The MATE proteins as fundamental transporters of metabolic and xenobiotic organic cations[J].TrendsPharmacolSci, 2006, 27(11): 587-93.
[2] Masuda S, Terada T, Yonezawa Aet al.Identification and functional characterization of a new human kidney-specific H+/organic cation antiporter, kidney-specific multidrug and toxin extrusion 2[J].JAmSocNephrol, 2006, 17(8): 2127-35.
[3] Tanihara Y, Masuda S, Sato T,et al.Substrate specificity of MATE1 and MATE2-K, human multidrug and toxin extrusions/H(+)-organic cation antiporters[J].BiochemPharmacol, 2007,74(2): 359-71.
[4] Otsuka M, Matsumoto T, Morimoto R,et al.A human transporter protein that mediates the final excretion step for toxic organic cations[J].ProcNatlAcadSciUSA, 2005,102(50):17923-8.
[5] Yonezawa A, Masuda S, Yokoo Set al.Cisplatin and oxaliplatin, but not carboplatin and nedaplatin, are substrates for human organic cation transporters (SLC22A1-3 and multidrug and toxin extrusion family)[J].JPharmacolExpTher, 2006, 319(2): 879-86.
[6] Yamazaki T, Desai A, Han D,et al.Pharmacokinetic interaction between isavuconazole and a fixed-dose combination of lopinavir 400 mg/ritonavir 100 mg in healthy subjects[J].ClinPharmacolDrugDev, 2016[Epub ahead of print].
[7] Kajiwara M, Ban T, Matsubara K,et al.Urinary dopamine as a potential index of the transport activity of multidrug and toxin extrusion in the kidney[J].IntJMolSci, 2016, 17(8).
[8] Damme K, Nies A T, Schaeffeler E,et al.Mammalian MATE(SLC47A) transport proteins: impact on efflux of endogenous substrates and xenobiotics[J].DrugMetabRev, 2011, 43(4): 499-523.
[9] Somogyi A, Stockley C, Keal J,et al.Reduction of metformin renal tubular secretion by cimetidine in man[J].BrJClinPharmacol,1987,23(5): 545-51.
[10]Muirhead M R, Somogyi A A, Rolan P E,et al.Effect of cimetidine on renal and hepatic drug elimination: studies with triamterene[J].ClinPharmacolTher, 1986, 40(4): 400-7.
[11]Becker M L, Visser L E, van Schaik R H,et al.Genetic variation in the multidrug and toxin extrusion 1 transporter protein influences the glucose-lowering effect of metformin in patients with diabetes:a preliminary study[J].Diabetes, 2009, 58(3): 745-9.
[12] Tzvetkov M V, Vormfelde S V, Balen D,et al.The effects of genetic polymorphisms in the organic cation transporters OCT1, OCT2, and OCT3 on the renal clearance of metformin[J].ClinPharmacolTher, 2009, 86(3): 299-306.
[13]Kajiwara M, Terada T, Asaka J,et al.Critical roles of Sp1 in gene expression of human and rat H+/organic cation antiporter MATE1[J].AmJPhysiolRenalPhysiol, 2007, 293(5): F1564-70.
[14]Chen Y, Teranishi K, Li S,et al.Genetic variants in multidrug and toxic compound extrusion-1, hMATE1, alter transport function[J].PharmacogenomicsJ, 2009, 9(2): 127-36.
[15]Nishimura K, Ide R, Hirota T,et al.Identification and functional characterization of novel nonsynonymous variants in the human multidrug and toxin extrusion 2-K[J].DrugMetabDispos, 2014, 42(9): 1432-7.
[16]Raghavan D.Testicular cancer: maintaining the high cure rate[J].Oncology(WillistonPark), 2003, 17(2): 218-28, 228-29, 234-5.
[17]Arnesano F, Scintilla S, Natile G.Interaction between platinum complexes and a methionine motif found in copper transport proteins[J].AngewChemIntEdEngl, 2007, 46(47): 9062-4.
[18]Li Q, Guo D, Dong Z,et al.Ondansetron can enhance cisplatin-induced nephrotoxicity via inhibition of multiple toxin and extrusion proteins(MATEs)[J].ToxicolApplPharmacol, 2013, 273(1): 100-9.
[19]Nakamura T, Yonezawa A, Hashimoto S,et al.Disruption of multidrug and toxin extrusion MATE1 potentiates cisplatin-induced nephrotoxicity[J].BiochemPharmacol, 2010, 80(11): 1762-7.
[20]Sauzay C, White-Koning M, Hennebelle I,et al.Inhibition of OCT2, MATE1 and MATE2-K as a possible mechanism of drug interaction between pazopanib and cisplatin[J].PharmacolRes, 2016, 110: 89-95.
[21]Iwata K, Aizawa K, Kamitsu S,et al.Effects of genetic variants in SLC22A2 organic cation transporter 2 and SLC47A1 multidrug and toxin extrusion 1 transporter on cisplatin-induced adverse events[J].ClinExpNephrol, 2012, 16(6): 843-51.
[22]Shu Y, Sheardown S A, Brown C,et al.Effect of genetic variation in the organic cation transporter 1(OCT1) on metformin action[J].JClinInvest, 2007, 117(5): 1422-31.
[23]Shu Y, Brown C, Castro R A,et al.Effect of genetic variation in the organic cation transporter 1, OCT1, on metformin pharmacokinetics[J].ClinPharmacolTher, 2008, 83(2): 273-80.
[24]He R, Ai L, Zhang D,et al.Different effect of testosterone and oestrogen on urinary excretion of metformin via regulating OCTs and MATEs expression in the kidney of mice[J].JCellMolMed, 2016,[Epub ahead of print].
[25]Rui H, Zhang D, Wei L,et al.SLC47A1 gene rs2289669 G>A variants enhance the glucose-lowering effect of metformin via delaying its excretion in Chinese type 2 diabetes patients[J].DiabetesResClinPract, 2015, 109(1): 57-63.
[26]Cho S K, Chung J Y.The MATE1 rs2289669 polymorphism affects the renal clearance of metformin following ranitidine treatment[J].IntJClinPharmacolTher, 2016, 54(4): 253-62.
[27]Stocker S L, Morrissey K M, Yee S W,et al.The effect of novel promoter variants in MATE1 and MATE2 on the pharmacokinetics and pharmacodynamics of metformin[J].ClinPharmacolTher, 2013, 93(2): 186-94.
[28]Choi J H, Yee S W, Ramirez A H,et al.A common 5′-UTR variant in MATE2-K is associated with poor response to metformin[J].ClinPharmacolTher, 2011, 90(5): 674-84.
[29]Toyama K, Yonezawa A, Masuda S,et al.Loss of multidrug and toxin extrusion 1(MATE1) is associated with metformin-induced lactic acidosis[J].BrJPharmacol, 2012, 166(3): 1183-91.
[30]Meyer ZSH, Verstuyft C, Kroemer H K,et al.Human multidrug and toxin extrusion 1(MATE1/SLC47A1) transporter: functional characterization, interaction with OCT2(SLC22A2), and single nucleotide polymorphisms[J].AmJPhysiolRenalPhysiol, 2010, 298(4): F997-1005.
[31]Kajiwara M, Terada T, Ogasawara K,et al.Identification of multidrug and toxin extrusion(MATE1 and MATE2-K) variants with complete loss of transport activity[J].JHumGenet, 2009, 54(1): 40-6.
[32]Toyama K, Yonezawa A, Tsuda M,et al.Heterozygous variants of multidrug and toxin extrusions(MATE1 and MATE2-K) have little influence on the disposition of metformin in diabetic patients[J].PharmacogenetGenomics, 2010, 20(2): 135-8.
[33]Ha C J, Wah Y S, Kim M J,et al.Identification and characterization of novel polymorphisms in the basal promoter of the human transporter, MATE1[J].PharmacogenetGenomics, 2009, 19(10): 770-80.
[34]Chen Y, Zhang S, Sorani M,et al.Transport of paraquat by human organic cation transporters and multidrug and toxic compound extrusion family[J].JPharmacolExpTher, 2007, 322(2): 695-700.
Research progress on pharmacogenetics in multidrug and toxin extrusion proteins
XIONG Zong-ping1,2, ZHU Peng1,2, HUANG Shi-qiong,LI Qing1,2
(1.DeptofClinicalPharmacology,XiangyaHospital,CentralSouthUniversity,Changsha410008,China;2.InstituteofClinicalPharmacology,CentralSouthUniversity,HunanKeyLaboratoryofPharmacogenetics,Changsha410078,China)
The body is equipped with kinds of transporters which generally exist in liver, kidney, and intestine. Multidrug and toxin extrusion proteins(MATEs; SLC47A) are predominantly expressed in the brush-border membrane of proximal tubule epithelial cells in the kidney and the canalicular membrane of hepatocytes. Functionally, MATEs act as efflux transporters for organic compounds. The article discusses type, structure, polymorphism and function of MATE1and MATE2-K,and also discusses the effect of single nucleotide polymorphisms (SNPs) in the SLC47A1 gene and SLC47A2 on the pharmacokinetics and pharmacodynamics of metformin and platinum-based chemotherapeutic agents.
multidrug and toxin extrusion proteins; SNP; metformin; cisplatin;diabetes;side efect
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.006.html
2016-06-30,
2016-09-13
国家自然科学基金资助项目(No 81373477)
熊宗萍(1992-),女,硕士,研究方向:临床药理学、遗传药理学和药物基因组学,E-mail:xzp0418@163.com; 李 清(1978-),女,博士,副教授,硕士生导师,研究方向:遗传药理学与药物基因组学、临床药理学、药物代谢动力学,通讯作者,E-mail:qli1026@163.com
10.3969/j.issn.1001-1978.2016.12.003
A
1001-1978(2016)12-1639-05
R-05;R341; R342.4; R394.2;R587.1;R977.15;R979.1