水溶性紫杉醇前药的制备及抗肿瘤活性的研究
2017-01-06赵素华杨秀勤郑朋成汪晋京单玲玲
赵素华, 杨秀勤, 朱 伟, 郑朋成,汪晋京, 单玲玲
(1. 宿州职业技术学院动物科学系,安徽 宿州 234000; 2. 宿州学院药物生物技术研究所,安徽 宿州 234000)
水溶性紫杉醇前药的制备及抗肿瘤活性的研究
赵素华1, 杨秀勤2, 朱 伟2, 郑朋成2,汪晋京2, 单玲玲2
(1. 宿州职业技术学院动物科学系,安徽 宿州 234000; 2. 宿州学院药物生物技术研究所,安徽 宿州 234000)
目的 紫杉醇是具有良好抗肿瘤疗效的化学药物,由于紫杉醇本身化学结构复杂,难溶于水,在一定程度上限制了紫杉醇药物在临床上的广泛应用,因此改善紫杉醇水溶性是解决紫杉醇药物不足的关键问题。方法 本实验选用水溶性叶酸配体作为“导向基团”,谷氨酸为连接叶酸和紫杉醇的Linker,氨基PEG(MW:350)为药物增溶剂和稳定剂,制备水溶性叶酸-PEG-谷氨酸-紫杉醇前药。用LC-MS鉴定前药的化学结构,通过对前药溶解性及释药动力学曲线的测定,确定前药的理化性质。用MTT实验分析并对比紫杉醇原药与前药在不同肿瘤细胞(MCF-7、MDA-MB-231、A549)和正常细胞HELF(人胚肺成纤维细胞)中的毒性和药效作用。用荧光标记法直观观察紫杉醇前药在肿瘤细胞和组织中的靶向性。结果 实验结果证明已成功合成叶酸-PEG-谷氨酸-紫杉醇前药,并具有较好的溶解性和原药释放动力学曲线,细胞实验表明在叶酸受体-配体作用的介导下,叶酸-PEG-谷氨酸-紫杉醇前药靶向叶酸受体高表达的肿瘤细胞,减少对叶酸受体低表达正常细胞的毒副作用。结论 叶酸-PEG-谷氨酸-紫杉醇前药具有良好的抗肿瘤活性。
叶酸;紫杉醇前药;水溶性; MTT实验;肿瘤细胞;靶向性
紫杉醇(PTX)是治疗多种恶性肿瘤的临床一线药物。由于紫杉醇存在结构复杂、难溶于水、靶向性差和毒副作用大等缺点,限制了紫杉醇药物在临床上的广泛应用[1]。目前,国内外许多研究者针对紫杉醇药物结构特点,设计出多种以大分子如白蛋白、脂质体、高分子聚合物等作为紫杉醇药物载体的药物传递系统,即前药。研究表明,这些前药能有效地提高紫杉醇的药效,减少紫杉醇药物的毒副作用,但仍存在药物载药量低、稳定性差、靶向性差等不足,因此还需开发新型靶向肿瘤的药物传递系统[2-3]。肿瘤靶向性前药具有将药物选择性地释放于目标部位,降低对正常组织的毒副作用,以及提高药物疗效等明显优点,已成为抗肿瘤药物研究发展的主要方向[4]。
在各种肿瘤主动靶向性药物研究中,以叶酸配体(folate ligand, FA)作为“导向基团”所介导的靶向性药物研究最为成功。叶酸受体(folate recepotor, FR)在正常细胞/组织中的表达高度保守,但大多数恶性肿瘤如乳腺癌、肺癌、肝癌等细胞FR却高度表达,比正常细胞/组织高出100~300倍[5-6]。因此,叶酸配体是设计靶向药物传递系统的最佳选择。聚乙二醇化(PEG化)是药物改造常用的新工艺,不仅可改善难溶药物的水溶性,同时还可延长药物在体内的代谢时间,从而减少药物剂量[7]。Linker作为药物改造中的一种偶联中间体,不仅改善药物的特性,如水溶性、活性及靶向性,而且可以连接药物与载体。这类Linker主要是通过酯键、酰胺键或是离子键来连接两端物质,在体内这些酯键、酰胺键或是离子键易断裂,使Linker水解,从而释放出原药发挥药效[8]。
本实验采用水溶性较好的叶酸配体作为紫杉醇前药的“导向基团”,氨基PEG化作为紫杉醇前药的增溶剂和稳定剂,谷氨酸作为Linker连接叶酸与紫杉醇,制备叶酸-PEG-谷氨酸-紫杉醇前药(FA-PEG-Glu-PTX)。用LC-MS对靶向性前药进行化学结构鉴定,通过对前药水溶性和释药动力学的测定,确定紫杉醇前药的理化性质,检测正常细胞和3种肿瘤细胞表面叶酸受体蛋白表达量,用荧光染料FITC标记紫杉醇前药,通过倒置荧光显微镜和流式细胞仪研究紫杉醇前药的靶向性,用MTT实验分析与对比肿瘤靶向性前药对不同细胞的靶向性和药效。
1 材料
1.1 细胞与动物 人肺癌细胞株(A549)、人乳腺癌细胞株(MCF-7、MDA-MB-231)和人胚肺纤维正常细胞(HELF)购于ATCC,这些细胞株用于细胞毒性和靶向性实验。以上细胞均置于5% CO2、37℃培养箱中培养。MCF-7、MDA-MB-231和HELF 用DMEM 培养液培养,A549用RPMI 1640 培养液培养,两种培养基中各含10 g·L-1胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素。
动物:SPF级ICR小鼠,5只,♀♂各半,体质量18 g~22 g,由上海西普尔-必凯实验动物有限公司提供,合格证号:2010002600621。
1.2 试剂 紫杉醇、叶酸、谷氨酸、氨基PEG和荧光染料5AF购于Sigma公司;溴化3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑(MTT)、RPMI 1640、DMEM、小牛血清、胎牛血清购于南京凯基试剂公司。以上试剂纯度均在95%以上。实验中所用液体试剂均为分析纯。
1.3 仪器 ZS-紫外分析摄影仪器180(中国远明公司),LC-MS(Triple QuadTM3500质谱系统, 美国),酶标仪(美国Thermo公司),倒置荧光显微镜(日本OLYMPUS公司),流式细胞仪(美国 BD公司),U-3310型紫外分光光度仪(上海天肯贸易有限公司)。2 方法
2.1 谷氨酸-紫杉醇(Glu-PTX)的合成 称取100 mg(0.117 mmol)PTX溶于15 mL的二氯甲烷溶剂(DCM),同时加入59.7 mg(0.1404 mmol,1.2 eqv)芴甲氧羰基-L-谷氨酸5叔丁酯[Fmoc-Glu(OtBu)-OH]和14.29 mg(0.117 mmol,1 eqv) 催化剂DMAP。将44.85 mg(0.234 mmol, 2 eqv) 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)溶于10 mL DCM中,在冰浴条件下,将10 mL溶于EDC溶液,缓慢滴入PTX反应体系中,大约25 min滴加完毕,除去冰浴。室温下搅拌21 h。待反应完后用同体积的DCM稀释,然后用同体积的蒸馏水洗2次,加入无水硫酸镁干燥,真空旋蒸后得晶状体产物Fmoc-谷氨酸-紫杉醇,将4 mL DCM Fmoc-Glu(OtBu)-PTX溶液中,加入体积20 mL·L-1的哌啶,在室温条件下搅拌10 h,溶液开始变浑浊,点TLC(乙酸乙酯 ∶石油醚=2 ∶1)跟踪,反应完毕后,真空旋蒸,用乙醚萃取,真空抽滤,旋蒸,得到粉末状的产物-NH2-Glu(OtBu)-PTX,纯度为98%。
2.2 叶酸-PEG-谷氨酸-紫杉醇前药[FA-PEG-Glu-PTX]的制备 如Fig 1所示,活化叶酸的羧基,加入DCC和NHS[摩尔比为 FA ∶DCC ∶NHS=1 ∶1.2 ∶2],避光50 ℃搅拌6 h,反应结束,反应液减压滤过副产物DCU。取上清,用4倍的丙酮萃取活化的叶酸。然后将活化后的叶酸(44.1 mg,0.1 mmol)溶于2 mL DMSO,并加入3 mL含128.54 mg-NH2-Glu(OtBu)-PTX(0.1 mmol)的DMSO 溶液, 常温搅拌12 h,将反应液经硅胶柱纯化,去除没有共价偶联的叶酸和-NH2-Glu(OtBu)-PTX片段,得到纯化的叶酸-谷氨酸-紫杉醇(FA-Glu(OtBu)-PTX前药。将FA-Glu(OtBu)-PTX溶于7 mL DCM,在通风橱内加3 mL三氟乙酸,室温搅拌,TLC跟踪。反应完全后,将产物旋转蒸发除去溶剂,用适量乙醚萃取过夜,将乙醚旋转蒸发,烘干产物,得到FA-Glu(COOH)-PTX。

Fig 1 Synthetic scheme and structures of FA-PEG-Glu-PTX
将叶酸-谷氨酸-紫杉醇溶于4 mL DMSO中,加入二环己基碳二亚胺(DCC)和NHS[摩尔比为FA-Glu(COOH)-PTX ∶DCC ∶NHS=1 ∶1.2 ∶2],室温搅拌4 h,加入1 mL 0.1mmol氨基PEG, 室温搅拌14 h(Fig 1),将反应液经硅胶柱纯化,得到纯化的叶酸-PEG-谷氨酸-紫杉醇,其纯度为95%。
2.3 FA-PEG-Glu-PTX的表征 用LC-MS对紫杉醇前药及中间体进行化学结构鉴定。
2.4 FA-PEG-Glu-PTX的水溶性测定 称取2.0 mg紫杉醇溶于2 mL甲醇中,配成1 mg·L-1的溶液,并稀释成5~50 mg·L-1的6个标准溶液,浓度梯度分别为5、10、20、30、40、50 mg·L-1,以甲醇为空白试剂,用紫外分光光度仪测定在PTX的最佳紫外吸收波长处相应的吸光度值,记录数据,绘制PTX标准曲线图,求得其标准曲线方程,绘制紫杉醇标准曲线。
准确称取100 mg样品,置于10 mL小容量瓶中,用微量注射器每次加水50 μL观察溶解情况,直到不溶为止,统计溶解100 mg前药样品所需的水量,根据紫杉醇标准曲线计算样品在水中的溶解度[9]。2.5 FA-PEG-Glu-PTX药物释放动力学曲线测定 准确称取紫杉醇2.0 mg溶于2 mL甲醇中, 配成1 g·L-1的溶液,并稀释成5~50 mg·L-16个标准溶液,浓度梯度分别为5、10、20、30、40、50 g·L-1。分别向高效液相色谱仪进样20 μL,测定紫杉醇峰面积,绘制紫杉醇峰面积-浓度标准曲线。将FA-PEG-Glu-PTX孵育在37℃的PBS、血浆和细胞培养液中,按照不同的时间点,取100 μL样品,用1 mL乙酸乙酯萃取PTX,用氮气吹干后,加入100 μL甲醇,再用HPLC测量PTX峰面积,用标准曲线方程计算PTX含量,与前药中原始紫杉醇含量对比,计算PTX的释放率。
2.6 FA-PEG-Glu-PTX前药的细胞摄取量 用Western blot技术测试正常细胞HELF和3种肿瘤细胞MDA-MB-231、A549和 MCF7的叶酸受体(FR)蛋白的表达水平。用荧光染料5AF标记叶酸-PEG-谷氨酸-紫杉醇前药,制备叶酸-PEG-谷氨酸-紫杉醇-5AF前药(叶酸-Glu-PTX-FITC),并将标记后前药的PBS水溶液(0.2 g·L-1)孵育在4种细胞(HELF、MDA-MB-231、A549、MCF-7)中12 h,在倒置荧光显微镜下观察前药进入细胞状况,并用流式细胞仪进行定量分析。
2.7 FA-PEG-Glu-PTX细胞毒性的研究 将乳腺癌细胞MCF-7、MDA-MB-231、肺癌细胞A549和正常细胞HELF接种于96孔培养板,每孔加入细胞1×104个,培养液100 μL,培养12 h后,分别取1 μL PTX、PEG-Glu-PTX、FA-PEG-Glu-PTX加入MCF-7细胞和正常细胞HELF,每组设6个复孔,置于CO2培养箱中培养。将培养24 h的细胞培养体系中的培养液用移液枪尽量吸干,取MTT,用含血清的DEME培养液配成5 g·L-1的溶液,加入上述体系。每孔加100 μL,室温放置2 h,用 DMSO终止反应。用酶标仪测定各孔吸光度值(OD值),测定波长为λ=490 nm,测定不同药物对3种肿瘤细胞和正常细胞HELF的细胞抑制率[9]。
3 结果
3.1 水溶性前药及中间产物的表征 谷氨酸-紫杉醇中间体(Glu-PTX)结构鉴定(Fig 2)。纯化后的-NH2-Glu(OtBu)-PTX用LC-MS分析,其质谱鉴定的结果与-NH2-Glu(OtBu)-PTX的理论分子质量1 283.4完全一致,证明已成功合成谷氨酸-紫杉醇中间体。
3.2 FA-PEG-Glu-PTX前药结构鉴定 用LC-MS鉴定FA-PEG-Glu-PTX分子质量,鉴定结果与FA-PEG-Glu-PTX的理论分子质量1 791.44完全一致(Fig 3),FA-PEG-Glu-PTX: MS (ESI, m/z): 1 791.44([M + H]+)。
3.3 FA-PEG-Glu-PTX的水溶性 按照上述PTX前药溶解度的计算方法,根据PTX的标准曲线方程为Y=0.776 96+0.035 08X(r2=0.999 01),重复3次,FA-PEG-Glu-PTX的溶解度为(6.08±0.14) g·L-1,与PTX原药(0.4 mg·L-1)相比,用多个水溶性小分子共价偶联PTX,大大提高了PTX原药的溶解性。
3.4 FA-PEG-Glu-PTX在不同溶液中释药动力学曲线 用HPLC测定紫杉醇峰面积,绘制出紫杉醇峰面积-浓度标准曲线,回归曲线方程为Y=65 535.650 35+17 388.998 22X(r2=0.999)。紫杉醇前药分别在PBS、血浆和细胞培养液中孵育4 h后,原药释放率分别是14.6%、23.8%和37.8%。由Fig 4可以看出,前药在PBS中释放速度最慢,在细胞培养液中释放速度最快,在血浆中的释放速度处于中间状态,这与细胞培养液和血浆中含活性酶有关。3.5 叶酸-PEG-谷氨酸-紫杉醇-FITC(FA-Glu-PTX-FITC)的细胞摄取实验 在2种肿瘤细胞和1种正常细胞中,叶酸受体蛋白表达量的顺序为:MDA-MB-231>MCF-7>A549>HELF (Fig 5A)。叶酸-PEG-谷氨酸-紫杉醇-5AF前药(FA-PEG-Glu-PTX-5AF)在3种肿瘤细胞和1种正常细胞中孵育 12 h后,在荧光显微镜下可以看到前药在叶酸配体-受体介导下进入肿瘤细胞,并显示出较强的荧光强度,而在正常细胞HELF中几乎看不到荧光(Fig 5B)。用流式细胞仪定量分析前药在MDA-MB-231、MCF-7、A549和HELF细胞中的摄取率分别为79.2%、64.1%、53.1%和6.8%,紫杉醇前药在MDA-MB-231肿瘤细胞中摄取量大于MCF-7和A549,3种肿瘤细胞的摄取量远远超过正常细胞,且4种细胞对前药摄取量的顺序为:MDA-MB-231>MCF-7>A549>HELF(Fig 5C),这与4种细胞表面叶酸受体表达量的顺序是一致的,说明紫杉醇前药可在肿瘤细胞表面高表达叶酸受体的介导下靶向肿瘤细胞。

Fig 2 Primary mass spectrum of-NH2-Glu(OtBu)-PTX.-NH2-Glu(OtBu)-PTX MS(ESI,m/z):1283.4([M+Na]+)

Fig 3 Primary mass spectrum of FA-PEG-Glu-PTX

Fig 4 HPLC of PTX from FA-PEG-Glu-PTX at 4 h incubation in rat plasma(CH3OH)
A:Release of PTX from FA-PEG-Glu-PTX at 4 h incubation in rat plasma(CH3OH) is 23.8%;B: Release of PTX from FA-PEG-Glu-PTX under different media
3.6 FA-PEG-Glu-PTX的细胞抑制率实验 Fig 6中,紫杉醇前药FA-PEG-Glu-PTX在正常细胞HELF中的细胞生存率明显高于PEG-Glu-PTX和PTX,表明 FA-PEG-Glu-PTX前药的细胞毒性小于PTX,但FA-PEG-Glu-PTX紫杉醇前药在3种肿瘤细胞中的细胞生存率低于PEG-Glu-PTX和PTX,说明FA-PEG-Glu-PTX与PTX原药相比较,在叶酸受体的介导下靶向叶酸受体表达量较高的肿瘤细胞,从而杀死肿瘤细胞,对叶酸受体表达量较低的正常细胞毒性较小。
4 讨论
当今对恶性肿瘤临床治疗手段主要是手术结合化学药物治疗。紫杉醇是疗效最确切的一线广谱抗癌药物,同时也是治疗乳腺癌最好的化疗药物之一,但由于紫杉醇本身的水溶性极差,在临床上使用时 所用溶剂为聚氧乙烯蓖麻油和乙醇的混合物,导致严重的毒副作用,限制了紫杉醇药物在临床上的应用[11-13]。

Fig 5 Targeting capability of fluorescence dye labeled PTX prodrugs in different tumor cell lines with different levels of expression of FA-α receptors
A:Protein levels of FR-α on the tumor and normal cell lines were determined by Western blot;B:Targeting ability of PTX prodrugs in MDA-MB-231, MCF-7, A549 and HELF cells(40×).Tumor cells showed increased uptake of PTX prodrug compared to the normal cell line with low FR protein expression;C:Flow cytometric analysis of FA-modified PTX prodrug in MDA-MB-231, MCF-7, A549 and HELF cells. FA-PEG-Glu-PTX-FITC prodrugs were uptaken into four cell lines about 79.2%,64.1%,53.1% and 6.8%.
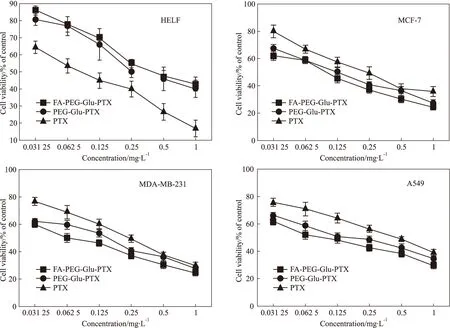
Fig 6 Antitumor and cytotoxic effects of FA-PEG-Glu-PTX on tumor cell lines and normal cell line HELF by cell viability ratio assay( n=6)
对于紫杉醇药物的改造主要集中在药物靶向前药的设计,用大分子作为紫杉醇的药物载体,并取得一定进展,如白蛋白-紫杉醇前药,但无论是大分子蛋白还是其它大分子材料作为难溶性药物载体都会诱导机体免疫原毒性,且大分子材料作为抗肿瘤药物剂型,存在包封率低、易渗漏、稳定性差等问题[14]。因此,本实验制备由多个功能性小分子通过共价偶联作为紫杉醇的载体,成功合成叶酸-PEG-谷氨酸-紫杉醇前药,其中叶酸作为“导向基团”,氨基PEG具有增溶剂和稳定剂的作用,氨基酸作为连接叶酸、氨基PEG和紫杉醇的Linker。实验结果证明多个水溶性较好的小分子偶合物可增加紫杉醇前药的水溶性,前药的溶解度为(6.08±0.14) g·L-1,是紫杉醇原药溶解度(0.4 mg·L-1)[15]的1×104倍。叶酸-PEG-谷氨酸-紫杉醇前药在PBS中释放药物速度最慢,在细胞培养液中释放的速度最快,血浆中释放速度处于两者之间,4 h可达到峰值,这为药物在体内滞留提供了充足的时间。通过对正常细胞和3种肿瘤细胞叶酸受体蛋白表达检测,可发现3种肿瘤细胞表面叶酸受体蛋白表达量远远大于正常细胞表面受体表达量,这与紫杉醇前药在3种肿瘤细胞中有较高摄取量是一致的。同样MTT实验结果也显示紫杉醇前药对3种肿瘤细胞抑制率高于正常细胞,证明叶酸-PEG-谷氨酸-紫杉醇前药在叶酸配体-受体介导下,靶向叶酸受体高表达的肿瘤细胞,而对叶酸受体表达较少的正常细胞毒性减小。
总之, 用多个功能性小分子修饰能提高紫杉醇前药的水溶性,并可在配体-受体的介导下,靶向肿瘤细胞,减少对正常细胞的细胞毒性,为开拓新型靶向性药物传递系统提供了新途径。
(致谢:感谢宿州学院药物生物技术研究所药物分析实验室为本项研究提供实验条件。)
[1] Singla A K, Garg A, Aggarwal D. Paclitaxel and its formulations[J].IntJPharm, 2002, 235(1-2):179-92.
[2] Duong H H, Yung L Y. Synergistic co-delivery of doxorubicin and paclitaxel using multi-functional micelles for cancer treatment[J].IntJPharm, 2014, 454(1): 486-95.
[3] Ma P, Mumper R J. Paclitaxel nano-delivery systems: a comprehensive review[J].JNanomedNanotechnol, 2014,4 (2):164-71.
[4] Xin H L, Jiang X Y, Gu J J,et al. Angiopep-conjugated poly(ethylene glycol)-co-poly(ε-caprolactone) nanoparticles as dual-targeting drug delivery system for brain glioma[J] .Biomaterials, 2013, 32(18):4293-305.
[5] Schreiner J, Thommen D S, Herzig P,et al. Expression of inhibitory receptors on intratumoral T cells modulates the activity of a T cell-bispecific antibody targeting folate receptor[J].Oncoimmunology,2015,5(2):29-37.
[6] Shan L L,Cui S S, Dua C L,et al. A paclitaxel-conjugated adenovirus vector for targeted drug delivery for tumor therapy[J].Biomaterials, 2012, 33(1):146-62.
[7] Yang T, Cui F D,Choi M K, et al. Enhanced solubility and stability of PEGylated liposomal paclitaxel:invitroandinvivoevaluation[J].IntJPharm, 2013, 29(2):317-26.
[8] Elsadek B, Graeser R, Esser N, et al. Development of a novel prodrug of paclitaxel that is cleaved by prostate-specific antigen: aninvitroandinvivoevaluation study[J] .EurJCancer, 2010, 46(18):3434-44.
[9] Greenwald R B, Pendri A, Bolikal D. Highly water soluble taxol derivatives: 7-polyethylene glycol carbamates and carbonates[J].JOrgChem, 1995, 60(2):331-6.
[10]李国灝, 李运柱,陈 琳. ATIR拮抗剂对膀胱癌细胞株生物学行为的影响及其机制研究[J]. 临床泌尿外科杂志, 2011, 26(3) :224-7,30.
[10]Li G H,Li Y Z,Chen L.The role of AT1R antagonist in the regulation of the biological behavior of bladder cancer cell lines and its mechanism[J].JClinUrol,2011,26(3):224-7,30.
[11]张琳华,何颖娜,马桂蕾,宋存先. 叶酸靶向紫杉醇聚合物纳米囊泡的制备及其抗肿瘤活性研究[J]. 中国药学杂志, 2014, 45(22) :1742-8.
[11]Zhang L H, He Y N, Ma G L, Song C X.Preparation,characterization,invitroandinvivostudies on folate-targeted biodegradable polymersomes loaded with paclitaxel[J].JChinPharmSci, 2010, 45(22):1742-8.
[12]杜芳芳,刘艳君,姜 丽,马 鑫.PI3K抑制剂LY294002抑制人巢癌耐紫杉醇细胞的增殖与迁移[J]. 中国药理学通报,2013, 29(12):1771-2.
[12]Du F F,Liu Y J,Jiang L,Ma X.Effects of PI3K inhibitor LY294002 on human paclitaxel-resistant ovarian cancer cell proliferation and migration[J].ChinPharmacolBull,2013, 29(12):1771-2.
[13]许成芳,李小毛,李 田,王小韵.紫杉醇对PTEN不同状态的子宫内膜癌细胞株的作用及其机制探[J]. 中国药理学通报,2011,27(11):1528-32.
[13]Xu C F,Li X M,Li T,Wang X Y.The effect of taxol on endometrial cancer cells with different PTEN status[J].ChinPharmacolBull,2011, 27(11):1528-32.
[14]Holvoet C, Vander Heyden Y, Lories G. Preparation and evaluation of paclitaxel-containing liposomes[J].Pharmazie, 2007, 62(2):126-32.
[15]Gupta N, Hatoum H, Dy G K. First line treatment of advanced non-small-cell lung cancer-specific focus on albumin bound paclitaxel[J].IntJNanomedicine, 2014, 9(1):209-21.
Preparation of anti-cancer water-soluble paclitaxel prodrug and its anti-cancer effect
ZHAO Su-hua1, YANG Xiu-qin2, ZHU Wei2, ZHENG Peng-cheng2,WANG Jin-jing2,SHAN Ling-ling2
(1.DeptofAnimalScience,SuzhouVocationalandTechnicalCollege,SuzhouAnhui234000,China; 2.InstituteofPharmaceuticalBiotechnology,SchoolofBiologyandFoodEngineering,SuzhouUniversity,SuzhouAnhui234000,China)
Aim Paclitaxel(PTX) has shown an effect against human cancer. However, serious drawbacks hamper PTX clinical use. Overcoming paclitaxel limitations is one of the best approaches to enhance water solubility.Methods In this study, water-soluble paclitaxel prodrug was prepared, folic acid-polyethylene glycol-glutamic-paclitaxel(FA-PEG-Glu-PTX) composed of folic acid(FA, target), amino acids(Glu, linker), and polyethylene glycol(PEG) in order to improve the solubilization and stability. The chemical structure and physicochemical property of prodrug were measured by LC-MS, solubility, drug release rate to evaluate the antitumor activity and cytotoxicity of FA-PEG-Glu-PTX. MTT assays were conducted on MDA-MB-231, MCF-7, A549 and HELF cell lines. FA-PEG-Glu-PTX prodrugs were labeled with 5 amino fluorescence visible fluorescent dye(5AF) for fluorescence microscopy.Results The successful conjugation of FA-PEG-Glu-PTX was confirmed by LC-MS, and had better water solubility, release rate curve.Invitrostudies indicated that foliate receptor(FR-α) mediated uptake of PTX-conjugated multi-small molecules carriers induced highly targeting ability, and antitumor activity, as well as reduced side toxicity effects of PTX. Conclusion FA-PEG-Glu-PTX has a good antitumor activity.
folic acid;paclitaxel prodrug;water-soluble; MTT test;tumor cells;targeting property
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.030.html
2016-08-10,
2016-09-11
国家自然科学基金资助项目(No 31400307);安徽省教育厅自然科学重点研究项目(No KJ2014A249)
赵素华(1965-), 女,博士生,副教授,研究方向:药物化学,E-mail:llwz0525@126.com; 单玲玲(1971-),女,博士,副教授,研究方向:肿瘤靶向探针及药物的合成,通讯作者,E-mail:414286713@qq.com
10.3969/j.issn.1001-1978.2016.12.015
A
1001-1978(2016)12-1711-07
R282.71 ;R329.24;R977.6;R979.1