评价胆红素对肌氨酸氧化酶法测定肌酐的干扰
2017-01-06张淑华李云凤赵宝鹤张吉奎杨亚轩高文育徐福海郑福和于水江王华新
张淑华,李云凤,赵宝鹤,张吉奎,杨亚轩,高文育,徐福海,郑福和,于水江,王华新
(1.黄骅开发区博爱医院,河北 黄骅 061100;2.唐山市丰润区疾控中心,河北 唐山 063000)
评价胆红素对肌氨酸氧化酶法测定肌酐的干扰
张淑华1,李云凤1,赵宝鹤2,张吉奎1,杨亚轩1,高文育1,徐福海1,郑福和1,于水江1,王华新1
(1.黄骅开发区博爱医院,河北 黄骅 061100;2.唐山市丰润区疾控中心,河北 唐山 063000)
目的评价胆红素对肌氨酸氧化酶法测定肌酐(Cr)的干扰。方法随机选择国内威高、长征、九强、生之源、基蛋、利德曼6种肌氨酸氧化酶法Cr试剂盒,按照美国临床实验室标准化协会EP 7-A2文件中“配对差异”和“剂量效应”方案,在正常和高值 Cr血清中添加不同浓度结合胆红素(CBIL)和游离胆红素(FBIL)干扰物,进行干扰评价试验。结果CBIL和FBIL对肌氨酸氧化酶法测定Cr存在不同程度的干扰。Cr正常水平,CBIL和FBIL≥120μmol/L时对威高、基蛋Cr试剂产生明显干扰,CBIL≥621μmol/L或 FBIL≥481μmol/L时对九强、生之源、长征 Cr试剂产生干扰;Cr高值水平,CBIL或FBIL≥120μmol/L时对威高 Cr试剂产生干扰,CBIL≥962μmol/L或 FBIL≥1083μmol/L时对长征 Cr试剂产生干扰。干扰所产生的相对偏倚差异显著,CBIL较比FBIL干扰作用更加明显。“剂量效应”结果显示,胆红素对 Cr测定产生负干扰并呈线性关系。结论国内肌氨酸氧化酶法测定 Cr试剂抗胆红素干扰能力不同,胆红素对 Cr测定产生负干扰并呈线性关系。临床实验室在应用肌氨酸氧化酶法测定 Cr时应进行胆红素干扰试验验证。
肌氨酸氧化酶法; 肌酐; 胆红素干扰; 干扰试验
肌酐(creatinine,Cr)是人体肌肉组织中肌酸及磷酸肌酸代谢终产物,血液中 Cr水平受饮食中摄取的外源性 Cr及人体内产生的内源性 Cr的影响,正常成人Cr生成速率基本稳定,血 Cr及尿 Cr测定广泛应用于评估肾小球滤过功能。国内大多实验室已将 Cr的Jaff碱性苦味酸法改进为酶法,在 3种酶法中应用较多的是肌酐酸偶联肌氨酸氧化酶法(简称酶法)。该法以Tinder为反应指示,该反应体系中易受胆红素、维生素 C等还原性物质干扰[1],胆红素的干扰可用亚铁氰化钾或胆红素氧化酶等清除。为评估国内肌酐酸偶联肌氨酸氧化酶法测定Cr抗胆红素干扰能力,随机选择国内6家不同 Cr试剂,依据美国临床实验室标准化协会(CLSI)EP 7-A2文件进行“配对差异”和“剂量效应”试验。
材料和方法
1 研究样本
选取门(急)诊、住院患者血清标本中,外观无溶血、黄疸、乳糜的正常和高值 Cr混合新鲜血清各20mL分为2管,1管用于批内精密度试验,1管用于“配对差异”试验。
2 试剂和仪器
随机选择6种国内 Cr试剂及配套校准品:山东威高批号20151201A、上海长征批号D1511083、武汉生之源批号 16030727-A2、北京九强批号15-1029、吉林 基 蛋 批号 S20151116、北 京利 德 曼 批 号5111911。质控品购 自伯乐 (BIO-RAD)批号 为lot14491、lot14492;干扰试剂盒为 Sysmex公司 APlus试剂盒,批号 ZS4003。检测 仪器 为Beckman5811全自动生化分析仪。
3 方法
3.1 Beckman5811全自动生化分析仪校准和质控
测试参数、仪器校准按照试剂说明书和仪器说明书设置、校准。在进行样本测定前按照质控 SOP文件进行室内质控,在控时进行样本检测。
3.2 批内精密度
按照 CLSI EP5-A2实验方案和要求进行精密度评价。Cr正常和高值 2种水平混合新鲜血清,用6种试剂在1天内每批间隔重复测试10次,按照 EP5-A2方案剔除离群值,计算均值(x)、标准差(s)、CV%值。根据我国WS/T 403-2012《临床生物化学检验常规项目分析质量目标》规定,Cr最大允许CV%为4.0%[1],本研究规定≤4.0%为批内精密度要求。
3.3 配对差异实验
3.3.1 样本准备
(1)参考 EP 7-A2文件,选择 Cr正常值和高值血清作为基础样本。
(2)按照 A-Plus试剂盒要求复溶结合胆红素(CBIl)、游离胆红素(FBIl)干扰试剂和空白液,复溶后干扰物FBIl和 CBIl浓度为3610μmol/L。
(3)分别用基础样本稀释复溶后的胆红素干扰试剂和 空 白 液,稀释 后 FBIl和 CBIl浓度 为1203μmol/L。将Cr正常值含 CBIl干扰试剂记作A1,Cr正常值含 CBIl空白液记作 B1,Cr正常值含FBIl干扰试剂记作C1,Cr正常值含FBIl空白液记作D1;Cr高值含CBIl干扰试剂记作A2,Cr高值含CBIl空白液记作B2,Cr高值含FBIl干扰试剂记作C2,Cr高值含 FBIl空白液记作 D2。
(4)按照 B1-A1、D1-C1、B2-A2、D2-C2配对稀释,稀释后 CBIl、FBIl系列浓度为1203、1083、962、842、722、602、481、361、241、120、0μmol/L共 22个样品。
3.3.2 确定重复测定次数
计算某浓度水平可接受的最大允许干扰值(dmax)与批内标准差(s)比值,查 dmax/s重测对应表[2],根据我国WS/T 403-2012《临床生物化学检验常规项目分析质量目标》规定,Cr允许最大bias为5.5%。
3.3.3 干扰效应
按照交互顺序检测 22个样品。正常及高值 Cr检测结果偏倚超过 dmax时为产生干扰效应。若存在干扰效应则进行干扰计量效应分析。
4 统计学分析
结果通过分析软件SPSS 22分析,计算x、s、CV,用最小二乘法进行回归分析,确定斜率、截距。
结 果
1 精密度
6种Cr试剂盒批内 CV均符合 WS/T 403-2012《临床生物化学检验常规项目分析质量目标》规定Cr最大允许 CV%为4.0%的要求,可以进行干扰试 验研究。具体数据见表1。

表 16种国内 Cr试剂日内精密度及 dmax/s(n=10)
2 配对差异试验
2.1 重复测定次数的确定
从表1可见,6种试剂检测 Cr正常值 dmax/s接近 2.5,经查表[2],样本重复次数为 5次;Cr高值dmax/s最小值为 3.25>3,查表确定重复测定次数为3次。
2.2 干扰效应
干扰效应判断标准:基础Cr浓度 ×(1-5.5%)为 cut-off值,当检测值<cut-off值时可判断为产生干扰。6种试剂测定正常和高值Cr的 cut-off值见表2。
根据表2中 cut-off值,分析表3、表4数据表明,胆红素对6种试剂检测 Cr均存在干扰,但产生干扰时胆红素浓度差异较大。Cr正常水平,CBIL和FBIL≥120μmol/L时对威高、基蛋试剂产生明显干扰,CBIL≥621μmol/L或 FBIL≥481μmol/L时对九强、生之源、长征试剂产生干扰;Cr高值水平,CBIL或FBIL≥120μmol/L时对威高试剂产生干扰,CBIL≥962μmol/L或FBIL≥1083μmol/L时对长征试剂产生干扰。361μmol/L CBIL、FBIL干扰产生的相对偏倚见表5。从表3和表4结果计算可知,相同浓度干扰物对不同厂家的试剂所产生干扰的相对偏倚差异显著,以上数据也显示,相同浓度下CBIL对测定Cr干扰强于 FBIL,威高和基蛋试剂表现更加明显(P<0.05)。

表2 6种试剂测定Cr干扰效应 cut-off值(μmol/L)
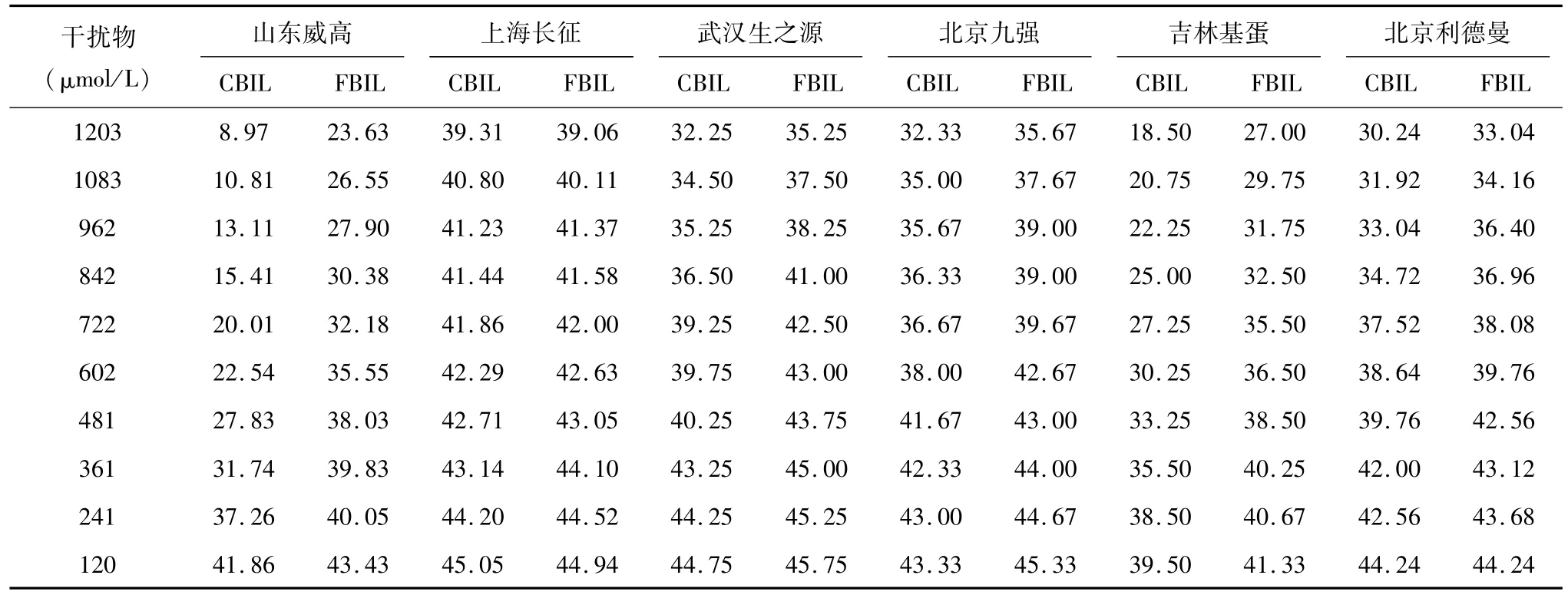
表3 CBIL和 FBIL干扰正常 Cr水平检测结果(x,μmol/L)

表4 CBIL和 FBIL干扰高值 Cr水平检测结果(x,μmol/L)

表5 361μmol/L CBIL、FBIL浓度产生的相对偏倚(%)
根据表2、表3和表4比较 CBIL和 FBIL产生干扰效应浓度,见图1、图2。
图 1和图 2显示,威高和基蛋试剂抗胆红素干扰能力较弱,九强和长征抗胆红素干扰能力较强。
2.3 剂量效应
除长征和九强在胆红素极高浓度下产生干扰且产生较小偏倚外,其他4种试剂测定正常和高值Cr胆红素均产生了明显干扰效应,胆红素对测定产生负干扰,4种试剂剂量效应分析结果见表6。

表6 CBIL和 FBIL剂量效应分析
讨 论
胆红素(bilirubin)是由体内铁卟啉化合物代谢产生的具有抗氧化性的混合物,主要有两种存在形式,一类与白蛋白结合的称为结合胆红素(CBIL),另一类未与白蛋白结合的称为游离胆红素(FBIl)。胆红素不仅因颜色特性对比色检测方法有干扰,而且因其具有抗氧化性对 Tinder反应指示的反应体系也有干扰。胆红素对酶法测定肌酐产生负干扰,这是因为胆红素作为还原剂与 Tinder反应体系中氧化剂 H2O2发生反应,使得终产物减少,如在R1试剂中加入亚铁氰化钾、抗坏血酸氧化酶、胆红素氧化酶等可消除胆红素的干扰[3]。
Nah[4]调查了4种酶法和2种 Jaffe法测定 Cr试剂,调查结果显示,4种酶法试剂不受总胆红素(中位数165.1μmol/L,范围75.58~330.17μmol/L)干扰;国秀芝[5]调查比较了 4种国产和 2种进口酶法Cr试剂抗胆红素干扰能力,当 CBIL≤332μmol/L、FBIL≤327μmol/L时对6种Cr试剂无干扰。本次研究随机选择的国内6种酶法试剂,结果显示,除了长征和九强试剂外,威高、基蛋、利德曼、生之源4种试剂受 CBIL、FBIL干扰明显,CBIL比FBIL干扰相对较强。当CBIL浓 度 接 近 国 秀 芝[5]试验浓度(332μmol/L)时,正常 Cr水平,威高、基蛋、利德曼、生之源试剂相对偏倚分别为 47.10%、24.65%、9.33%、9.25%;高值 Cr水平,威高、基蛋、利德曼、生之源试剂相对偏倚分别为 30.55%、13.72%、5.96%、5.60%。相对偏倚均超过我国 WS/T 403-2012《临床生物化学检验常规项目分析质量目标》中规定的Cr允许最大 bias为 5.5%的标准[1]。6种酶法 Cr试剂盒抗胆红素干扰能力差异明显,推测可能是试剂中添加破坏胆红素干扰物质的量不同。
Cr是临床最常用的肾功能指标,是评估肾小球滤过率(GFR)的重要参数,检测结果的准确性直接影响肾病分期、评估预后[6]。对急性或慢性肾病合并黄疸时或黄疸合并肾病患者,能避免胆红素干扰而准确检测 Cr,正确评估 GFR显得尤为重要。应用酶法检测 Cr时进行抗干扰能力性能验证,若存在明显干扰时可经剂量效应试验建立回归方程,对测定结果进行回归分析可得出较为准确的结果。
CBIL和 FBIL都均有抗氧化剂作用,对测定Cr都具有干扰作用,但干扰效应不同,其产生机制尚待进一步研究。
总之,本研究发现国内酶法 Cr试剂抗胆红素能力存在显著差异,胆红素对Cr测定存在负干扰并呈线性关系。试剂厂家应在说明书中明确其抗干扰能力,临床实验室在应用时应进行干扰试验验证。
[1]尚红,王毓三,申子瑜.全国临床检验操作规程.第4版.北京:人民卫生出版社,2015:309-1015.
[2]杨有业,张秀明.临床检验方法学评价.北京:人民卫生出版社,2008:59-234.
[3]郭洪晨,刘静.胆红素对临床检验结果的干扰及消除.检验医学与临床,2009,6(18):1573-1575.
[4]Nah H,Lee S G,Lee K S,et al.Evaluation of biliruin interference and accuracy of six creatitine assays compared with isotope dilution-liquid chromatography mass spectrometry.Clin Biochem,2016,49(3):274-281.
[5]国秀芝,邱玲,吴洁,等.四种国产和两种进口酶法肌酐试剂的分析性能及准确度验证.中华检验医学杂志,2013,36(9):806-811.
[6]刘海燕,李伟娜,肖波,等.胱抑素C临床检验及在肾脏疾病应用中的研究进展.河北医药,2015,37(21):3311-3315.
(李 雁 张增武编辑)
Evaluation of Biliruin Interference of Creatinine by Sarcosine Oxidase Method
ZHANG Shu-hua,LI Yun-feng,ZHAO Bao-he,ZHANG Ji-kui,YANG Ya-xuan,GAO Wen-yu,XU Fu-hai,ZHENG Fu-he,YU Shui-jiang,WANG Hua-xin
(Boai Hospital of Huanghua City,Huanghua 061100,China)
ObjectiveTo investigate the interference and result bias of bilirubin by Sarcosine oxidase method in determination of creatinine.MethodsTo evaluate the anti-interference ability,we randomly selected 6 kinds ofSarcosine oxidase method forthe determination ofcreatinine(WEIGAO,CHANGZHENG,SHENGZHIYUAN,JIUQIANG,JIDAN,LIDEMAN).According to the“paired difference”and“doseresponse”documents from Clinical and Laboratory Standards Institute NCCLS EP7-A2, the interference tests were conducted by adding different concentrations of conjugated bilirubin(CBIL)and freed bilirubin(FBIL)to normal and high levels creatinine in serum.ResultsThe CBIL and FBIL had different degrees of interference to the determination of creatinine,but the anti-interference ability of the reagents was different.At normal creatinine level,WEIGAO or JIDAN revealed interference when CBIL and FBIL≥120μmol/L.When CBIL≥621 μmol/L or FBIL≥481 μmol/L,JIUQIANG,SHENGZHIYUAN and CHANGZHENG revealed interference.At high creatinine levels,WEIGAO also demonstrated interference with CBIL or FBIL≥120μmol/L,CHANGZHENG with≥962 μmol/L CBIL and CHANGZHENG with≥1083 μmol/L FBIL respectively.The relative bias caused by interference was significantly different.The CBIL interference effect was more obvious than the FBIL.The results of“dose-response”showed that there was a negative interference in the determination of serum creatinine with bilirubin,and there was a linear function relationship.ConclusionThe interference ability of anti bilirubin interference in the determination of creatinine reagent was different,and there was a negative interference in the determination of serum creatinine withbilirubin and there was a linear function with them.Clinical laboratories should always conduct validation of bilirubin interference for the determination of creatinine by sarcosine oxidase method.
Sarcosine oxidase method; Creatinine; Bilirubin interference; Interference testing
10.11748/bjmy.issn.1006-1703.2016.12.032
2016-07-01;
2016-09-27
河北省卫计委指令性课题(1120140226)
李云凤。E-mail:wanghuaxin004@163.com
