芸豆种质资源抗根腐病鉴定
2017-01-05郭宝德白琪林冀丽霞黄穗兰
郭宝德,白琪林,冀丽霞,黄穗兰
(山西省农业科学院作物科学研究所,山西太原030031)
芸豆种质资源抗根腐病鉴定
郭宝德,白琪林,冀丽霞,黄穗兰
(山西省农业科学院作物科学研究所,山西太原030031)
采用人工接种鉴定方法,鉴定了106份芸豆种质资源对根腐病的抗性,根据病圃芸豆根腐病病情指数分为高抗、抗、中抗、感病和高感5个等级。结果表明,通过抗病试验筛选出高抗种质资源9份,抗级种质资源25份,进一步讨论了抗病种质资源的创制及合理利用方法与技术。
芸豆;种质资源;根腐病;抗病鉴定
山西是红芸豆的主产区[1]。由于田间管理粗放,多年重茬种植和防病意识不强,红芸豆根腐病已成为山西省红芸豆生产中的主要病害[2-4],有逐年加重、扩散蔓延的趋势,从而造成产量降低,品质下降,直接影响了农民收入。
红芸豆根腐病是由芸豆腐皮镰孢菌侵染而引起的一种土传真菌病害。病菌主要以菌丝体和厚垣孢子在土壤中的病残体上越冬,腐生性很强,在土壤里可腐生10 a以上。病菌传播方式主要有种子带菌、肥料带菌和土壤侵染3种,病菌由植株根部伤口侵入。高温高湿是根腐病发病的条件,土壤黏重、低洼积水、基肥不腐熟和多年重茬等,都是诱发该病的重要条件[5-7]。高温有利于病菌的繁殖,高湿使得作物根系生长不良,土壤板结,根系生长受抑制时发病重;土壤黏重及低洼地、重茬地发病重。发病严重时会造成成片死秧。
虽然通过药剂拌种和栽培措施有一定的防治效果,但是存在生产成本上升、环境污染加重且防治效果不稳定的问题。因此,拓宽芸豆种质资源,挖掘抗病种质基因,加强抗病育种是防治芸豆根腐病的最有效的途径[8-9]。抗病芸豆新品系的培育是抗逆育种的基础,因此,需要明确不同育种材料对根腐病的抗性差异,为培育抗病种质资源提供基础材料[10-11]。
本试验通过人工接种鉴定的方法,对106份芸豆种质资源进行了抗根腐病鉴定,以明确不同芸豆种质资源的抗病性差异,同时对不同类型的抗病芸豆种质资源进行分析,进一步探讨其在抗性育种上的应用价值。
1 材料和方法
1.1 材料
鉴定材料从山西、河北、黑龙江、内蒙古、新疆、云南主要芸豆种植省份收集。首先在芸豆连作5 a以上地块种植,淘汰自然发生根腐病的材料,筛选出未有根腐病症状的材料106份。其中,红芸豆种质资源62份,黑芸豆种质资源26份,花芸豆种质资源9份,白芸豆种质资源9份。病株采集于红芸豆种植大县苛岚县、神池县、代县芸豆连作5 a以上的发病田。
1.2 病原菌制备
1.2.1 病菌制备将采集回来的病株分别接入普通培养基(马铃薯葡萄糖(PDA))和专选择性培养基(察氏、胡萝卜、没食子、燕麦琼脂培养基)上进行培养[12-13],温度控制在(26±1)℃,孢子长出后随即进行单孢分离、纯化培养,将长满菌丝的培养基风干后粉碎、封装[14];同时制备空白培养基一份。
1.2.2 根腐病病菌滤液的制备取病原菌培养基及空白培养基各20 g,加入1 000 mL无菌水,在(26±1)℃恒温条件下浸提40~42 h,过滤后得到根腐病病原菌原液和空白培养基原液。
1.3 接种方法
试验用土壤进行高温灭菌,花盆、种子也要严格消毒,鉴定用营养钵规格为直径18 cm、高16 cm,每盆播种10粒,置于(26±1)℃下恒温培育幼苗,2 d浇一次蒸馏水。病原滤液浓度在10×10倍显微镜下,每视野8~10个孢子,于芸豆播种的当天、第7天和第11天各接种1次,每盆30 mL,重复3次,以空白培养基为对照。第20天用水将盆土充分浸泡,将土坨轻轻倒出,用小水流慢慢冲洗根系附泥,检测根部发病情况。
1.4 病情指数分级标准
病情指数分级标准:0级,地下茎和根无病;1级,地下茎和根有零星病斑,但不连片,须根上无病斑;2级,地下茎和根有较多病斑,病斑面积占茎和根总面积的1/4以下,须根略微发病;3级,地下茎和根有多数病斑,病斑面积占茎和根总面积的1/4以上,但不足1/2,幼苗生长受阻,须根减少;4级,地下茎和根病斑面积占茎和根总面积的1/2以上,须根病斑连片,部分须根脱落;5级,地下茎和根布满病斑,须根全部脱落,主根变黑、缢缩[15-16]。
1.5 抗性评价指标
种质群体对根腐病的抗性依病情指数(DI)分为5级,分别为:高抗(HR),DI≤20;抗病(R),20<DI≤40;中抗(MR),40<DI≤60;感病(S),60<DI≤80;高感(HS),DI>80[17-18]。

2 结果与分析
2.1 芸豆种质资源根腐病的抗性鉴定结果
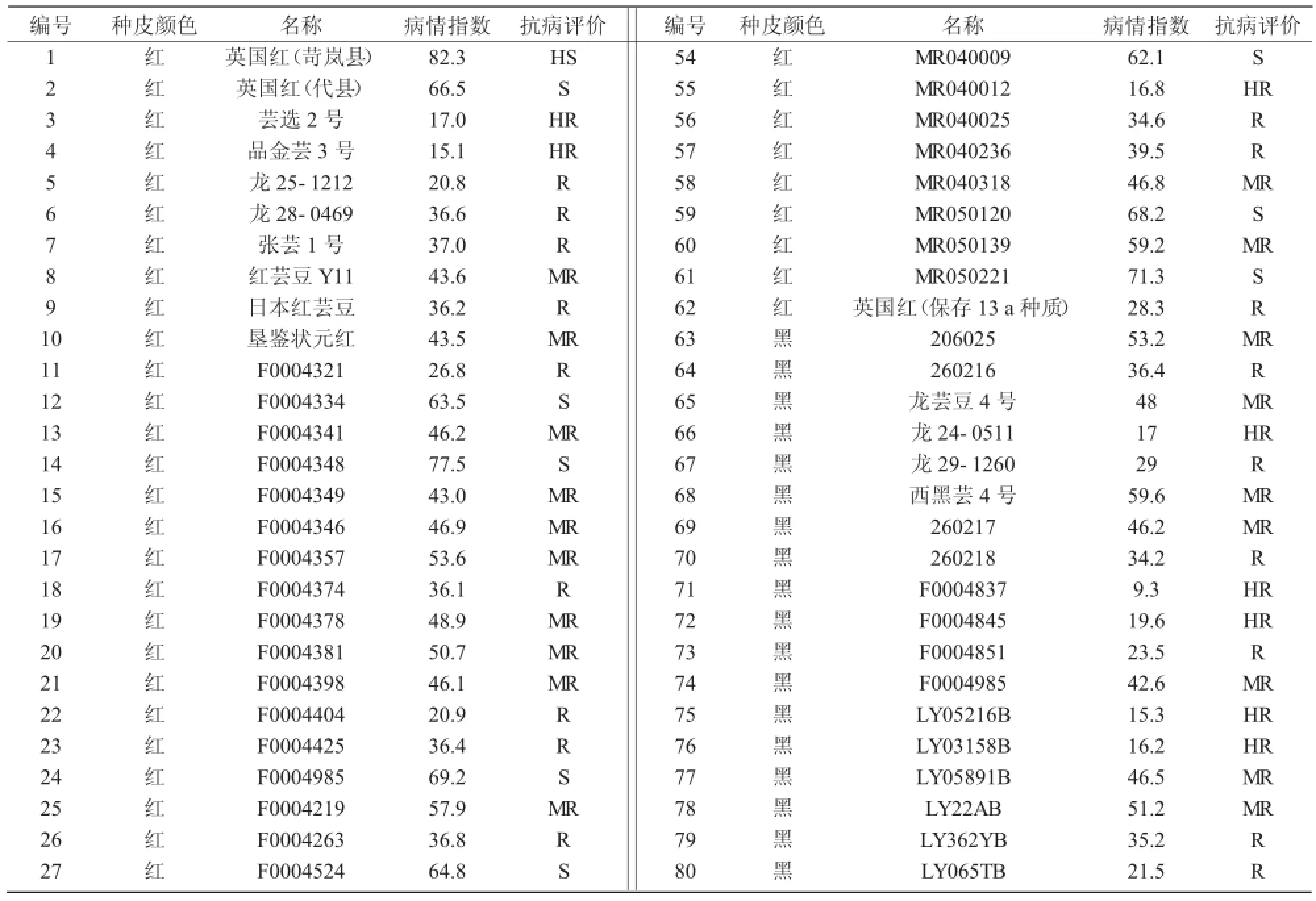
表1106 份芸豆种质资源抗根腐病鉴定结果

续表1
从表1可以看出,不同类型芸豆种质资源的抗性差异较大。106份供试种质系中,62份红芸豆中有3份表现高抗,分别占同类芸豆总数和鉴定芸豆总数的4.8%和2.8%,14份表现抗病,分别占同类芸豆总数和鉴定芸豆总数的22.6%和13.2%;26份黑芸豆中6份表现高抗,分别占同类芸豆总数和鉴定芸豆总数的23.1%和5.7%,11份表现抗病,分别占同类芸豆总数和鉴定芸豆总数的42.3%和 10.4%;9份白芸豆及9份花芸豆中未筛选出高抗及抗性材料。由此可见,黑芸豆种质资源中筛选出高抗及抗性的概率最高,红芸豆种质资源中筛选出高抗及抗性的概率明显低于黑芸豆(表2),而花芸豆和白芸豆没有筛选出抗性资源。鉴定结果表明,供试芸豆资源高抗根腐病的材料较少,仅占8.5%,且主要出现在黑芸豆和红芸豆资源中,这可能与2类芸豆资源数量上的优势有关。

表2 不同类型芸豆的抗根腐病检测结果比较
2.2 根腐病发病逐年加重原因
英国红芸豆在山西省主产区有30多年的种植历史,是山西芸豆生产上的主栽品种。但近年根腐病发生严重,产量连年下降。究其原因,除多年连作根腐病致病真菌在土壤不断累积、真菌密度持续上升的原因外,英国红芸豆品种退化严重使得抗病性下降也是发病重的重要原因[19](表3)。从表3可以看出,英国红芸豆品种退化不仅造成百粒质量减小,产量降低;品种抗病性更是大幅下降。品金芸3号和芸选2号是山西省近几年审定的新品种,由抗性评价结果可以看出,这2个芸豆品种抗芸豆根腐病,而且产量高,已在生产上大面积推广,说明了抗芸豆根腐病育种的重要性。

表3 山西省推广红芸豆根腐病抗性及产量性状比较
3 讨论
3.1 红芸豆抗病资源的拓展
我国红芸豆育种依赖的种质资源绝大部分来源于引进的英国红芸豆及其衍生系,还有一部分来源于地方品种。遗传基础狭窄、种质资源匮乏导致品种的抗病性较差,芸豆产区各种病害的大面积发生,影响了芸豆的产量和品质,损失较大。因芸豆遗传基础狭窄导致的遗传脆弱性已成为现实威胁。因此,芸豆育种工作应在充分利用现有抗病系的基础上,加强抗病新种质资源的引进和鉴定工作;同时从其他类型的芸豆上寻找新的抗病遗传基因,通过现代生物技术创造新的红芸豆抗病资源。我国芸豆类型的多样性为抗病种质提供了丰富的遗传基础,分子标记技术和转基因工程等方法的有机结合,必将促进我国芸豆抗病新品系培育工作的进展。
3.2 抗病资源的利用
抗病资源的抗性不是永恒的,其中有品种退化造成抗病性下降的因素,还有自然条件下所有物种都会发生一定概率的变异,变异产生根腐病新的致病生理小种也是抗病性下降的主要成因。因此,芸豆育种中除了对抗病资源材料繁殖利用时要严格采取保纯去杂防混措施外,还应及时发现和利用抗新致病生理小种的品系,从而提高抗病品系的广谱性。
[1]廖琴.浅析我国芸豆产业发展现状及对策[J].中国小杂粮,2003(10):28.
[2]高润明,游爱新,党利罡.红芸豆根腐病的发生和防治措施[J].山西农业,2007(4):43.
[3]刘伟.红芸豆根腐病防治技术探讨[J].农业技术与装备,2012(22):69-70.
[4]孟凡亮,刘金凤.早春芸豆根腐病的发生与防治[J].植保技术与推广,1995(2):25-26.
[5]王春华,章建新,谢东升,等.新疆大豆根腐病病原及防治技术初报[J].新疆农业大学学报,2004,27(4):7-11.
[6]李长松,罗瑞梧.黄淮地区大豆根腐病病原菌分离及致病性研究[J].植物保护学报,1996,23(2):187-188.
[7]董金皋.农业植物病理学[M].北京:中国农业出版社,2007.
[8]王福海,将寰林.芸豆栽培技术[J].现代化农业,1996(11):19-20.
[9]程益军,欧胜伟,袁云福,等.英国红芸豆栽培技术[J].现代化农业,2001(3):20.
[10]张志清,李莉,曹静,等.英国红芸豆特征特性及高产栽培技术[J].中国农技推广,2007(3):30.
[11]王建雄,韩美善,宁秀蓉,等.晋西北芸豆引种试验与推广[J].山西农业科学,2008,36(10):25-27.
[12]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1995.
[13]张中义,冷怀琼.植物病原真菌学[M].成都:四川科学技术出版社,1986.
[14]陆家云.植物病原真菌学[M].北京:中国农业出版社,2001.
[15]连荣芳,王梅春,墨金萍,等.豌豆种质资源抗根腐病鉴定及利用价值分析[J].作物杂志,2012(6):111-114.
[16]王梅春,连荣芳,墨金萍,等.甘肃豌豆根腐病研究及抗病育种[J].杂粮作物,2008(4):272-273.
[17]宋刚,徐玉明.豌豆品种抗根腐病鉴定初报[J].杂粮作物,2001(4):40-41.
[18]王春华,孙超,刘淑燕.新疆花芸豆根腐病病原及防治的初步研究[J].干旱区研究,2010(3):380-384.
[19]王余文,黄云才,于江飞.芸豆品种提纯方法[J].种子科技,2006(2):56.
Evaluation of Resistance to Kidney Bean Root Rot in Kidney Bean Germplasm
GUOBaode,BAI Qilin,JI Lixia,HUANGSuilan
(Institute ofCrop Sciences,Shanxi Academy of Agricultural Sciences,Taiyuan 030031,China)
106 kidney bean germplasms were evaluated for their resistance to kidney bean root rot by artificial inoculating. According to the disease index of the diseased plants,the infected plants on a scale were distinguished as highly resistant,resistant, moderately resistant,susceptible and highly susceptible.The results showed that 9 kidney bean germplasms were high resistant,25 germplasms were resistant,and discussion was made about the development of resistant germplasms and the method and technology of reasonable application in kidney bean germplasms.
kidney bean;germplasms resource;root rot;resistance evaluation
S529
A
1002-2481(2016)10-1522-04
10.3969/j.issn.1002-2481.2016.10.24
2016-06-13
山西省科技攻关项目(20130311007-1)
郭宝德(1969-),男,山西寿阳人,研究员,主要从事芸豆遗传育种研究工作。
