一株高效降解玉米蛋白粉枯草芽孢杆菌的筛选及其发酵特性研究
2017-01-05王雨婷缪礼鸿周凤鸣刘蒲临
■王雨婷 缪礼鸿周凤鸣 刘蒲临
(武汉轻工大学生物与制药工程学院,湖北武汉 430023)
玉米蛋白粉是玉米湿法加工淀粉厂主要的副产物之一,由玉米籽粒经过0.1%~0.2%的亚硫酸钠浸泡、破碎、洗涤后湿磨制得的粗淀粉乳再经分离压滤干燥而成[1]。玉米蛋白粉蛋白质含量60%以上,其余约为20%的淀粉和少量酯类、玉米黄素、叶黄素等[2]。由于玉米蛋白粉中的蛋白质主要为不溶性的醇溶蛋白[3],而且食味性差,严重影响其在食品和饲料工业中的应用[4-5]。将玉米蛋白经酶或微生物发酵水解得到的小分子高活性玉米肽具有易于消化吸收、抗氧化、延缓衰老等功能[6-7]。微生物发酵法制备活性肽具有减少苦味产生等优点,是一种具有发展潜力的处理方法[8]。国内已有研究者采用芽孢杆菌[9-10]和真菌[11]对玉米蛋白粉进行发酵和工艺优化方面的研究。
鉴于芽孢杆菌具有生长快速、耐受性好、产蛋白酶等活性高、安全性好等优点[12],本试验以玉米蛋白粉为主要原料,进行降解玉米蛋白粉高效益生芽孢杆菌菌株的筛选、菌株耐亚硫酸钠特性的比较和玉米蛋白粉液态发酵制备玉米肽工艺优化研究,为提高玉米蛋白粉的资源开发[13]和利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 样品及菌种来源
玉米蛋白粉:市购;酸性蛋白酶制剂:湖南新鸿雁鹰生物工程有限公司;中性蛋白酶和碱性蛋白酶制剂:南宁庞博生物工程有限公司;地衣芽孢杆菌S14、枯草芽孢杆菌S37和大肠杆菌E601:均为本实验室冷冻保藏菌株。
1.1.2 主要试剂
酵母粉、蛋白胨:安琪酵母股份有限公司。
测定蛋白酶活的试剂:无水碳酸钠溶液、三氯乙酸溶液、磷酸缓冲液、酪蛋白、100 μg/ml酪氨酸标准溶液、福林酚试剂。
测定可溶性蛋白的试剂:NaOH溶液、硼酸溶液、0.1 mol/l盐酸溶液、甲基红-溴甲酚绿指示剂。以上试剂均为国产分析纯。
1.1.3 培养基
玉米蛋白粉平板筛选培养基:KH2PO43.0 g/l、玉米蛋白粉 7.5 g/250 ml、K2HPO42.0 g/l、NH4Cl 0.1 g/l、MgSO4·7H2O 0.2 g/l、NaCl 5.0 g/l、蛋白胨1.5 g/l、牛肉膏0.6 g/l、琼脂20 g/l、蒸馏水1.0 L,pH值7.0~7.5。
牛肉膏蛋白胨培养基:牛肉膏5.0 g/l、蛋白胨10.0 g/l、NaCl 5.0 g/l、蒸馏水1.0 L,pH值7.0~7.5。固体培养基加入20 g/l琼脂。
LB培养基:胰蛋白胨5.0 g/l、蛋白胨10.0 g/l、Na⁃Cl 10.0 g/l、琼脂 20 g/l、蒸馏水 1.0 L,pH值7.0。
亚硫酸钠生长培养基:牛肉膏 3.0 g/l、酵母浸粉2.0 g/l、蛋白胨 10.0 g/l、NaCl 5.0 g/l、无水亚硫酸钠2.0 g/l、蒸馏水 1.0 L,pH值7.0~7.5。
玉米蛋白粉基础发酵培养基:玉米蛋白粉80 g/l、KH2PO41.65 g/l、K2HPO40.5 g/l、CaCl20.1 g/l、NaCl 0.5 g/l、蛋白胨 2.0 g/l、蒸馏水 1.0 L,pH值8.0。
玉米蛋白粉优化发酵培养基:玉米蛋白粉40 g/l、KH2PO41.65 g/l、K2HPO40.5 g/l、CaCl20.1 g/l、NaCl 0.5 g/l、蛋白胨 2.0 g/l、蒸馏水 1.0 L,pH值7.5。
以上培养基根据pH值不同皆用6 mol/l NaOH溶液调配,灭菌条件为121℃、20 min。
1.2 仪器与设备
DNP-9082恒温培养箱(上海精宏实验设备有限公司);ZQLY-300F振荡培养箱(上海知楚仪器);WH-3微型旋涡混合仪(上海沪西分析仪器厂有限公司);HH-6恒温水浴锅(国华电器有限公司);UV-5900PC紫外可见分光光度计(上海元析仪器有限公司);SH220石墨消解仪(海能仪器);SD-1500喷雾干燥机(迪沃设备)。
1.3 实验方法
1.3.1 降解玉米蛋白粉芽孢杆菌的筛选
从豆粕样品中各取10 g分别加至装有90 ml无菌水的三角瓶中。摇匀后放入80℃恒温水浴锅中处理20 min,然后摇匀稀释,分别取10-3、10-4、10-5三个稀释度涂布到玉米蛋白粉平板筛选培养基上,于30℃恒温培养箱中培养72 h,每隔12 h观察测定菌落周围透明圈的大小[14]。
1.3.2 碱性蛋白酶活力的测定
福林酚试剂法[15]测定出筛选得到的菌株的碱性蛋白酶活性,比较碱性蛋白酶活性大小。
蛋白酶活的计算公式:
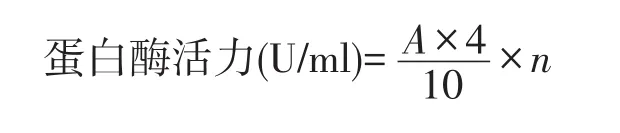
式中:A——由样品测得净OD值,查标准曲线得相当的酪氨酸微克数(μg);
4——4 ml反应液总体积(取出1 ml测定即4倍);
n——酶液稀释的倍数;
10——反应时间(min)。
1.3.3 序列分析和菌种鉴定
对筛选到的蛋白酶活性较高的菌株进行16S rD⁃NA测序。细菌DNA采取试剂盒抽提后,PCR扩增16S rDNA,细菌的16S rDNA引物为27F和1492R。反应体系采用50 μl的反应体系。测序结果采用BioaEdit软件人工校对拼接,拼接后的序列在NCBI核酸序列数据库中进行同源序列搜索。根据同源序列搜索结果,选取与测试菌株关系较近的模式菌株的16S rDNA区序列,用MEGA软件采取邻接法构建系统发育树。
1.3.4 芽孢杆菌无菌滤液对大肠杆菌的抑制作用
采用牛津杯法[16],将芽孢杆菌和大肠杆菌种子液培养18 h,离心后取上清液经过无菌滤膜过滤,分别调整到适当的浓度。吸取0.1 ml大肠杆菌无菌滤液涂布于LB平板上,用无菌镊子取灭菌后的牛津杯(外径8 mm)置于其上,轻压,使杯底紧贴于培养基上。每个牛津杯加入0.15 ml芽孢杆菌无菌滤液。然后将培养皿置于30℃恒温培养24 h,测抑菌圈直径(包括牛津杯直径)。
1.3.5 亚硫酸钠对细菌生长影响的测定方法
用接种环挑取待测菌株于牛肉膏液体培养基中,在37℃、170 r/min的条件下振荡培养18 h,将此菌液按5%的接种量分别接种于玉米蛋白粉基础发酵培养基和亚硫酸钠生长培养基中,在37℃、170 r/min条件下振荡培养48 h,每隔12 h取样,经适当稀释后涂布于牛肉膏平板培养,测细菌活菌数。
1.3.6 玉米蛋白粉发酵工艺优化方法及可溶性蛋白含量计算方法
挑取经平板活化的X1-1菌株接种于牛肉膏液体培养基中培养,再将此种子液按一定比例接种于玉米蛋白粉发酵培养基中,在初始发酵条件(培养基pH值8.0、接种量5%、摇床转速170 r/min、培养温度37℃、培养时间48 h)的基础上,采用单因素试验对培养基中玉米蛋白粉含量、培养基pH值、接种量、发酵温度、摇床转速及发酵时间等工艺参数进行优化。发酵液经离心(4 000 r/min、10 min)后取上清液,采用凯氏定氮法(GB5009.5-2010)测定可溶性蛋白含量。
可溶性蛋白含量的计算公式:
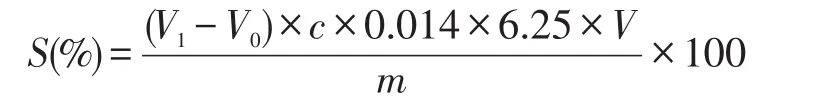
式中:S——可溶性蛋白含量(%);
V1——样品滴定消耗盐酸的量(ml);
V0——空白滴定消耗盐酸的量(ml);
c——盐酸标准液浓度(mol/l);
6.25 ×0.014——蛋白质转换系数;
V——可溶性蛋白的体积(ml);
m——样品的质量(g)。
1.3.7 喷雾干燥样品制备及小肽含量计算方法
对玉米蛋白粉发酵液进行喷雾干燥处理,物料进风温度为180℃,出风温度控制在75~90℃之间,蠕动泵转速为1 800 ml/h,风机速度为50 Hz[17]。喷雾干燥后,凯氏定氮法(QB/T2653-2004)测定样品中的粗蛋白、小肽含量[18]。
小肽的计算公式:

式中:V1——酸溶蛋白滴定消耗盐酸的量(ml);
V2——粗蛋白滴定消耗盐酸的量(ml);
V0——空白滴定消耗盐酸的量(ml);
3——酸溶蛋白检测过程中,样品稀释的倍数。
1.3.8 蛋白肽的电泳分析
制备凝胶,采用分离胶和浓缩胶组成的凝胶板,下层为分离胶,上层为浓缩胶。发酵样品经无菌水稀释一定的浓度后,离心(8 000 r/min,10 min),分别取上清液和沉淀物与buffer处理,原料做同样的处理,作为对照组。用微量进样器取混合液20 μl加于凝胶的每个凹槽中,在电泳槽中注入Tris-甘氨酸缓冲液,控制电泳电流电压,电泳2~3 h后结束,再用0.25%考马斯亮蓝染色1 h,最后用甲醇-冰醋酸脱色,将胶板放入凝胶成像系统进行照相与分析。
2 结果与分析
2.1 降解玉米蛋白粉芽孢杆菌菌株的筛选
2.1.1 芽孢杆菌透明圈(H/C)值的测定结果
从3个豆粕样品中共分离获得10株水解圈较明显的芽孢杆菌菌株,透明圈(H/C)值,如表1所示。X1-1,Xla,X1-3-1这三种菌株透明圈(H/C)值相对较大,其中X1-1最大,可达1.60。

表1 10株产蛋白酶芽孢杆菌透明圈(H/C)值
2.1.2 碱性蛋白酶活性测定结果
筛选出的10株芽孢杆菌在玉米蛋白粉基础发酵培养基中发酵,其发酵液的碱性蛋白酶活性测定结果如表2所示。X1-1、X1-3-1、X1a这三菌株透明圈值相对比较大,碱性蛋白酶活性也比较高。

表2 碱性蛋白酶活性测定结果
2.2 三株芽孢杆菌的系统进化树
对筛选到的三株蛋白酶活性较高的芽孢杆菌进行16S rDNA基因测序分析,与已知细菌的16S rDNA序列的相似性比较结果如图1所示。X1-1菌株与Ba⁃cillus subtilis的16S rDNA序列同源性达100%,鉴定为枯草芽孢杆菌;而X1-3-1和X1a菌株与Bacillu am⁃yloliquefacien的16S rDNA序列同源性均达100%,鉴定为解淀粉芽孢杆菌。
2.3 芽孢杆菌对大肠杆菌抑制作用的结果
3株芽孢杆菌对大肠杆菌E601的平板抑菌圈直径值(D-d)测定结果见表3。枯草芽孢杆菌X1-1对大肠杆菌具有明显的抑制作用,因此选取该菌株用于玉米蛋白粉发酵试验。

图1 依据16S rDNA序列构建的系统发育树

表3 大肠杆菌抑菌圈直径值(D-d)
2.4 不同菌株在玉米蛋白粉基础发酵培养基和亚硫酸钠生长培养基中生长能力的比较测定结果
2.4.1 三株芽孢杆菌在不同培养基中的生长情况和产蛋白酶能力比较
将本研究筛选到的X1-1菌株与本实验室保藏的2株产蛋白酶活性较高的芽孢杆菌S14和S37进行比较。3株芽孢杆菌在牛肉膏蛋白胨培养基和玉米蛋白粉基础发酵培养基中的生长曲线见图2。结果表明,在牛肉膏蛋白胨培养基中3株芽孢杆菌的生长情况相似(见图2A),但在玉米蛋白粉基础发酵培养基中,X1-1的生长情况显著优于菌株S14和S37,后2株芽孢杆菌在玉米蛋白粉基础发酵培养基中受到明显抑制(见图2B)。
将X1-1、S14和S37菌株分别接种于在牛肉膏蛋白胨培养基和玉米蛋白粉基础发酵培养基中发酵培养,发酵液碱性蛋白酶酶活的测定结果见表4。结果表明,这3株芽孢杆菌在牛肉膏蛋白胨培养基中的蛋白酶活相差并不大,但在玉米蛋白粉基础发酵培养基中,X1-1菌株的蛋白酶酶活比S14和S37菌株的酶活高2倍以上。显然,这种差异是由于S14和S37菌株在玉米蛋白粉基础发酵培养基中生长能力较弱引起的。
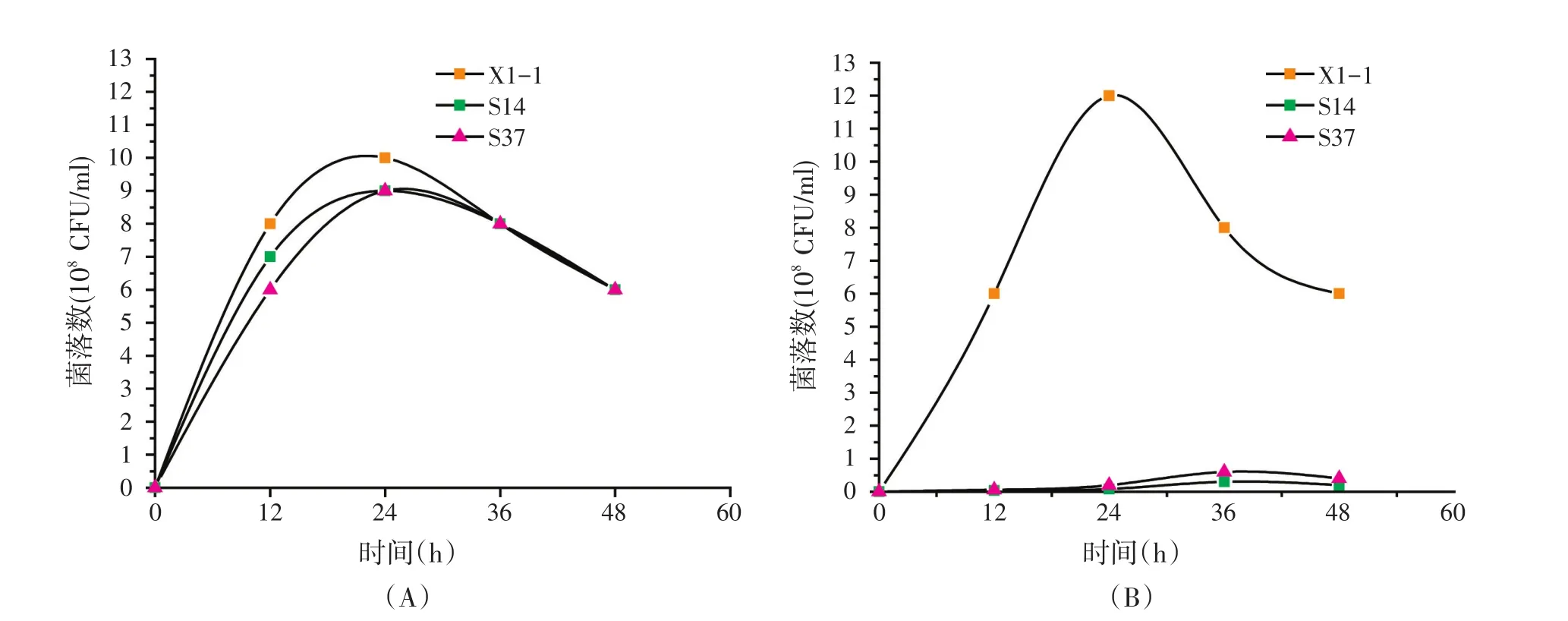
图2 三株芽孢杆菌在不同培养基中的生长曲线

表4 三株芽孢杆菌在不同培养基中的蛋白酶酶活比较
2.4.2 三株芽孢杆菌在含不同浓度的亚硫酸钠培养基中的生长结果
考虑到玉米蛋白粉的生产是由玉米经过亚硫酸钠浸泡而来,使得玉米蛋白粉中有含硫化合物残留。菌株X1-1、S14和S37在玉米蛋白粉基础发酵培养基中生长能力的差异可能是由于它们对亚硫酸钠耐受能力的不同导致的,因此,本研究对这3株芽孢杆菌耐亚硫酸钠的能力进行了测试。3株芽孢杆菌在含有0.5~2 g/l亚硫酸钠生长培养基上的生长情况见图3。由图3可知,X1-1菌株在含2 g/l的亚硫酸钠平板上仍生长良好,而S14和S37菌株均不能生长,表明X1-1菌株对亚硫酸钠具有明显的耐受性。

图3 芽孢杆菌在含不同浓度亚硫酸钠生长培养基中的生长情况
X1-1和S37菌株在含2 g/l亚硫酸钠和不含亚硫酸钠培养基中的生长曲线测定结果(见图4)表明,亚硫酸钠对X1-1菌株的生长无抑制作用(见图4A),但对S37菌株的生长抑制作用显著(图4B)。
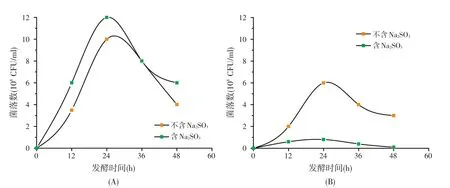
图4 亚硫酸钠对不同芽孢杆菌菌株生长的影响
2.4.3 X1-1菌株在不同浓度玉米蛋白粉基础发酵培养基中的生长结果
枯草芽孢杆菌X1-1在含40 g/l和80 g/l的玉米蛋白粉基础发酵培养基中的生长曲线如图5所示。结果表明,当培养基中玉米蛋白粉底物的浓度增加1倍后,X1-1的活菌数并无明显增加,这可能与玉米蛋白粉中的硫化物含量有关。
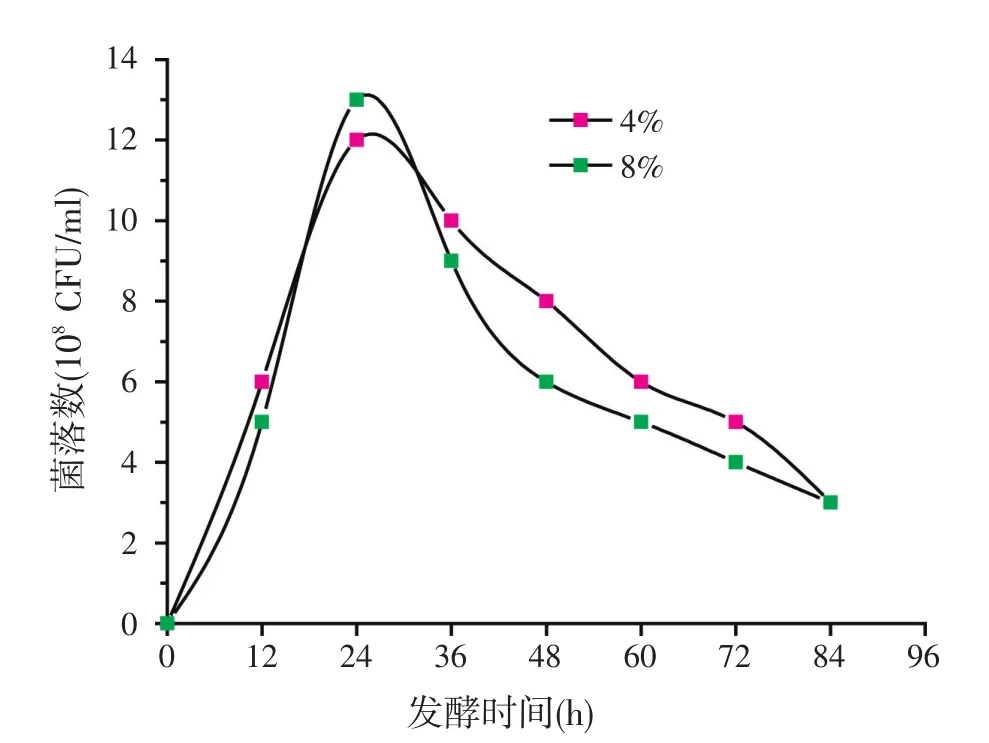
图5 X1-1在不同浓度的玉米蛋白粉培养基中的生长曲线
2.5 X1-1发酵玉米蛋白粉单因素发酵工艺优化
2.5.1 培养基底物浓度对可溶性蛋白含量的影响
在初始发酵条件下,考察培养基底物浓度对培养液中可溶性蛋白含量的影响。结果表明(见图6),当培养基中玉米蛋白粉含量为4%时,发酵液的可溶性蛋白含量最高达31.4%,比发酵前培养基中可溶性蛋白含量提高了1.34倍。

图6 底物浓度对可溶性蛋白含量的影响
2.5.2 接种量对可溶性蛋白含量的影响
试验采用4%玉米蛋白粉含量的发酵培养基,其它发酵条件不变,研究不同接种量对发酵液可溶性蛋白含量的影响。结果表明(见图7)。当接种量为6%时,可溶性蛋白含量最高,达47.7%。
2.5.3 初始pH值对可溶性蛋白含量的影响
接种量为6%,其它发酵条件同上,试验发酵培养基不同初始pH值对可溶性蛋白含量的影响。结果表明(图8),培养基初始pH值对发酵液的可溶性蛋白含量有明显影响,当初始pH值为7.5时,发酵液可溶性蛋白含量最高,达64.3%。
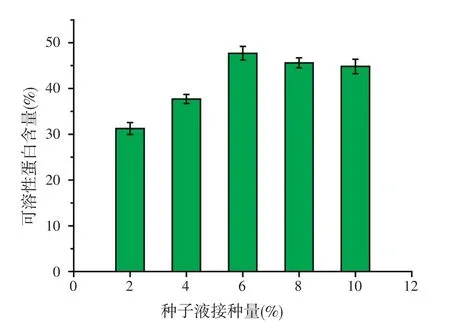
图7 接种量对可溶性蛋白含量的影响
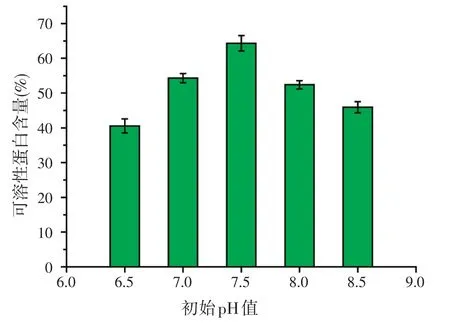
图8 初始pH值对可溶性蛋白含量的影响
2.5.4 摇瓶转速对可溶性蛋白含量的影响
培养基的初始pH值为7.5,其它发酵条件同上,试验不同摇瓶转速对发酵液中可溶性蛋白含量的影响。结果表明(见图9),当摇瓶转速为180 r/min时,可溶性蛋白含量最高,达68.7%。
2.5.5 发酵温度对可溶性蛋白含量的影响
摇床转速为180 r/min,其它发酵条件同上,试验不同发酵温度对可溶性蛋白含量的影响。结果表明(见图10),当发酵温度为36℃时,可溶性蛋白含量最高达71.9%。
2.5.6 发酵时间对玉米蛋白粉可溶性蛋白含量的影响
发酵温度为36℃,其他发酵条件同上,试验不同发酵时间对可溶性蛋白含量的影响。结果表明(见图11),当发酵时间为72 h时,发酵液的可溶性蛋白含量最高,达75.2%,发酵前发酵液的可溶性蛋白含量达13.4%,发酵后可溶性蛋白含量提高了462.6%。
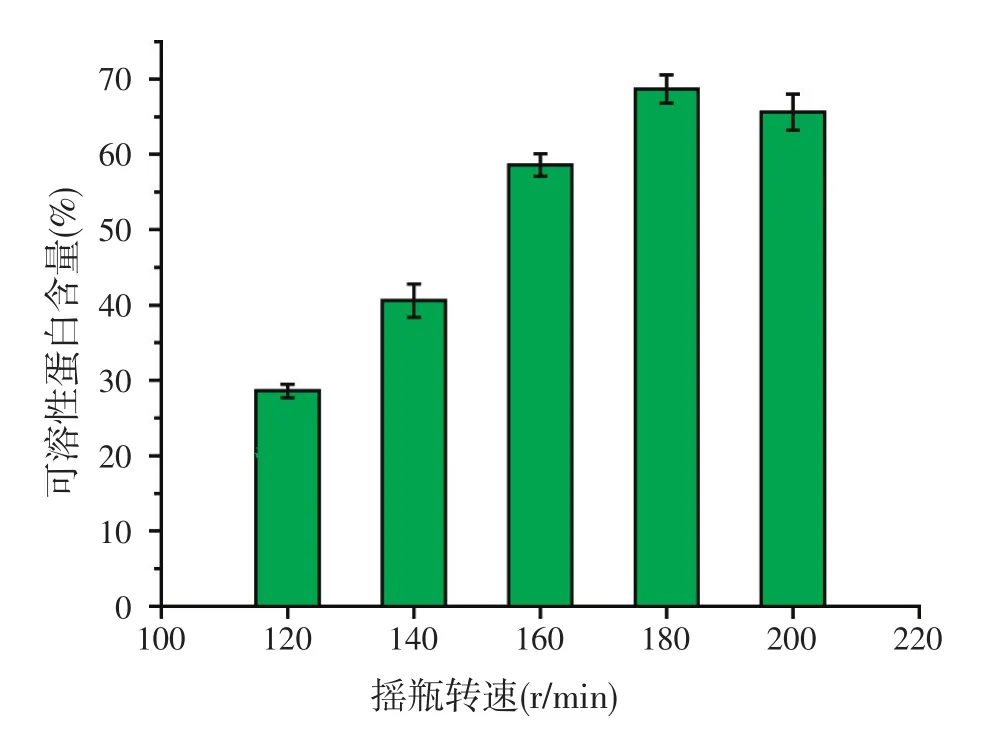
图9 摇瓶转速对可溶性蛋白含量的影响
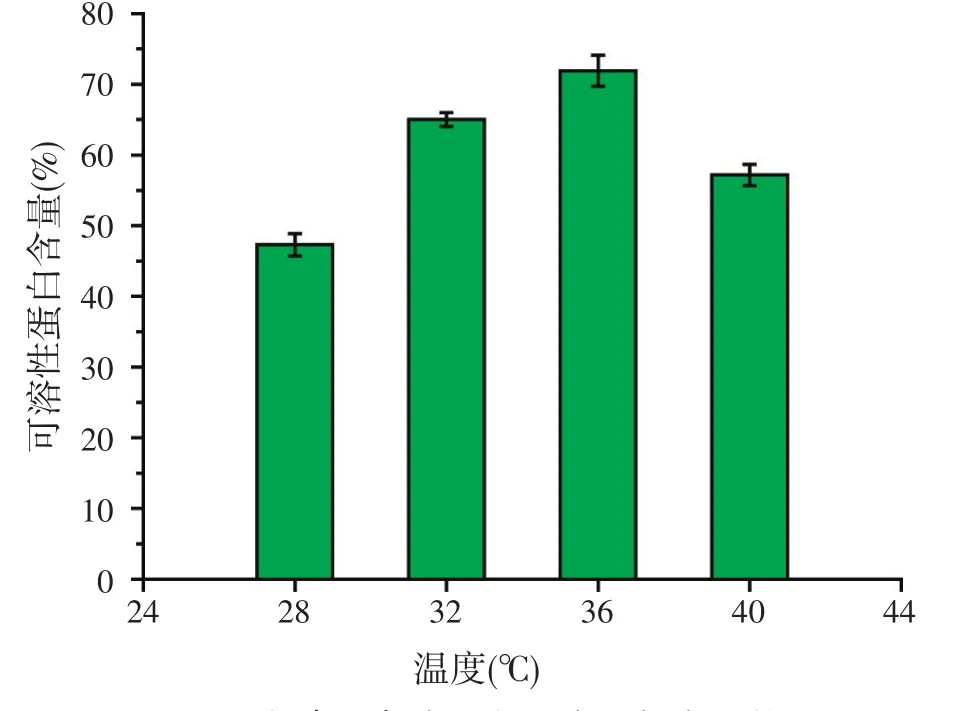
图10 发酵温度对可溶性蛋白含量的影响

图11 发酵时间对可溶性蛋白含量的影响
2.6 玉米蛋白粉发酵后理化与生化指标的测定结果
2.6.1 喷雾干燥样品与原料生化指标的比较
采用优化后的玉米蛋白粉发酵培养基和培养条件,对X1-1发酵液进行喷雾干燥,制备成发酵玉米蛋白粉。由表5可知,发酵后的玉米蛋白样品蛋白酶活性达2 217 U/g,粗蛋白和小肽含量分别为69.7%和47.6%,比玉米蛋白粉原料分别提高了18.1%和534.7%。
2.6.2 玉米蛋白粉发酵前后的电泳图谱
玉米蛋白粉中主要含有醇溶蛋白(68%)和谷蛋白(28%),醇溶蛋白的分子量约为21~25 kD,疏水性强。谷蛋白亦不溶于水。如图12所示,经枯草芽孢杆菌X1-1发酵后的玉米蛋白粉中蛋白质的分子量明显降低,主要为分子量在17 kD以下的小分子蛋白,亲水性明显提高。

表5 玉米蛋白粉发酵前后生化指标的对比

图12 玉米蛋白粉发酵前后蛋白质的SDS-PAGE电泳图谱
3 讨论
本研究筛选到1株在玉米蛋白粉培养基中蛋白酶活性高、能有效降解玉米蛋白粉菌株的枯草芽孢杆菌X1-1菌株,经测定发现该菌株X1-1具有较强的抗亚硫酸钠的能力和在玉米蛋白粉培养基中良好生长的能力,而不抗亚硫酸钠的参比芽孢杆菌菌株在玉米蛋白粉培养基中的生长也明显减弱。亚硫酸钠是食品和饲料工业中常用的一种防腐剂,对许多细菌具有抑制作用[19-20],由于玉米蛋白粉加工过程中使用了亚硫酸钠,从而使得玉米蛋白粉原料中残留有该物质,因此,本研究筛选的X1-1菌株对玉米蛋白粉的高效降解能力与其抗亚硫酸钠的能力有关。
目前已报道的玉米蛋白粉发酵工艺中,存在发酵底物浓度不高[21-22]或较高底物浓度下水解效率不高[23]等不足。本研究结果表明,当发酵液中玉米蛋白粉发酵浓度由4%提高到8%时,细菌数量并无显著增加,发酵液中的可溶性蛋白比例也明显下降,这可能与发酵底物中含有较高浓度的硫化物从而对微生物的发酵产生抑制作用有关。因此,玉米蛋白粉中亚硫酸钠的含量需要引起生产厂家的重视,在玉米蛋白粉加工过程中应控制硫化物的添加量。此外,可通过选育抗硫化物的菌株用于发酵来提高底物发酵浓度。
目前,生产玉米活性肽的方法主要有酶解法和微生物发酵法[24-26]。本研究通过枯草芽孢杆菌X1-1液体发酵和喷雾干燥制备的发酵玉米蛋白粉样品,经感官品尝无明显苦味,而经碱性蛋白酶水解的玉米蛋白粉溶液具有明显的苦味[27]。因此,与酶解法相比,发酵法制备的玉米肽在口感上具有一定优势。有报道表明,微生物发酵可以减少玉米肽制备过程中的苦味,降低成本,将会成为玉米肽制备产业化发展的重要趋势[28]。
