相同成分不同厂家注射剂药品说明书26组调查分析
2017-01-05陈叶琴
陈叶琴
(江苏省常州市第三人民医院药剂科,江苏 常州 213001)
相同成分不同厂家注射剂药品说明书26组调查分析
陈叶琴
(江苏省常州市第三人民医院药剂科,江苏 常州 213001)
目的 比较相同成分不同厂家注射剂药品说明书内容的一致性。方法 收集并调查分析医院药房相同成分不同厂家的注射剂药品说明书26组。结果 18组说明书内容基本相似,4组用法用量项有差异,3组不良反应与注意事项项下有差异,4组贮存项有差异。结论 相同成分不同厂家的注射剂药品说明书间有差异,医疗机构及广大医务人员易忽视,应引起重视并加以管理和规范。
药品说明书;合理用药;调查分析
药品说明书作为国家批准的法定文书,对于指导医护人员、患者合理用药有非常重要的临床意义[1]。药品说明书必须符合国家食品药品监督管理总局(CFDA)颁布的统一格式,具有真实性、简要性特点[2],医生应严格按照药品说明书使用药物。注射剂是临床常用而风险较大的品种,为规范使用药物注射剂,减少药物不合理使用的医疗行为,保证药物使用安全性和有效性。笔者调查分析了我院临床使用的相同成分不同厂家的注射剂药品说明书,现报道如下。
1 资料与方法
收集我院药房相同成分不同厂家的注射剂药品说明书26组,对其说明书内容逐一对比阅读、分析。
2 结果与分析
2.1 结果
26组注射剂药品说明书中,18组说明书内容基本相似,8组说明书内容有差异,其中4组用法用量项有差异,3组不良反应与注意事项项下有差异,4组贮存项有差异。8组有差异说明书的药品基本信息见表1。
2.2 分析
2.2.1 用法用量项的差异
针对不同厂家药品说明书用法用量项有差异的部分,一并查阅了《临床用药须知》,分述如下。
注射用泮托拉唑钠:配制液pH,海南卫康制药未提及,扬子江药业是配制液pH≥9,《临床用药须知》[3]配制液pH为9;滴注时间,海南卫康制药与扬子江药业分别为15~60 min与 1 h内滴完,《临床用药须知》[3]为15~30 min;溶解和稀释后溶液,海南卫康制药为4 h内用完,扬子江药业未提及,《临床用药须知》[3]为3 h内用完。
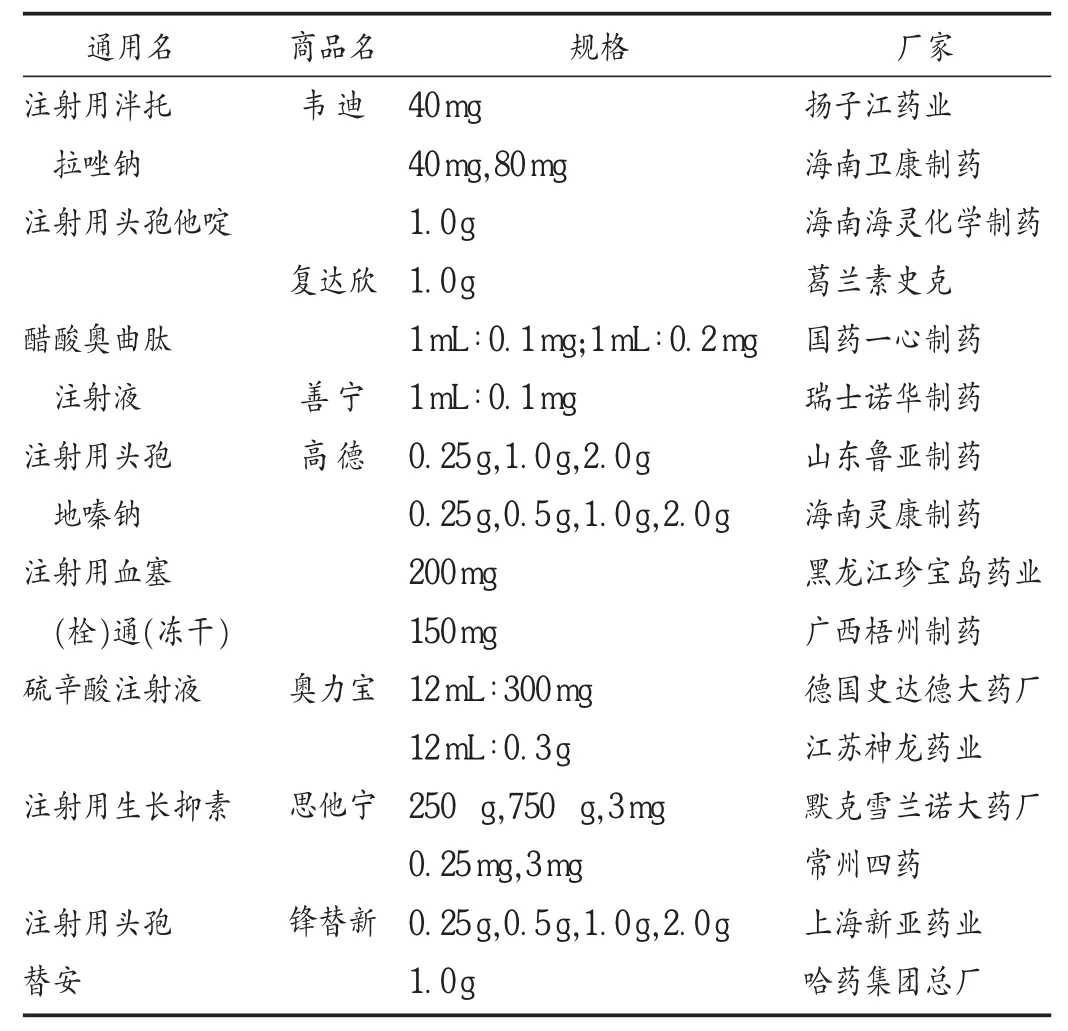
表1 8组药品说明书有差异药品基本信息
注射用头孢他啶:儿童用药剂量,葛兰素史克对儿童用药剂量分为婴儿及儿童,对于2个月以上的儿童,一般的剂量范围是按体重每日30~100 mg/kg,分2~3次给药,新生儿至2个月月龄的婴儿,一般剂量范围是按体重每日25~60 mg/kg,分2次给药;海南海灵制药为婴幼儿常用剂量每日30~100 mg/kg,分2~3次给药;《临床用药须知》[3]为儿童每日 50~150 mg,分 3次给药,新生儿,出生体重超过2 kg,日龄不超过7 d者每12小时50 mg/kg给药,日龄超过7 d者,每8小时50 mg/kg给药。
醋酸奥曲肽注射液:治疗食管-胃静脉曲张出血,瑞士诺华制药表述为连续静脉滴注0.025 mg/h最多治疗5 d,奥曲肽可用0.9%氯化钠注射液稀释,在患有食管-胃静脉曲张出血的肝硬化患者中奥曲肽连续静脉滴注0.05 mg/h持续5 d都可被耐受;国药一心制药为首先0.1 mg静脉推注5 min,随后以0.6 mg溶于5%葡萄糖注射液500 mL中,通过输液泵以50 μg/h的速度连续静脉滴注,每12小时1次。最多治疗5 d;《临床用药须知》[3]为100 μg+葡萄糖推注,而后25~50 μg/h滴注,持续24~48 h,最长5 d。
注射用头孢地嗪:溶液的配制,海南灵康制药有3种规格(0.5 g,1.0 g,2.0 g)的配制方法,山东鲁亚制药只有2种规格(1.0 g,2.0 g)溶液配制方法,而治疗淋病给药剂量为0.25 g或0.5 g;《临床用药须知》[3]中无配制方法。
2.2.2 不良反应与注意事项差异
注射用血塞(栓)通:哈尔滨珍宝制药中不良反应描述为头面部发红、潮红,轻微皮疹,轻微头胀痛是本品常见反应,偶见寒战、发热、胸闷;而广西梧州制药不良反应项下为尚不明确,但在注意事项中提及;哈尔滨珍宝制药中有输液速度不宜过快,特别开始30 min应密切观察,用药期间勿从事驾驶及高空作业等危险作业,禁忌与其他药品配伍使用。
注射用泮托拉唑钠:对肝、肾功能受损用药注意事项,海南卫康制药为肾功能受损者无须调整剂量,肝功能受损需酌情减量;扬子江药业为肝肾功能不全者慎用,根据需要酌情减量。
硫酸辛注射液:德国史达德制药中提及经常饮酒对神经性疾病的发生和发展是危险因素,建议有糖尿病周围神经病变的患者尽可能避免饮酒,以及有极罕见的味觉异常;江苏神龙药业中均未提及。
另外,进口药注射头孢他啶(复达欣)、复方甘草酸苷(美能)、醋酸奥曲肽注射液(善宁)中的不良反应与注意事项均比国产药详细。
2.3 贮存项差异
针对不同厂家药品说明书贮存项下有差异的部分,一并查阅了《中国药典》,分述如下。
默克雪兰诺制药和常州四药生产的注射用生产抑素,前者标示为贮存于25℃以下的避光干燥处,后者为避光,密闭,在冷处(2~10℃)保存,《中国药典》[4]为避光,密闭,在冷处保存。
葛兰素史克和海南海灵生产的注射用头孢他啶,前者标示为25℃以下,避光保存;后者为密封,在阴凉(避光并不超过 20℃)保存,《中国药典》[4]为密封,在凉暗处保存。
上海新亚制药和哈药集团的注射用盐酸头孢替安,前者为避光,密封,在室温干燥处保存;后者为密封,在凉暗(避光并不超过20℃)干燥处保存,《中国药典》中未收载。
江苏神龙药业和德国史达德制药的硫酸辛注射液,前者标示为避光,密闭保存(未标明温度);后者为宜在 25℃以下,置盒内避光保存,《中国药典》中未收载。
3 讨论
泮托拉唑钠有亚磺酰基并咪唑的化学结构,其稳定性易受光线、重金属离子、氧化性和还原性成分等多种因素影响,尤其在酸性条件下,泮托拉唑钠的化学结构可发生破坏性变化,出现变色和聚合现象[5]。若能在说明书中,对溶解药物的溶剂pH有具体说明,易让医护人员更直观地认识到配伍是否合理。在临床输液配制操作中,配成的溶液在一定时间和温度条件下稳定,如超过了规定放置时间,就会发生变质、沉淀等不稳定现象,故配好的溶液不能超过规定放置时间。注射用泮托拉唑钠扬子江药业提及溶剂pH,但无溶解稀释后放置的时间,海南卫康制药没提及溶剂pH,而有溶解稀释后放置的时间,但药厂提及的pH和溶解稀释后放置的时间与《临床用药须知》中不完全一致。用法用量对患者安全有效用药至关重要[6],故建议药品监督管理部门进一步加强药品说明书的规范化管理,监督药品生产厂家严谨制订和及时修订药品说明书,提高其内容的科学性、准确性与严谨性。
儿童正处于生长发育旺盛时期,各个器官还不成熟,各种功能尚不完善,对药物的耐受性较差,敏感性较强,极易发生药物的危害。本调查发现,药品说明书对于儿童年龄的表述多样化,根据《诸福棠实用儿科学》[7],并未对“婴幼儿”“小儿”等年龄段进行明确定义,为概括性描述。注射用头孢他啶用法用量项下,海南海灵制药将儿童剂量混淆地称为“婴幼儿常用剂量”或“小儿常用剂量”,在临床应用中,不能对小月龄,甚至是早产儿或新生儿的用药提供很好的权威性指导,而葛兰素史克与《临床用药须知》上用药时对儿童年龄的划分又不一致。建议生产厂家撰写说明书时准确划分儿童年龄段。
不良反应的种类和发生率是医患双方共同关注的问题,在药品说明书中明确标注将对药物选择及责任追究具有指导意义。如果发生药品不良反应且对患者造成伤害,而药师(医师)又不能证明用药发生的不良反应与该药无关时,药师(医师)的医疗行为属违反医疗常规,不受法律保护[8]。注射用血塞(栓)通,为中药注射剂,在说明书注意事项项下,哈尔滨珍宝制药中有注意滴速,密切观察,根据《中药注射剂临床使用原则》禁忌与其他药品配伍使用等,而广西梧州制药未提及;哈尔滨珍宝制药中不良反应项下有不良反应描述,广西梧州制药不良反应项下为尚不明确,但注意事项中又有不良反应的描述,前后矛盾。不良反应的资料来源可反映生产厂家的科学态度,增加医患使用的信心。建议生产厂家更多采用临床数据,说明不良反应发生概率。
贮存项下的规定,是避免污染和降解而对药品贮存与保管的基本要求。药品说明书贮存项下详细地标示药物贮存条件,有利于药品的贮存管理和用药安全。但若标示的贮存条件同一成分不同厂家不一致,可增加药师对贮存药品的保管与监督难度,也使护士、患者在保存上述药品时易产生混淆。如注射用生产抑素,默克雪兰诺制药标示为贮存于25℃以下的避光干燥处;而常州四药为密闭、在冷处(2~10℃)保存,温度相差很大。
因《中国药典》5年修订1次,存在滞后性,故不良反应与注意事项项下的差异未与《临床用药须知》中的内容比较。本调查发现,药厂的说明书在用法用量项下与《临床用药须知》中的内容不一致,在贮存项下与《中国药典》中的内容不一致。《中国药典》及《临床用药须知》属于国家药典委员会编著,权威性更高。普遍认为,药品说明书应和《临床用药须知》及其他药学文献保持高度的一致性,否则会削弱一方的公信力,当出现不一致或相左时,给法律引证带来困难。建议增加制订说明书、审批说明书者的责任,规范说明书的文字和内容,且要与《中国药典》《临床用药须知》保持一致。
药品监督管理部门应依法对药品说明书进行普查,防止厂家“各自为战”。通过修订、完善药品说明书,使其管理法制化、规范化,从而树立药品说明书的权威性[9]。药品监督管理部门应进一步明确药品生产者对药品说明书的法律责任,必要时让药品生产者对药品说明书中存在的缺陷造成的损害承担赔偿责任,促使药品生产者重视药品说明书的修改和完善,保证患者用药安全有效[10],让药品说明书更好地为医、药、护、患各方面提供正确依据,避免因药品说明书的不同而引起不必要的医疗差错和医、患纠纷。
[1]马 巍,赵春芝,崔秀滨.注射剂药品说明书在实际应用中存在的问题[J].中国药业,2008,20(17):8-9.
[2]明 佼,尹晓飞.35种中药注射剂药品说明书的合理性调查分析[J].中国药业,2012,21(8):8-9.
[3]国家药典委员会.临床用药须知(化学和生物制品卷)[M].北京:中国医药科技出版社,2010:371,670,665,534.
[4]国家药典委员会.中国药典(二部)[M].北京:中国医药科技出版社,2010:167,176.
[5]刘维海,刘 芸.药物注射剂临床不规范使用案例分析[J].药学实践杂志,2014,32(2):134.
[6]杨 波,翟所迪.从安全性角度对药品说明书异同的调查分析(一)[J].中国医院用药评价与分析,2008,8(1):76-78.
[7]胡亚芳,江载芳.诸福棠实用儿科学[M].第7版.北京:人民卫生出版社,2002:301.
[8]乔 毅,冯 旭,席金发.浅谈临床药学的风险控制[J].中国实用医学,2010,5(19):168.
[9]吕世臣,刘玲珍.药品说明书几点问题值得商榷[J].首都医药,2009,16(8):20.
[10]于培明,黄泰康.药品说明书的法律定性必须明确[J].中国药业,2007,16(4):14.
Investigation on Injections′Package Inserts of 26 Groups with Same composition from Different Manufacturers
Chen Yeqin
(Department of Pharmacy,Changzhou Third People′s Hospital,Changzhou,Jiangsu,China 213001)
Objective To compare the consistency of package inserts of same composition but from different manufacturers.M ethods A total of 26 groups of injections′package inserts with same composition but from different manufacturers were collected and investigated from the hospital.Results 18 groups of package inserts were basicly similar,4 groups differed from usage and dosage,3 groups were different under adverse reactions and precautions,and the rest 4 groups were different in storage items.Conclusion There are differences between the same composition injections′package inserts of different manufacturers.It is easy for medical institutions and medical staffs to ignore the situation,which thus remain to be improved further.
package inserts;rational drug use;investigation
R954
A
1006-4931(2016)02-0107-03
2015-01-27;
2015-04-27)
