肾炎胶囊大鼠长期毒性试验
2017-01-05范治云谭会萍
范治云,谭会萍
(1.山东省食品药品检验研究院,山东 济南 250101; 2.山东省济南市第三人民医院,山东 济南 250101)
肾炎胶囊大鼠长期毒性试验
范治云1,谭会萍2
(1.山东省食品药品检验研究院,山东 济南 250101; 2.山东省济南市第三人民医院,山东 济南 250101)
目的 探讨连续灌胃给予肾炎胶囊对大鼠产生的毒性反应。方法 给予大鼠肾炎胶囊1.5,0.5 g/kg(分别为临床拟用剂量的50倍和16.7倍)连续灌服6个月,停药1个月,分别观察大鼠的生长发育及血液学常规、血液生化、脏器系数及病理组织学变化。结果 各剂量组大鼠发育正常,各项检测指标未见与用药相关的异常变化,主要脏器病理形态未出现明显毒性病变。结论 肾炎胶囊长期用药对大鼠无明显毒性,临床拟用剂量安全。
肾炎胶囊;大鼠;长期毒性
肾炎胶囊为由黄芪、丹参、党参等提取物研制而成的中药制剂,具有健脾补肾、活血通络、利水消肿等功效,可用于治疗慢性肾炎。为探讨肾炎胶囊在临床应用的安全性,根据长期毒性试验方法和技术要求,本研究中进行了大鼠长期毒性试验[1-4],现报道如下。
1 材料与方法
1.1 动物、仪器与材料
健康Wistar大鼠,鼠龄9~11周,体重90~120 g,雌雄各半,购自山东鲁抗医药有限公司[许可证号为SCXK(鲁)20030006]。肾炎胶囊(某肾病医院自制,批号为041018,规格为每粒0.45 g),用前倒出内容物,用蒸馏水配制成所需质量浓度。贝克曼DIFF2型血细胞分析仪,日立7020型全自动生化分析仪
1.2 方法[5-9]
取上述大鼠90只,按体重随机分为高、低剂量组和对照组,各30只,雌雄各半。每笼5只,雌雄分养,并开始给药,肾炎胶囊高、低剂量药物质量浓度分别用蒸馏水配成150,50 g/L的混悬液,给药容积10.0 mL/kg体重,分别相当于临床剂量的50倍和16.7倍。对照组给等体积蒸馏水,每日定时灌胃给药1次,给药后予常规颗粒饲料喂饲,自由摄食饮水,每周给药6 d,连续给药6个月。前3个月每周测体重1次,3个月后每3周测体重1次,并根据体重变化调整药量。每日观察受试动物的外观、行为体征、活动、精神状态、进食、体重变化、粪便及尿液等情况。在给药中期(3个月)、末期(满6个月)及恢复期(停药1个月),分别各随机抽取1/3动物,麻醉采血后处死。收集全血,检测血常规和血生化指标。同时剖取心、肝、脾、肺、肾等各主要脏器,电子天平称重,肉眼观察和病理切片检查,以判断用药期间及停药后可能出现的延迟毒性反应或毒性反应的可逆程度。试验数据采用IBM SPSS 17.0统计软件分析。
2 结果
2.1 一般情况
给药期,高、低剂量组大鼠和对照组大鼠外观、行为、活动、精神状态等均无明显异常;饮食、大小便均正常,体重呈线性增加,给药组与对照组比较,差异无统计学意义。结果见表1。
表1 肾炎胶囊对3组大鼠体重的影响比较(±s,g,n=30)
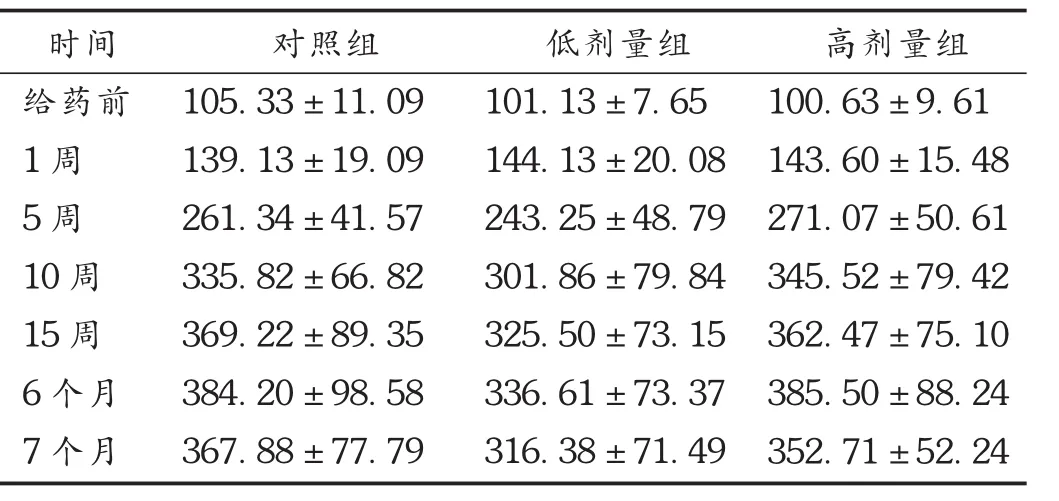
表1 肾炎胶囊对3组大鼠体重的影响比较(±s,g,n=30)
时间给药前1周5周10周15周6个月7个月对照组105.33±11.09 139.13±19.09 261.34±41.57 335.82±66.82 369.22±89.35 384.20±98.58 367.88±77.79低剂量组101.13±7.65 144.13±20.08 243.25±48.79 301.86±79.84 325.50±73.15 336.61±73.37 316.38±71.49高剂量组100.63±9.61 143.60±15.48 271.07±50.61 345.52±79.42 362.47±75.10 385.50±88.24 352.71±52.24
2.2 血常规和血生化主要指标变化
给药组大鼠在给药期和恢复期,其红细胞计数(RBC)、血红蛋白(Hb)、白细胞计数(WBC)、血小板计数(PLT)等主要血液学指标和碱性磷酸酶(ALP)、天门冬酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)等主要血生化指标与对照组比较,差异无统计学意义(P>0.05)。表明本品对正常大鼠外周血常规及肝、肾功能无明显影响,恢复期亦未见延迟性损害。给药组尿素氮(BUN)、肌酐(Cr)指标与对照组比较有显著性差异,这可能与本药能提高肾功能的药效学有关。结果见表2至表4。
表2 给药3个月时血常规及血生化检查结果(±s,n=30)

表2 给药3个月时血常规及血生化检查结果(±s,n=30)
注:与对照组比较, P<0.05。下表同。
指标WBC(×109/L)RBC(×1012/L)Hb(G/L)PLT(×109/L)ALP(U/L)AST(U/L)ALT(U/L)BUN(mmol/L)Cr( mol/L)对照组9.09±2.31 7.27±0.76 131.80±10.81 567.30±165.50 78.50±23.35 59.60±12.03 33.60±8.50 6.20±0.90 86.85±12.45低剂量组10.59±3.64 7.22±0.70 132.10±7.94 578.30±94.71 68.60±23.77 51.60±6.92 34.50±3.63 3.86±0.70 72.30±5.68高剂量组11.15±2.71 7.18±0.49 130.30±7.87 528.40±144.01 77.40±24.33 52.30±7.30 34.30±6.17 3.53±0.75 73.90±6.35
表3 给药6个月时血常规及生化检查结果(±s,n=30)

表3 给药6个月时血常规及生化检查结果(±s,n=30)
指标WBC(×109/L)RBC(×1012/L)Hb(G/L)PLT(×109/L)ALP(U/L)AST(U/L)ALT(U/L)BUN(mmol/L)Cr( mol/L)对照组8.83±3.13 7.87±0.46 147.30±10.38 616.50±203.42 79.50±20.07 69.60±11.74 33.00±11.77 5.87±0.51 97.90±6.79低剂量组6.49±2.29 7.35±0.67 141.20±9.20 652.20±141.18 95.40±35.47 58.20±14.67 33.50±5.30 5.98±0.67 75.90±5.74高剂量组6.72±1.20 7.54±0.50 138.30±10.66 604.60±181.05 86.10±20.78 78.60±20.40 38.90±7.81 5.72±0.49 77.20±10.29
表4 停药1个月时血常规及生化检查结果(±s,n=30)

表4 停药1个月时血常规及生化检查结果(±s,n=30)
WBC(×109/L)RBC(×1012/L)Hb(G/L)PLT(×109/L)ALP(U/L)AST(U/L)ALT(U/L)BUN(mmol/L)Cr( mol/L)10.34±4.17 7.76±0.97 141.38±6.67 714.00±182.97 82.75±46.46 57.13±13.13 18.38±6.05 5.09±0.89 97.88±6.31 11.45±5.86 7.24±1.25 137.13±12.03 659.25±78.09 76.75±27.05 68.38±11.94 25.00±10.58 5.19±1.18 97.25±9.60 10.33±3.71 7.14±0.54 135.14±9.41 640.29±110.76 85.86±20.74 58.14±8.41 20.71±4.82 5.91±0.67 84.86±5.55
2.3 主要脏器系数及病理组织学变化
给药期及恢复期,肉眼观察各组大鼠的主要脏器心、肝、脾、肺、肾等的位置、形态、色泽、硬度等均无明显异常。各给药组大鼠脏器系数与对照组大鼠基本一致。病理组织学检查个别大鼠可见肝脏点灶状坏死和炎细胞浸润,但高剂量组与对照组比较无显著性差异。心、脾、肺、肾等其他脏器均无明显病理改变。
3 讨论
肾炎胶囊临床推荐成人日用量为4粒,用于长期服用治疗慢性肾炎。本试验以1.5,0.5 g/kg剂量(分别相当于临床成人日用量的50,16.7倍),给大鼠连续灌服6个月,停药1个月。在给药期及恢复期内,大鼠一般状况良好,主要血液学指标、生化学指标、脏器系数等与对照组比较无明显差异;解剖主要脏器未见明显肉眼可见的病理性改变,只有个别可见肝脏脂肪瘤发生,但给药组与对照组比较,病变大鼠数无显著性差异,故认为这是正常反应,与药物无关。病理组织学检查显示,给药组各期与对照组的组织脏器均未见明显病理改变,停药1个月也未见药物延迟损害毒性。个别动物可见肝脏点灶状坏死和炎细胞浸润,但高剂量组与对照组比较无显著性差异,不具有毒理学意义[10-11]。血生化指标结果显示,给药组大鼠的BUN和Cr水平显著降低,证实肾炎胶囊具有增强肾功能的作用。
综上所述,肾炎胶囊在相当于人剂量50倍和16.7倍时对大鼠无明显毒性反应,可长期服用,本试验结果为临床用药的安全性提供了毒理学依据。
[1]国家食品药品监督管理局.中药、天然药物长期毒性研究技术指导原则[Z].2011-09-28.
[2]袁伯俊,王治乔.新药临床前安全性评价与实践[M].北京:军事医学科学出版社,1997:23-26.
[3]黄芳华.中药新药一般药理学研究技术要求和常见问题分析[J].中国中药杂志,2007,32(1):83-85.
[4]叶正良,周大铮,岳洪水.中药注射剂安全性研究的思考[J].毒理学杂志,2007,21(4):296.
[5]袁伯俊,缪明阳,李 波.药物毒理学实验方法与技术[M].北京:化学工业出版社,2007:256.
[6]吕秋军.新药药理学研究方法[M].北京:化学工业出版社,2007:382-387.
[7]王林丽,李卓恒,吕金胜,等.益精灵口服液大鼠长期毒性试验研究[J].中国药业,2014,23(19):21-22.
[8]蒋婀娜,张春光,刘兆平,等.中药注射剂大鼠长期毒性试验研究浅析[J].毒理学杂志,2008,22(3):66-67.
[9]张晓冬,宗 英,陆国才,等.药物长期毒性试验血液和生化指标的统计处理[J].中国新药杂志,2010,19(7):13-15.
[10]苏晓欧,戴益民,弓雪莲,等.毒性试验中SD大鼠常见自发性病变[J].中国药理学与毒理学杂志,2013,27(3):518.
[11]许 迪,孔利佳,杜佐华,等.大鼠长期毒性试验质量控制探讨[J].中国比较医学杂志,2010,20(1):61-63.
Chronic Toxicity of Shenyan Capsules on Rats
Fan Zhiyun1,Tan Huiping2
(1.Shandong Institute for Food and Drug Control,Jinan,Shandong,China 250101; 2.Jinan Third People′s Hospital of Jinan,Jinan,Shandong,China 250101)
Objective To observe the chronic toxicity of Shenyan Capsule on rats.Methods Wistar rats were orally given Shenyan Capsule at dose of 1.5,0.5 g/kg(equal to 50 and 16.7 times of clinic dosage respectively),reated for 6 months and stopped for 1 month.The animal growth condition,indexes of hemotology and biochemistry,and the histopathology of the major organs were examined.Results The outer appearance and behavior,weights,organ coefficient,the indexes of haematology and biochemistry in rats had no significant difference by comparing with control group.The pathological examination did not discover significant pathological changes related to drug toxicity and the delayed toxicity reaction after drug administration.Conclusion Shenyan Capsules have no significant toxicity for long-term administration on rats.It infers that the drawing-up doses in clinic will be safe.
Shenyan Capsules;rat;chronic toxicity
R285.5
A
1006-4931(2016)02-0055-03
2015-05-13;
2015-09-07)
