柿叶总黄酮的初步质量研究
2017-01-05黄顺旺乔金为左亚锋陈师农吴德玲李玲芝宋少江
黄顺旺,乔金为,左亚锋,李 正,陈师农,孙 备,吴德玲,李玲芝,宋少江
(1.安徽省食品药品检验研究院,安徽 合肥 230022; 2.安徽中医药大学,安徽 合肥 230031; 3.沈阳药科大学中药学院,辽宁 沈阳 110016)
柿叶总黄酮的初步质量研究
黄顺旺1,3,乔金为2,左亚锋2,李 正2,陈师农1,孙 备1,吴德玲2,李玲芝3,宋少江3
(1.安徽省食品药品检验研究院,安徽 合肥 230022; 2.安徽中医药大学,安徽 合肥 230031; 3.沈阳药科大学中药学院,辽宁 沈阳 110016)
目的 建立柿叶提取物中总黄酮的质量研究方法。方法 用薄层色谱法对总黄酮中的芦丁、槲皮素、山柰酚进行定性鉴别;以芦丁为标准品,用分光光度法测定总黄酮的含量;用高效液相色谱法对总黄酮的水解苷元槲皮素、山柰酚进行含量测定。结果 薄层鉴别的色谱斑点清晰。供试品溶液最大吸收波长为 410 nm。槲皮素质量浓度在 9.6~57.6 g/mL范围内与峰面积呈良好线性关系(r=0.999 8),平均回收率为99.09%,RSD为0.47%(n=6)。山柰酚质量浓度在9.28~55.68 g/mL范围内与峰面积呈良好线性关系(r=0.999 8),平均回收率为99.03%,RSD为0.55%(n=6)。结论 该方法简便、快速,重复性及稳定性均较好,可用于柿叶提取物中总黄酮的初步质量控制。
柿叶总黄酮;芦丁;槲皮素;山柰酚;薄层色谱;分光光度法;高效液相色谱法
柿叶为柿科柿属植物柿 Diospyros kaki Thunb.的新鲜或干燥叶,收载于湖南、广东、广西药材标准中,化学成分较复杂,主要含有黄酮、三萜、酚类等化合物。其中黄酮类大多以苷的形式存在,具有抗心肌缺血、保护血管和脑缺血性神经细胞、耐缺氧、改善血液循环等多种生物活性。柿是我国南北各地普遍栽培的食用品种,分布广泛。目前,柿叶的开发利用主要是加工成柿叶茶等多种功能保健食品,日本是世界上最早开发利用柿叶茶的国家,临床药品“kaki yo”可用于治疗高血压,在印度传统医药中也作利尿剂、止血剂[1]。通过查询国家食品药品监督管理总局(CFDA)网站得知,国内有7家药企生产柿叶乙酸乙酯浸出物制成的中成药脑心清片和胶囊。目前,国内对柿叶中总黄酮研究的报道较多,但关于质量标准研究仍待深入。因此,笔者对柿叶有效部位中总黄酮的质量控制进行了研究,现报道如下。
1 仪器与试药
硅胶G板(青岛海洋化工厂分厂,100 mm×100 mm,供薄层层析用);TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);LC-10AT型高效液相色谱(HPLC)仪(日本岛津公司),包括 SPD-10Avp型紫外检测器,LC-10Atvp型溶剂输送泵,N-2000型双通道色谱工作站;KQ-250E型超声波清洗器(昆山市超声仪器有限公司);AR1140型电子天平(十万分之一,上海加惠仪器仪表有限公司);真空干燥箱(上海越众仪器设备有限公司);HHS型电热数显水浴锅(上海博迅实业有限公司医疗设备厂)。柿叶药材购自安徽普仁中药饮片有限公司,经沈阳药科大学中药学院路金才教授鉴定为柿科柿属植物柿 Diospyros kaki Thunb.的叶;芦丁对照品(批号为100080-200707)、槲皮素对照品(批号为 10081-9905)、山柰酚对照品(批号为0861-200002),供含量测定用,均购自中国食品药品检定研究院;柿叶提取物总黄酮样品(批号为 140911,140912,140913)均为我院天然药化室自制;甲醇、磷酸为色谱纯,水为重蒸馏水,浓盐酸、AlCl3·6H2O等其余试剂均为分析纯。
2 方法与结果
2.1 薄层色谱(TLC)鉴别[2-3]
取3批柿叶总黄酮样品5 mg(本试验中均采用减重法称量),研细,加甲醇5 mL,超声溶解,得供试品溶液。另取柿叶总黄酮样品10 mg,加甲醇适量,完全溶解,加36%浓盐酸适量,使盐酸终浓度为2 mol/L,摇匀,90℃回流2 h,得水解供试品溶液(质量浓度约为1 g/L)。另取芦丁、槲皮素、山柰酚对照品适量,分别加甲醇制成每1 mL约含0.3 mg的溶液,得对照品溶液。取以上对照品溶液各0.5 mL混合,得混合对照品溶液。吸取上述6种溶液各3 μL,分别点于同一硅胶G薄层板上,以甲苯-甲酸乙酯-甲酸(6∶6.5∶1.5)为展开剂,取出,晾干。喷以2%AlCl3乙醇溶液,在105℃加热30 min,置紫外光灯(365 nm)下检视。供试品溶液色谱中,与3个对照品溶液色谱相应位置上,显相同颜色的斑点。水解供试品溶液色谱中,在与槲皮素、山柰酚对照品溶液色谱相应位置上显相同颜色的斑点,在与芦丁对照品溶液色谱相应位置上则无斑点。见图1。
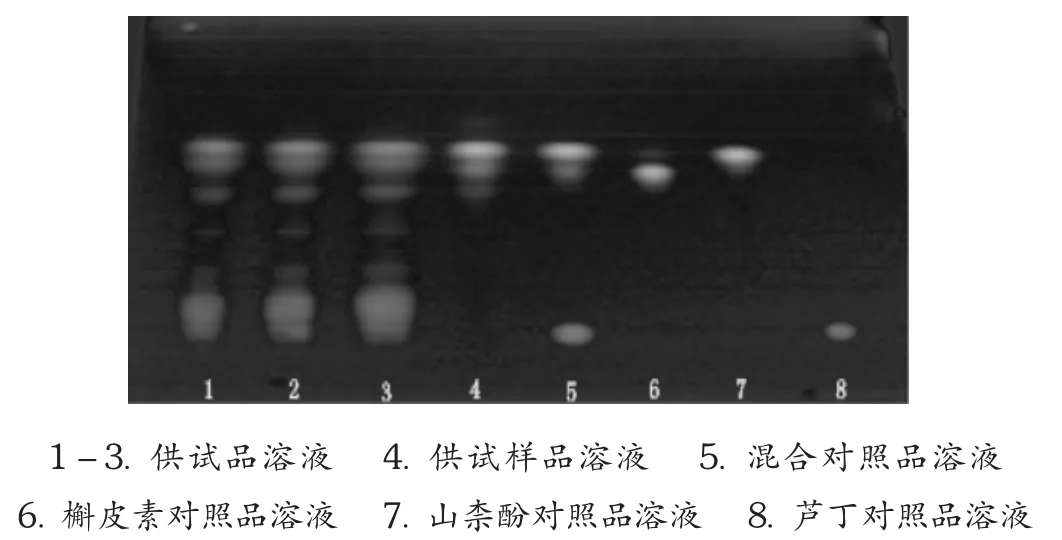
图1 薄层色谱图
2.2 总黄酮含量测定(分光光度法)[2,4]
溶液制备:精密称取120℃干燥至恒重的芦丁对照品4.6 mg于5 mL容量瓶中,50%乙醇超声溶解,定容至刻度,得0.92 g/L对照品溶液。
线性关系考察:取芦丁对照品溶液1.0 mL,置25 mL容量瓶中,用50%乙醇定容至刻度,摇匀,分别取1.0,2.0,2.5,3.0,3.5,4.0 mL,置 10 mL容量瓶中,加入0.1 mol/L AlCl3·6H2O(称取 0.483 g的 AlCl3·6H2O溶于20 mL的重蒸馏水中,超声30 min即得)1.0 mL,摇匀,用50%乙醇定容至刻度,摇匀,40 min后于410 nm波长处测定吸光度(A)。以质量浓度(C,μg/mL)对 A进行线性回归,得回归方程 A=0.025 C+0.003 8,r=0.999 7。结果表明,芦丁质量浓度在3.68~14.72 μg/mL与峰面积呈良好线性关系。
含量测定:分别取 3批总黄酮样品 16.8,17.1,16.5 mg,置100 mL容量瓶中,加入50%乙醇超声溶解,定容至刻度,得 0.168,0.171,0.165 g/L的供试品溶液。分别取供试品1 mL,置10 mL容量瓶中,加0.1 mol/L AlCl3·6H2O 1.0 mL,摇匀,用50%乙醇定容至刻度,摇匀,40 min后于410 nm波长处测定吸光度,计算含量。结果见表2。
2.3 总黄酮中槲皮素和山柰酚含量测定[3,5]
2.3.1 色谱条件与系统适用性试验
色谱柱:COSMOSIL5C18-MS-Ⅱ柱(250mm×4.6mm,5 μm);流动相:甲醇-0.4%磷酸溶液(58∶42);流速:1.0 mL/min;检测波长:360 nm;柱温:25℃;进样量:10 μL。保留时间:槲皮素约为9 min,山柰酚约为14 min,理论板数应不低于5 000。供试品溶液色谱图中,槲皮素和山柰酚与前面相邻的杂质峰分离度(R)分别为1.731和 7.972(n=3),拖尾因子(T)分别为 1.03和 0.98(n=3),均符合2010年版《中国药典(一部)》规定。色谱图见图2。
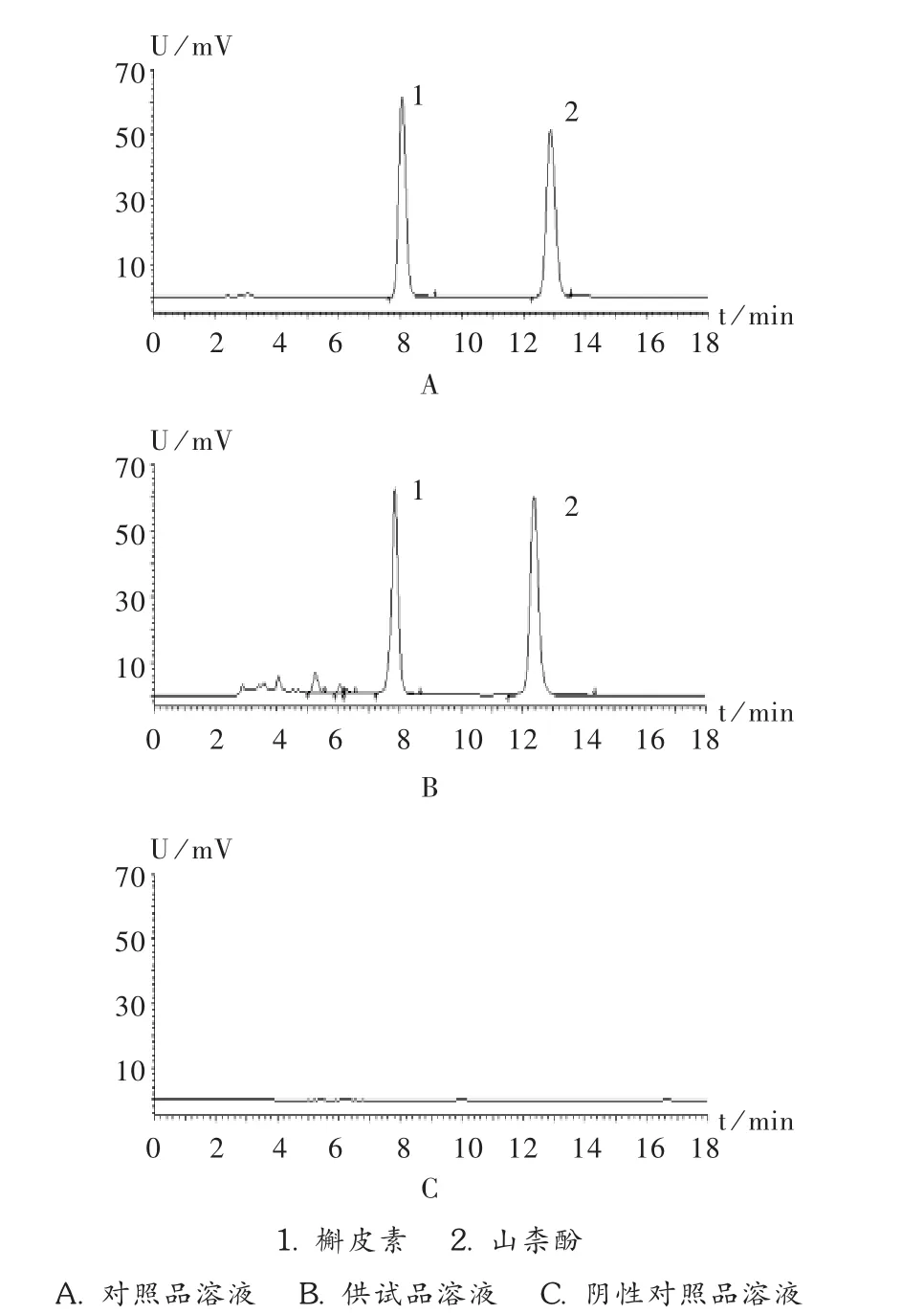
图2 柿叶提取物高效液相色谱图
2.3.2 溶液制备
称取真空干燥至恒重的槲皮素对照品6.0 mg,山柰酚对照品5.8 mg,精密称定,分别置25 mL容量瓶中,加甲醇溶解,稀释至刻度,摇匀,作为槲皮素、山柰酚对照品贮备液(质量浓度为0.240,0.232 g/L);精密量取上述贮备液各3 mL,置25 mL容量瓶中,用甲醇定容至刻度,摇匀,得混合对照品溶液(槲皮素、山柰酚质量浓度分别为0.028 8,0.027 8 g/L)。取柿叶提取物样品(批号为140911)适量,研细,取约100 mg,精密称定,置100 mL圆底烧瓶中,加甲醇20 mL,超声使其完全溶解,加入36%浓盐酸约4 mL,使盐酸终浓度为2 mol/L,摇匀,90℃水浴回流2 h,冷却,定量转移至250 mL容量瓶中,加甲醇至刻度,摇匀,滤过,即得供试品溶液。
2.3.3 方法学考察
定量限测定:取对照品溶液(槲皮素9.6 μg/mL、山柰酚9.28 μg/mL),不断稀释,按照信噪比不得小于10计算,得定量限,槲皮素为1.92 μg/mL,山柰酚为1.86 μg/mL。
线性关系考察:精密量取槲皮素、山柰酚对照品贮备液各 1.0,2.0,3.0,4.0,5.0,6.0 mL,分别置25 mL容量瓶中,加甲醇稀释至刻度,摇匀,依法测定,以对照品质量浓度(X)为横坐标、峰面积值(Y)为纵坐标进行线性回归。得回归方程槲皮素为 Y=54 028 X-16 536,r=0.999 8(n=6),质量浓度在 9.6~57.6 μg/mL范围内与峰面积呈良好线性关系;山柰酚为 Y=58 650 X-5 292.6,r=0.999 8(n=6),质量浓度在9.28~55.68 μg/mL范围内与峰面积呈良好线性关系。
精密度试验:精密量取同一质量浓度槲皮素、山柰酚混合对照品溶液10 μL,依法测定,连续测定6次。结果槲皮素、山柰酚峰面积的 RSD分别为 0.87%,0.68%(n=6),表明仪器精密度良好。
重复性试验:精密称取同一批样品(批号为140911),依法制备供试品溶液,平行制备6份。分别精密量取供试品溶液、对照品溶液(槲皮素、山柰酚对照品浓度分别为0.028 8 g/L和0.027 8 g/L)各10 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算。结果槲皮素、山柰酚含量的 RSD分别为1.52%和1.81%(n=6),表明该方法重复性良好。
稳定性试验:取重复性试验项下的同一供试品(批号为140911)溶液,分别于0,2,4,6,8 h时进样10 μL,记录色谱图。结果槲皮素、山柰酚峰面积基本不变,RSD分别为1.60%和1.65%(n=5),表明供试品溶液在8h内稳定。
加样回收试验:取供试品(批号为140911)细粉约50 mg,精密称定,共6份,分别置250 mL容量瓶中,分别精密加入混合对照品溶液(槲皮素4.800 g/L和山柰酚5.594 g/L)0.5,1.0,1.5 mL,每个质量浓度平行制备2份,再分别加甲醇至刻度,超声处理(功率250 W,频率33 kHz)30 min,放置至室温,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得供试品溶液,依法测定。结果见表1。
2.3.4 含量测定
经自制 3批柿叶提取物样品(批号为 140911,140912,140913),按供试品溶液的制备项下方法制备供试品溶液,平行测定2次。结果见表2。
3 讨论
提取物的制备方法:柿叶产于安徽蚌埠,晒干,切断,采用70%乙醇煎煮,煎液过滤,滤液浓缩至无醇味,得清膏,石油醚(60~90℃)萃取(脱脂和色素等),再用乙酸乙酯萃取,萃取液回收乙酸乙酯后的干粉与聚酰胺型树脂拌样,上聚酰胺型大孔树脂,乙醇洗脱,冷冻干燥,即得总黄酮提取物。

表1 槲皮素、山柰酚加样回收试验结果(n=6)

表2 3批样品含量测定结果
TLC鉴别:由图1可知,供试品溶液色谱中除槲皮素、山柰酚和芦丁外,尚有多个斑点,因无对照品,故无法一一对应鉴别;水解供试品溶液色谱中,除槲皮素、山柰酚主斑点外,还分布有个别斑点,可能为其他苷元,同时未检测到芦丁,分析原因可能为其已水解。
总黄酮含量测定波长的选择:精密吸取芦丁对照品溶液0.1 mL和供试品溶液适量,置10 mL容量瓶中,分别加入 0.1 mol/L AlCl3·6H2O 1.0 mL,用50%乙醇定容至刻度,摇匀,放置 40 min,随行空白校零,于190~700 nm范围内扫描测定吸收光谱。芦丁对照品溶液的 λmax为 410 nm,3个样品溶液的λmax均在400~410 nm,故选择AlCl3显色后的410 nm波长。
总黄酮中槲皮素和山柰酚检测波长的选择:取槲皮素和山柰酚对照品适量,加甲醇溶解,稀释至一定刻度,照紫外可见分光光度法[2010年版《中国药典(一部)》]附录ⅤA,以甲醇为空白,在200~500 nm波长范围扫描,结果于260 nm和360 nm均有较强吸收,但360 nm处样品中其他成分干扰较小。故选择360 nm作为检测波长。
HPLC指标成分的选择[6]:目前从柿叶中分离得到的黄酮类化合物有十几种成分,其中主要含有槲皮素和山柰酚苷元及其单、双糖苷类,如芦丁、金丝桃苷、紫云英苷、山柰酚-3-O-α-L-吡喃鼠李糖苷、槲皮素-3-O-β-D-吡喃葡萄糖苷等。由图1可知,总黄酮进行酸水解后,测定水解后主成分槲皮素(C15H10O7)和山柰酚(C15H10O6)的含量,故选择对两者含量测定作为控制提取物质量的有效方法。
流动相的选择:参照考文献[5],采用流动相甲醇-0.4%磷酸溶液(50∶50),结果槲皮素和山柰酚的出峰时间较长,检测1次大约需要40 min,后调整流动相为58∶42,出峰时间均在20 min内,故选择后者为流动相。
[1]姜红波,赵卫星,冯国栋,等.柿叶的主要有效成分及药理作用研究进展[J].化工时刊,2010,24(6):38-44.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:附录30.
[3]罗 杰,贝伟剑,徐 腾,等.脑心清片质量标准的研究[J].中国新药杂志,2004,13(7):625-627.
[4]张秀梅,曾祖平,王永红.柿叶总黄酮提取工艺的研究[J].时珍国医国药,2008,19(1):35-36.
[5]Chen G,Wei SH,Huang J,et al.A novel C-glycosylflavone from the leaves of Diospyros kaki[J].Journal of Asian Natural Products Research,2009,11(6):503-507.
[6]贝伟剑,罗 杰,吴爱銮,等.HPLC法测定柿叶浸膏中槲皮素和山柰酚[J].中草药,2005,36(7):1 014-1 015.
Quality Standard of Persimmon Leaf Flavonoids
Huang Shunwang1,3,Qiao Jinwei2,Zuo Yafeng2,Li Zheng2,Chen Shinong1,Sun Bei1,Wu Deling2,Li Lingzhi3,Song Shaojiang3
(1.Anhui Institute of Food and Drug Control,Hefei,Anhui,China 230022; 2.Anhui University of TCM,Hefei,Anhui,China 230031;3.School of Chinese Materia Medicia,Shenyang Pharmaceutical University,Shenyang,Liaoning,China 110016)
Objective To establish the qualitystandard of persimmon leaf flavonoids.M ethods To qualitatively identify therutin,kaempferol and quercetin in the total flavonoid by TLC method;the total flavonoid was determined by spectrophotometry with rutin as standard material.The content of quercetin and kaempferol was determined by HPLC.Results The characteristic identification by TLC was distinct and highly specific.The absorbance of total flavonoid was measured at 410 nm.The quercetin showed a good linear in the range of 9.6-57.6 μg/mL(r=0.999 8),the average recovery was 99.09%,and RSD was 0.47%(n=6).The kaempferol showed a good linear relationship with the peak area in the range of9.28-55.68 μg/mL(r=0.999 8),the average recovery was 99.03%,and RSD was 0.55%(n=6).Conclusion The method is simple and rapid,and the reproducibility and stability are good,it is suitable for the quality control of persimmon leaf flavonoids.
persimmon leaf flavonoids;quercetin;kaempferol;TLC;spectrophotometry;HPLC
R284.1;R282.71
A
1006-4931(2016)02-0034-04
黄顺旺,男,副主任药师,主要从事新药研究工作,(电子信箱)huangsw5503@163.com;宋少江,男,博士研究生导师,主要从事天然产物活性成分和质量控制度结构优化研究工作,本文通讯作者,(电话)024-23986510。
2015-02-05;
2015-08-10)
