质子守恒中的几个问题
2017-01-04王文霞
王文霞●
江苏省黄埭中学(215131)
质子守恒中的几个问题
王文霞●
江苏省黄埭中学(215131)
质子守恒的依据是质子的得失总数相等,列出等式的关键是确定好与质子有关的基准物质.质子基准物质就是溶液中大量存在的并参与质子转移的物质,通常是原始酸碱组分和溶剂分子.在比较离子浓度大小时,经常要用到质子守恒,但是有些人认为质子守恒只适用于弱酸或者弱碱形成的正盐,例如Na2CO3、NH4Cl、CH3COONH4,其实不仅在正盐中有质子守恒,在酸式盐、酸、碱、混合溶液中都可以列质子守恒,下面分别说明.
一、酸溶液中质子守恒(分别以HCl和CH3COOH为例)
(1)强酸溶液:以HCl溶液为例,HCl溶液中基准物质为HCl和H2O

根据得失氢离子个数相等,得到质子守恒为:c(H3O+)=c(OH-)+c(Cl-),可以简化为c(H+)=c(OH-)+c(Cl-),以下的质子守恒都以简化的方式呈现.
(2)弱酸溶液:以CH3COOH溶液为例,CH3COOH溶液中基准物质为CH3COOH和H2O

根据得失氢离子个数相等,得到质子守恒为:c(H+) =c(OH-)+c(CH3COO-)
在这种溶液中质子守恒与电荷守恒是一致的.
二、碱溶液中的质子守恒(分别以NaOH和NH3·H2O为例)
(1)强碱溶液.以氢氧化钠溶液为例,NaOH溶液中基准物质为NaOH和H2O
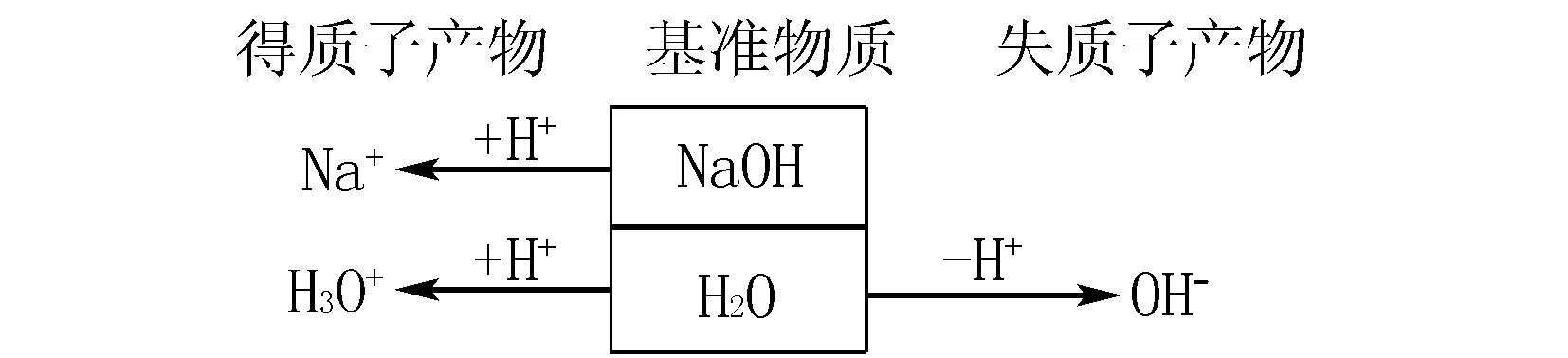
得到质子守恒为:c(H+)+c(Na+)=c(OH-)
(2)弱碱溶液.以氨水溶液为例,氨水溶液中基准物质为NH3·H2O和H2O
在这种溶液中质子守恒也与电荷守恒是一致的.
三、酸式盐溶液中的质子守恒(以Na2HPO4溶液为例)
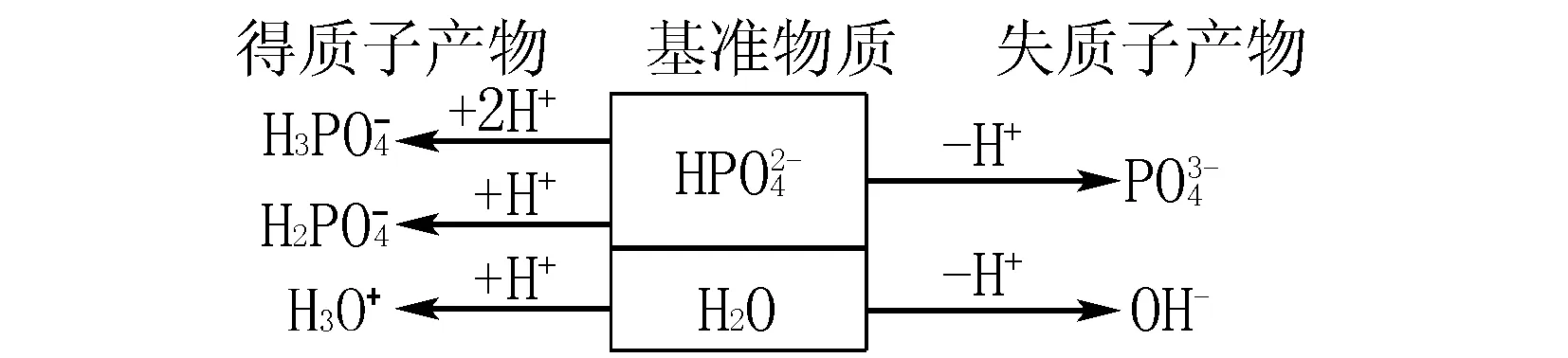


四、混合溶液中的质子守恒
1.共轭溶液:(以NH4Cl、NH3·H2O混合溶液为例)
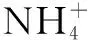
c(H+)=c(NH3)+c(OH-)
①式
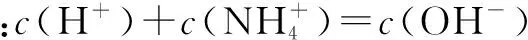
②式

例如把Na2CO3和NaHCO3以物质的量之比为2∶1的配比配的混合溶液中,质子守恒应该这样处理:
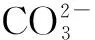
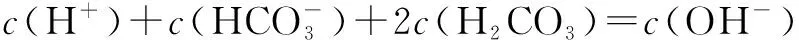


2.非共轭溶液(CH3COONa、NH4Cl混合溶液为例)
得质子产物
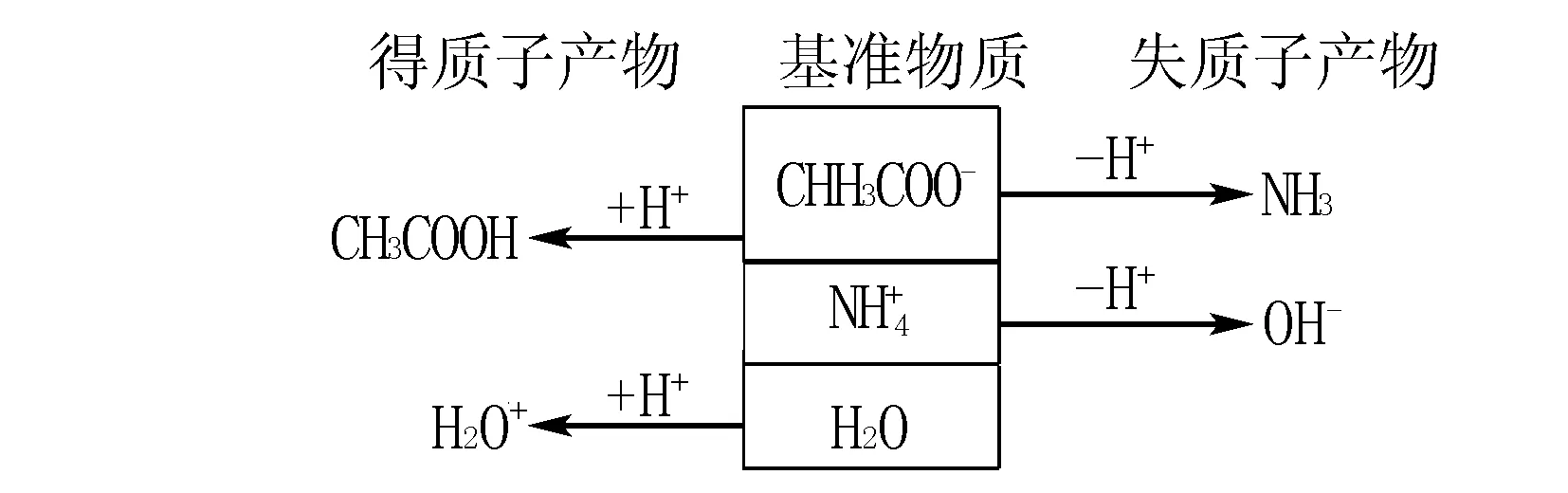
该混合溶液的质子守恒为:c(CH3COOH)+c(H3O+)=c(NH3)+c(OH-).可以换成另外一种书写形式:c(CH3COOH)+c(H+)=c(NH3.H2O)+c(OH-)
这种类型的质子守恒不需要分列,跟溶质的物质的量也是没有关系的.
3.混合酸溶液
以弱酸HA与强酸HCl混合溶液为例: c(H+)=c(A-)+c(Cl-)+c(OH-)
4.混合碱溶液
质子守恒是基于电离守恒和水解守恒的基础上,以H+为载体所列的一个守恒,如果能够很好地掌握,在解答离子浓度这类题目时,可以起到事半功倍的效果.
G632
B
1008-0333(2016)28-0088-01
